胃癌患者唾液中筛选嘌呤代谢相关的诊断标志物
2020-06-11包楚阳向丽娟汪圣毅王亚雷
包楚阳,向丽娟,刘 虎,汪圣毅,王亚雷
癌细胞的增殖不仅需要大量能量,对增殖合成的底物也有大量需求。而嘌呤是所有生物体最丰富的代谢底物,它不仅是RNA和DNA的核心构建模块之一,嘌呤代谢还提供了大量重要生物合成所需的能量和辅助因子[1-2]。现通过收集178例胃癌和良性胃病患者的唾液样本,针对胃癌的嘌呤代谢进行分析,试图寻找有价值的诊断标志物。
1 材料与方法
1.1 病例资料收集安徽医科大学第一附属医院2017年3月~2018年1月外科术后148例胃癌患者和消化内科胃镜室30例胃炎患者。所有入组患者均有明确组织病理学诊断。本研究经安徽医科大学伦理委员会批准(批准号:20140141)。已获得所有患者和唾液供体志愿者的书面知情同意书,该研究严格遵守赫尔辛基宣言。
纳入标准:① 所有胃癌和良性疾病组患者均有明确的病理诊断;② 所有入组患者均可以收集到完整的病案资料和辅助检查资料;③ 年龄≤80岁。排除标准:① 存在其他严重的心、肺、肝、肾功能异常病史及糖尿病等异常代谢疾病;② 近期有过上呼吸道感染;③ 存在其他的口腔疾病。
1.2 标本收集所有唾液标本提供者在收集前1 d晚上10:00之后不允许进食任何食物。所有标本在收集当天清晨使用2 ml冻存管收集,并且收集前1 h不得进行饮水、吸烟、刷牙和剧烈运动。所有的唾液样本在收集后封存于-80 ℃冰箱中,使用装有干冰的泡沫箱封装运输。
1.3 仪器与试剂Agilent 1290 UHPLC超高效液相色谱仪;AB Sciex& Agilent Triple TOF 6600/6550高分辨质谱仪(美国Agilent);Thermo Fisher Scientific Heraeus Fresco17离心机(日本Thermo);深圳市雷德邦电子有限公司PS-60AL超声仪;Waters ACQUITY UPLC BEH Amide色谱柱(1.7 μm; 2.1×100 mm)(美国Waters);CNW Technologies公司纯度LC-MS级的甲醇、乙腈醋酸铵、氨水(德国杜塞尔多夫);上海恒柏生物科技有限公司纯度≥98% 的L-2-氯苯丙氨酸。
1.4 唾液样本的处理将唾液样本在4 ℃下冰上解冻,于EP管中以100/400 μl(样本/提取液)涡旋混匀;在-20 ℃孵育以沉淀蛋白质,离心;取新鲜上清液,在不加热的真空浓缩器中干燥提取物,加入提取液重构;再次涡旋超声水浴并离心后,将上清液转移到新鲜的LC/MS采样瓶中,每个样品取10 μl,合并为质控 (quality control,QC) 样品。之后对样品进行UHPLC-QTOF-MS 分析。
1.5 LC-MS参数和数据预处理LC-MS所用色谱柱为UPLC BEH Amide色谱柱(1.7 μm; 2.1×100 mm)。进样体积为pos: 2 μl,neg:3 μl。在每个数据采集循环中,筛选出强度最强且大于100的分子离子谱峰进行采集对应的二级质谱数据。轰击能量:30 eV,每50 ms产生15张二级谱图。ESI离子源参数设置如下:雾化气压:60 Psi,辅助气压:60 Psi,气帘气压:35 Psi,温度:650 ℃,喷雾电压:5 000 V(正离子模式)。再使用XCMS软件做保留时间矫正、峰识别、峰提取、峰积分、峰对齐。使用自撰写R程序包和自建二级质谱数据库对峰进行物质鉴定。(唾液样本液相色谱-质谱分析由Shanghai Biotree Biotechnology公司完成)
1.6 数据处理与统计分析使用多元统计分析中的正交偏最小二乘法分析(orthogonal projections to latent structures- discriminant analysis, OPLS-DA)第一变量投影重要度(variable importance in the projection, VIP )以及单变量统计分析的学生t检验来筛选差异代谢物,差异代谢物的筛选标准以VIP值大于1,t检验以及秩和检验的P<0.1为有统计学意义。将差异代谢物与嘌呤代谢通路映射匹配分析进行代谢通路分析(差异代谢通路分析和差异代谢物分析由Shanghai Biotree Biotechnology公司定制R Package分析完成)。使用SPSS16.0来进行差异受试者工作特征曲线(receiver operating characteristic curve, ROC curve)分析,评估差异代谢物以及差异代谢物的组合对样本进行区分的效果,使用Fisher判别分析计算差异代谢物的诊断函数。
2 结果
2.1 患者的流行病学资料本次研究征募唾液样本志愿者共178例,年龄为25~78(59.84±11.57,P<0.001)岁,在148例胃癌患者中男性119例,女性29例;30例良性胃病患者中,男性21例,女性9例。按TNM分期来观察,胃癌组患者中,T1患者18例;T2患者42例;T3患者76例;T4患者8例,分期不明的患者4例。
2.2 LC-MS数据处理和差异代谢物的筛选在178例受试者的唾液中共鉴定出3 638个峰,经过对原始数据进行数值标准化处理后3 637个峰被保留,通过二级质谱匹配分析得到374个常规代谢物或二级碎片,根据峰面积的强度值来评估代谢物的水平,经过经过两组间的信号强度比值和OPLS-DA分析的VIP值以及组间单变量学生t检验分析后得出164个代谢物用于后续分析。见表1。
2.3 嘌呤代谢物分析对嘌呤代谢通路内92个代谢物或二级碎片,在经过两组间的定量比值和OPLS-DA分析的VIP值以及组间单变量学生t检验分析后得出4个符合筛选卡值标准的代谢物。在代谢组学数据分析中,通常使用ROC曲线来评估差异代谢物或其组合对组间样本的区分的效果,即通过ROC曲线评估差异代谢物的组间判别能力。在对以上4种差异代谢物进行ROC曲线分析,结果显示在胃癌患者中唾液样本中嘌呤代谢通路内的黄嘌呤核苷、环鸟苷酸和脱氧核苷一磷酸相较于胃良性病患者出现了下调,而尿酸则呈现上调。见图1。

表1 差异代谢物和差异代谢通路的筛选
RT:该物质的色谱中的保留时间;MC:该物质在该组对比内的癌症组的相对定量值均值;MB:该物质在该组对比内的良性组的相对定量值均值;FC:Fold_Change特定代谢物在胃癌组与胃良性病组定量的比值。该表列举几个嘌呤代谢的中间产物作为示例,部分产物因其统计分析的差异值不明显且判别分析贡献值较小没有纳入下述的诊断模型;筛选卡值标准:VIP值>1,P<0.1
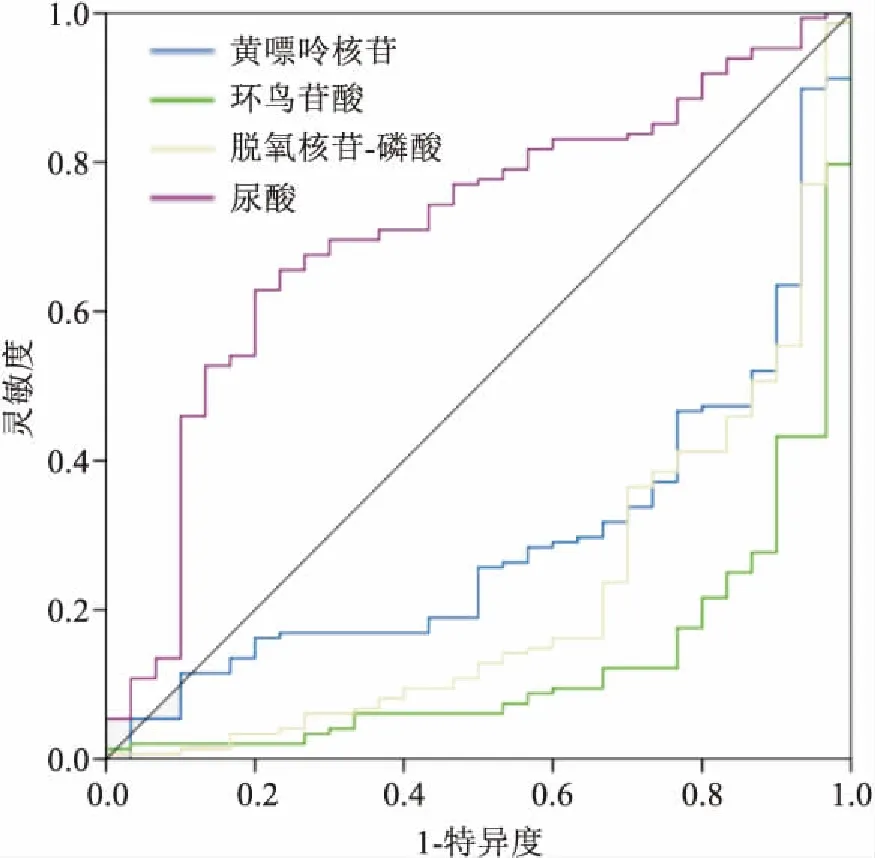
图1 嘌呤代谢通路中4个差异代谢物的ROC曲线
脱氧核苷一磷酸曲线下面积(area under curve, AUC)=0.38(95%CI=0.27~0.49);黄嘌呤核苷AUC=0.294(95%CI=0.20~0.39);环鸟苷酸AUC=0.13(95%CI=0.06~0.19);尿酸AUC=0.711(95%CI=0.61~0.81)
2.4 嘌呤代谢物的诊断函数模型针对上述分析结果中的4种差异代谢物使用Fisher判别分析建立差异代谢物的诊断函数模型。
诊断函数:y1=65.973x1+24.766x2-22.641x3-0.2x4-1.489
y2=32.690x1-22.685x2+29.897x3+13242x4-1.137
上述函数中x1为唾液中的黄嘌呤核苷,x2为环鸟苷酸,x3为脱氧核苷一磷酸,x4为尿酸。若单个样本的y1值大于y2,则视为良性胃病,若y1小于y2则将其视为胃癌,P=0.013。使用留一法交叉验证分析得出该模型的灵敏度为83.1%,特异度为63.3%。
3 讨论
目前已有多项针对膀胱癌、乳腺癌等多个癌种进行了代谢组学相关研究,发现癌症患者的血液、尿液以及呼气中有多种明显差异的代谢物,在经转录组学整合分析后发现大多数差异代谢物与嘌呤代谢密切相关[3-4]。本次研究收集了148例胃癌患者和30例胃良性病患者的唾液进行UHPLC-QTOF-MS分析,筛选出4个较明显的差异代谢物,分别为环鸟苷酸、黄嘌呤核苷、腺嘌呤脱氧核苷以及尿酸。相较于良性胃病的患者,在胃癌患者的唾液中环鸟苷酸、黄嘌呤核苷和腺嘌呤脱氧核苷出现下调,而尿酸呈上调。
在人体内,嘌呤核苷酸的合成方式有2种,一种是从头生物合成(de novo synthesis)途径,另一种是互补的补救合成途径。从头合成主要中间产物为肌苷一磷酸(inosine monophosphate, IMP),IMP可以继续通过中间产物黄嘌呤一磷酸(xanthine monophosphate, XMP)合成为鸟嘌呤一磷酸(guanosine monophosphate, GMP)或者直接合成腺嘌呤一磷酸(adenosine monophosphate, AMP)、GMP和AMP 继续进入各自的循环并最终合成DNA或RNA,由于肿瘤细胞不受限制增殖产生了其对RNA、DNA大量需求,这可能导致鸟嘌呤、腺嘌呤代谢循环的改变以及环鸟苷酸和脱氧核苷一磷酸相应的下调。另外的补救合成途径主要存在于缺乏从头合成的细胞或组织中,通过循环回收碱基来合成嘌呤核苷酸以满足机体平时的代谢需求。在本次研究中几种嘌呤核苷酸的相应衍生物如鸟苷、腺苷、肌苷均出现了不同程度的下调,其中黄嘌呤核苷最为明显。大致代谢过程见图2。
对于肿瘤细胞,由于从头生物合成能够产生巨大能量和各种细胞原材料,可以满足癌细胞的各种增殖需求。在肿瘤组织中,由于补救合成途径的中间代谢物被用于细胞增殖而次黄嘌呤的回收途径利用率下降,导致了嘌呤降解增加从而产生了尿酸的上调,最近也有研究[5-6]显示血清中的尿酸浓度可以作为评估乳腺癌的预后因素。而鸟苷一磷酸、脱氧腺苷一磷酸以及黄嘌呤核苷这3种代谢物目前在

图2 嘌呤的补救合成途径
橙色箭头:从头合成方式(de novo synthesis);绿色箭头:嘌呤补救合成途径;红色箭头:嘌呤降解,最终产物为尿酸;深色标记的4个代谢物为本次研究的诊断标记物;绿色:下调,红色:上调
嘌呤代谢通路内的作用未发现有研究揭示说明。对于本次研究所发现的在胃癌患者唾液样本中这3种代谢物出现的不同程度下调的原因,推测可能与肿瘤组织不受限制的增殖需求以及肿瘤环境中嘌呤代谢途径改变有关,但其具体的分子水平代谢机制仍不清楚,有待进一步的体外细胞试验来探索和证实[7-8]。
