SOCS3基因甲基化状态与儿童急性淋巴细胞白血病治疗反应及预后的相关性
2020-06-11江傲霜王宁玲刘亢亢吴正玉储金华杨林海
江傲霜,王宁玲,刘亢亢,吴正玉,储金华,杨林海
儿童急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童恶性肿瘤中最常见类型[1],其发病机制极其复杂,研究表明白血病的发生可能与Janus 蛋白质酪氨酸激酶(janus protein tyrosine, JAK)/信号转导因子和转录激活子3(singal transducer and activator of transcription 3, STAT3)信号通路的异常持续活化有关[2],细胞因子信号转导抑制因子3(cytokine signaling 3, SOCS3)作为一种可能的抑癌基因,是JAK/STAT3信号转导通路的重要抑制因子,在多种恶性肿瘤中可发现SOCS3启动子区域的胞嘧啶-磷酸-鸟嘌呤位点(CpG位点)高甲基化,从而引起SOCS3基因的表达下调或缺失[3]。这些已经成为国内外针对恶性肿瘤发病机制及特异性靶向治疗的研究热点,但国内外针对SOCS3基因甲基化及转录水平与儿童ALL病程和预后的相关性研究少有报道。该研究通过检测儿童ALL疾病不同阶段的SOCS3甲基化及mRNA表达水平,并与正常儿童进行对照研究,以探讨其与儿童ALL的治疗反应及预后的关系,从而为SOCS3是否能作为儿童ALL特异性靶向治疗点提供理论依据。
1 材料与方法
1.1 病例资料选择2015年1月~2016年11月就诊于安徽医科大学第二附属医院儿科血液病区的新诊断的ALL患儿作为研究对象,纳入及排除标准参照文献[4],共83例ALL患儿纳入研究,随访时间截止至2018年6月,同时选择21例健康儿童作为正常对照组。入组ALL患儿均完善骨髓细胞学、免疫分型、染色体核型分析及融合基因检测(TEL-AML基因、E2A-PBX基因、BCR-ABL基因、MLL基因重排等),根据初诊时临床及生物学特点,危险度分为低危(low risk, LR)、中危(moderate risk, MR)、高危(high risk, HR)3组,根据治疗第19天和第46天骨髓微小病变残留水平(minimal residual disease, MRD)调整危险度,按照CCCG-ALL-2015方案进行序贯化疗,总疗程2.5年。该研究已经获得安徽医科大学第二附属医院医学伦理委员会的批准(N0.201501),根据赫尔基宣言,所有入组患儿监护人均签署临床研究知情同意书、化疗知情同意书、废弃标本用于科研同意书,对照组健康儿童在入组前由监护人签署废弃标本用于科研同意书。
1.2 骨髓单个核细胞提取用无菌EDTA抗凝管留取ALL患儿和正常儿童骨髓血2 ml,加入Ficoll分离液(天津生物科技有限公司),参照说明书提取骨髓单个核细胞。
1.3 RNA提取和逆转录定量聚合酶链式反应(reverse transcriptional quantitative polymerase chain reaction, qRT-PCR)用TRIzol试剂(美国Invitrogen公司)从骨髓标本中提取RNA。用QuantiTect(德国Chiagen GmbH公司)逆转录试剂盒将RNA逆转录成cDNA。以甘油醛-3-磷酸脱氢酶(GAPDH)基因为参照基因,用qRT-PCR进行cDNA定量检测。SOCS3 mR-NA前引物序列: 5′-CAGCTCCA AGAGCGAGACCA-3′;SOCS3 mRNA后引物序列: 5′-AGAAGCCGCTCTCCTGCAG-3′;内参基因GADPH前引物序列: 5′-AATGGAAAT CCCATCACCATCT-3′;GADPH后引物序列:5′-CGCCCCACTTGATTTTGG-3′。根据数据结果运用2-ΔΔCT公式计算mRNA相对表达量。
1.4 细胞DNA提取及甲基化特异性PCR反应参照DNA 提取试剂盒说明书提取细胞DNA 后,用紫外分光光度计测定DNA 的纯度和浓度,取0.5 μg DNA 样品(A260 nm/280 nm比值在1.7~2.0)进行亚硫酸盐修饰,按照MethylCodeTM Bisulfite转化试剂盒(美国Invitrogen公司)说明书对cDNA 进行处理,使抽提到的DNA中未发生甲基化的胞嘧啶通过亚硫酸氢盐处理后全部转化为尿嘧啶,而甲基化的胞嘧啶不变。SOCS3甲基化水平检测以亚硫酸氢钠修饰DNA为模板,采用亚硫酸氢钠测序法检测SOCS3基因甲基化水平。用上海Invitrogen公司设计和合成的巢式亚硫酸氢钠测序PCR引物对CpG岛进行扩增。第一轮引物序列,上游为5′-TTGATT TYGTAGGTGAT-3′,下游为5′-ACCTTTATATATATA TATATATATACACATACTC-3′(扩增片段555 bp);第二轮引物序列,上游为5′-GAGTATATAAGAAG GT-3′,下游为5′-TCCTATATATACCC-3′(扩增片段408 bp)。用1.5%琼脂糖凝胶把PCR 产物电泳后,用凝胶回收试剂盒进行回收纯化,然后用氨苄西林耐药的TA克隆进行连接反应。从每个平板中筛选出10个克隆,接种于2 ml LB培养基中,37 ℃培养过夜。最后送上海Invitrogen公司进行测序,分析测序结果中,○代表未发生甲基化的CG 位点,●代表发生甲基化的CG位点。
1.5 统计学处理采用SPSS 17.0软件进行统计分析,GraphPad 6.0作为制图软件。计数资料采用百分数进行卡方检验及Fisher 确切概率处理数据;计量资料采用均数±标准差表示并用方差分析处理数据。采用2-ΔΔCT法计算SOCS3 mRNA水平;采用秩和检验法分析SOCS3基因甲基化水平与临床特点及治疗反应的关系;采用Kaplan-Meier曲线绘制总生存率(overall survival, OS)和累积复发率(cumulative incidence of relapse, CIR)曲线,单因素预后分析采用对数秩Log-Rank卡方检验法,以P<0.05差异有统计学意义。
2 结果
2.1 一般结果83例ALL患儿纳入研究,男43例,女40例,中位年龄6.2岁(7月~14岁),21例健康儿童作为健康对照组,男13例,女8例,中位年龄6.3岁(10月龄~ 14岁)。ALL患儿组与健康对照组在性别比率及年龄构成比之间差异无统计学意义(P<0.05)。ALL患儿与健康对照组儿童一般临床资料见表1。
2.2 儿童ALL化疗前后SOCS3 mRNA表达水平83例ALL患儿按照CCCG-ALL-2015方案按序规范化治疗后,9例复发,74例完全缓解。测定83例患儿初诊时和健康对照组儿童的SOCS3 mRNA表达水平显示,初诊(1.024±0.584)及复发组(0.796±0.384)患儿SOCS3 mRNA的表达水平明显低于健康对照组(3.459±1.118)儿童SOCS3 mRNA的表达水平(P<0.05);完全缓解组患儿SOCS3 mRNA的表达水平基本恢复正常,与初诊组SOCS3 mRNA的表达水平差异具有统计学意义(3.021±0.549vs1.024±0.584;P<0.05),而与健康对照组儿童SOCS3 mRNA的表达水平比较差异无统计学意义(3.021±0.549vs3.459±1.118;P>0.05)。
2.3 SOCS3基因甲基化状态与治疗反应的相关性运用甲基化特异性PCR检测初诊组、复发组、完全缓解组及健康对照组儿童的SOCS3基因甲基化水平,结果显示:初诊组、复发组、完全缓解组患儿的SOCS3基因甲基化水平检测阳性率不等,而健康对照组儿童SOCS3基因甲基化均未检出。初诊组、复发组、完全缓解组ALL患儿的SOCS3基因甲基化水平明显高于健康对照组(P<0.05);初诊组及复发组ALL患儿的SOCS3基因甲基化水平明显高于完全缓解组(Z=4.539、3.044;P<0.05),见表2、图1。

表1 ALL及健康对照组儿童一般临床资料
复发:定义为骨髓幼稚细胞≥20%,或髓外有白血病细胞浸润证据;完全缓解:定义为外周血中性粒细胞计数≥1.0×109/L、血小板计数≥100×109/L及血红蛋白浓度≥90 g/L,骨髓幼稚细胞≤5%,且无髓外白血病浸润的任何证据。

表2 ALL组和对照组患者SOCS-3基因甲基化的表达水平
与健康对照组比较:*P<0.05;与缓解组比较:#P<0.05
2.4 ALL患儿初诊时SOCS3基因甲基化高水平组和低水平组临床特点比较按照中位数法将初诊组83例患儿SOCS3 基因甲基化水平分为高水平组和低水平组,高水平组中位甲基化密度为31.14%(25.32%~48.52%),低水平组中位甲基化密度为15.22%(0~25.19%),比较SOCS3基因甲基化高水平组和低水平组ALL患儿在年龄、性别、初诊外周血白细胞计数及骨髓原始幼稚细胞、危险度分组、免疫分型、细胞遗传学改变、治疗反应中的差异。结果显示,初诊SOCS3甲基化高水平组有更高的外周血白细胞计数,与低水平组之间的差异有统计学意义(P<0.05)。SOCS3甲基化高水平组有更多的中高危组病例,两组比较差异有统计学意义(P<0.05)。此外,SOCS3甲基化高水平组的复发病例高于SOCS3甲基化低水平组,差异有统计学意义(P<0.05),而化疗后SOCS3甲基化高水平组与低水平组比较,其治疗完全缓解率差异无统计学意义(P>0.05),见表3。

图1 ALL患儿化疗前后SOCS3基因甲基化水平
A:健康对照组;B:初诊组;C:复发组;D:完全缓解组;○代表未发生甲基化的CG 位点;●代表发生甲基化的CG 位点
将包括初诊年龄、外周血白细胞计数、危险度分组、SOCS3 基因甲基化分组纳入Cox比例风险模型进行多因素分析,结果表明:初诊外周血白细胞计数>50×109/L、SOCS3 基因甲基化高水平组患儿复发率高,差异具有统计学意义(P<0.05),相对危险度及95%置信区间分别为2.348(1.331~4.142)、0.397(0.209~0.751)。
2.5 SOCS3基因甲基化水平与预后的相关性基于SOCS3基因甲基化水平的42个月总生存率(overall survival, OS)和累积复发率(cumulative incidence of relapse, CIR)的Kaplan-Meier曲线见图3,SOCS3基因甲基化高水平组CIR明显高于低水平组(P<0.05);而SOCS3基因甲基化高、低水平组总生存率之间差异无统计学意义(P>0.05)。
3 讨论
SOCS3作为负性调节JAK/STAT信号转导通路的重要抑制蛋白之一,在胰腺癌、乳腺癌、肝癌等多种实体肿瘤中发现肿瘤细胞中均有SOCS3的表达下调[5-7]。 为探讨SOCS3在儿童ALL不同病程中的变化,本研究采用qRT-PCR技术检测了ALL患儿不同病程SOCS3 mRNA的表达水平,结果显示,初诊及复发阶段SOCS3 mRNA的表达水平明显低于健康对照组儿童,完全缓解阶段SOCS3 mRNA的表达水平基本恢复正常。以上结果证实SOCS3也参与了儿童ALL的发生和发展,其表达水平与儿童ALL治疗反应密切相关。SOCS3在复发状态的再次减低,提示SOCS3 mRNA的表达水平在病程中的再次减低可能作为评估体内残留肿瘤细胞水平升高的指标,但其特异性有待进一步研究。

表3 初诊组ALL患儿SOCS3 基因甲基化高水平组和低水平组临床特点比较
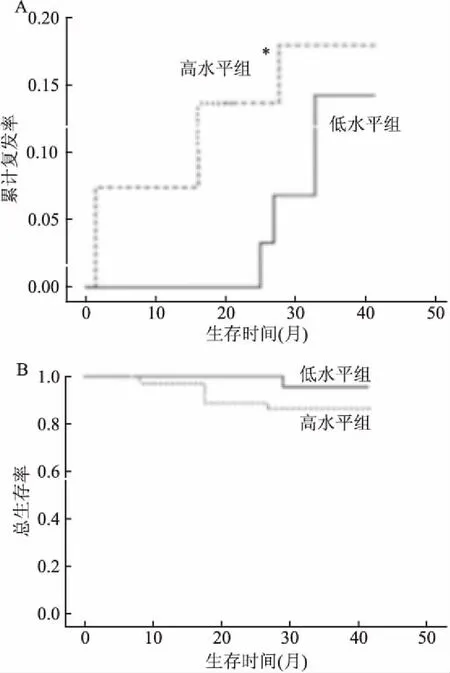
图3 ALL患儿SOCS3基因甲基化高、低水平组的生存分析A:累积复发率比较;B:总生存率比较;与低水平组比较:*P<0.05
针对SOCS3在恶性肿瘤中的低表达分子机制引起众多学者的关注和兴趣,本课题组前期研究结果表明小儿ALL初诊阶段SOCS3的表达水平与STAT3的水平呈负相关,SOCS3在ALL儿童中的低表达可以导致ALL中STAT3的异常持续活化[4],然而,SOCS3基因表达下降的原因尚不清楚。在基因表达调控的研究中表明,最常见的基因修饰是DNA甲基化,在多种恶性肿瘤中均存在基因启动子启动子区域甲基化改变[8],且研究表明SOCS3的异常甲基化有助于JAK/STAT信号转导通路的异常激活,从而影响肿瘤的发生、发展及侵袭过程[2]。本研究组运用甲基化特异性PCR检测初诊组、复发组、完全缓解组即代表儿童ALL不同病程阶段的SOCS3基因启动子区域甲基化水平,探讨SOCS3基因表达降低的可能机制。结果显示ALL患儿不同病程的SOCS3基因甲基化水平明显高于健康对照组,提示SOCS3甲基化引起的SOCS3基因表达下调对儿童ALL的发生和发展具有重要意义。
有关学者在针对肝细胞癌的研究中发现,SOCS3表达与肿瘤分化程度、血管浸润及复发有关,SOCS3甲基化在肿瘤组织中的频率和强度都有所增加,SOCS 3甲基化与肝细胞癌患者不良的临床结局显著相关,SOCS3表达水平及SOCS 3甲基化水平可作为评估肝癌预后的相关指标[7]。在本课题组前期研究中发现SOCS3高表达组具有更高的外周血白细胞计数、乳酸脱氢酶水平及更多的预后不良基因病例[9]。为进一步讨论SOCS3甲基化对SOCS3表达及ALL患儿治疗反应及预后的影响,本研究针对SOCS3甲基化水平与治疗反应及预后的相关性作出分析,结果显示SOCS3甲基化水平的差异与儿童ALL初诊外周血白细胞计数、疾病危险度相关。SOCS3甲基化低水平组患儿具有更高的外周血白细胞计数,且具有更多的中危组和高危组病例。
本研究中患儿初诊时SOCS3甲基化水平升高,完全缓解后较前减低,复发后再次升高,提示SOCS3甲基化水平可反映白血病负荷程度,结合42个月随访结果显示SOCS3甲基化高水平组复发率明显高于低表达水平组,提示SOCS3甲基化水平与复发明显相关,多因素分析提示SOCS3甲基化水平是影响复发率的重要危险因素之一。相关研究表明SOCS3通过调控STAT3参与肿瘤的发生及演进,SOCS3高度甲基化从而促使SOCS3基因沉默,无法负性调节JAK2/STAT3通路,从而促使STAT3的过度激活,诱发慢性炎症有关的细胞因子,如IL-6、M-CSF、COX2等,这些因子又通过相关受体激活间质细胞中的STAT3,STAT3在肿瘤细胞和肿瘤基质细胞之间形成反馈环,促进炎性肿瘤微环境的形成,从而增强肿瘤的侵袭和转移[10-11]。该研究证实了这一过程,提示SOCS3高度甲基化参与儿童ALL复发过程,SOCS3甲基化水平能否作为监测复发后患儿治疗疗效的指标也是本课题组进一步的研究方向。但SOCS3甲基化高水平组和低水平组的总生存率之间差异无统计学意义,分析原因可能是与完成整个CCCG-ALL-2015方案疗程停药的患者较少、随访时间较短相关。SOCS3甲基化水平是否能作为评估儿童ALL的远期预后指标有待继续跟踪随访观察。
该研究表明SOCS3基因高度甲基化导致SOCS3基因表达下调,与儿童ALL的发生、发展、复发密切相关,这一结果启发我们应用去甲基化试剂恢复体内SOCS3表达功能,从而重新实现对JAK/STAT信号转导通路的负性调节作用,抑制肿瘤细胞增殖,促进凋亡,可能有助于控制儿童ALL的恶化趋势。SOCS3基因能否作为治疗儿童ALL的新靶点有待研究组进一步探究。
