中药干预下脾虚痰浊动脉粥样硬化巴马猪小肠差异蛋白组学及生物信息学分析
2020-06-11贾连群马艺鑫张立德张会永杨关林
王 佳,贾连群,宋 囡,马艺鑫,张立德,张 哲,张会永,杨关林
动脉粥样硬化(atherosclerosis, AS)是引起血管损伤和心血管疾病的多因素过程,是世界范围内引发死亡的主要原因,在形成早期,会发生内皮功能障碍,全身的血管紧张素损伤内皮细胞在AS的发病机制中扮演着关键角色。AS的病理基础为脂质代谢障碍,而脂代谢主要在小肠进行,小肠的功能异常会成为引发AS的高危因素。流行病学研究[1]表明饮食习惯可能通过调节细胞脂质代谢、血管和内皮功能、炎症因子反应等影响心血管疾病的发病率和治疗效果。中医脾的功能主要对应着消化吸收和能量代谢2个方面,巴马小型猪的动脉硬化模型与人模型相近,故选取其作为实验动物[2]。应用iTRAQ技术探讨代表蛋白,GO富集分析及KEGG通路分析寻找关联通路,部分地阐明中药干预下脾虚痰浊AS巴马猪小肠蛋白质组学变化机制,为蛋白质的改变影响提供实验依据,为临床治疗脾虚痰浊AS疾病提供理论依据。
1 材料与方法
1.1 动物与分组SPF级半岁(6~8个月)雄性广西巴马小型猪10只,体质量(29.88±2.27)kg,肠道菌群正常,单笼饲养,许可证号SCXK(苏)2011-0002,购自泰州泰和生物科技有限公司。实验室温度为(20.80±2.97)℃,湿度(47.30±15.31)%[3]。委托辽宁中医药大学实验动物中心饲养,自由摄食与饮水。随机均分为模型组、中药治疗组。
1.2 试剂与仪器iTRAQ试剂(Applied Biosystems,北京);ARF3抗体(博奥森,北京),ATP5E抗体(博奥森,北京);F3型全自动荧光与可见光凝胶成像分析系统(Syngene,美国);β-actin多克隆抗体(Abcam,美国);垂直电泳装置(Bio-Rad,美国);HRP标记山羊抗兔IgG(H+L)(碧云天,北京);Trans-Blot SD半干转膜仪(Bio-Rad,美国);化学发光底物(Thermo,美国);MALDI-TOF/TOF质谱仪(Thermo fisher,美国);蛋白酶抑制剂PMSF(Genview分装,美国);强阳离子交换柱(SCX,美国Phenomenex公司);酶标仪(Thermo,美国);BSA蛋白定量测定试剂盒(鼎国昌盛,北京);HPLC(SHIMADZU,美国);F3型全自动荧光与可见光凝胶成像分析系统(Syngene,美国)。
1.3 模型制备及分组模型组详见课题组相关文献[4-5]。模型组采用中医经典复合因素造模法,饮食不节加劳倦过度造脾虚模型,配合现代医学冠脉内皮损伤手术造动脉粥样硬化模型。模型组与中药治疗组高脂喂饲,中药治疗组第25周使用课题组临床专利方健脾祛痰化瘀方药搅拌于饲料中喂食。48周末,开腹取小肠组织。
1.4 iTRAQ定量分析(华大基因,深圳)
1.4.1蛋白质提取过程 同课题组共同取材制作,详述如下[3]:称取适量实验动物小肠组织,使用蛋白裂解液溶解,超声破碎组织15 min,25 000 r/min离心20 min,取上清液,加5倍丙酮,-20 ℃沉淀2 h后16 000 r/min离心20 min,弃上清液。取沉淀使用蛋白裂解液溶解,滴加2 mmol/L的EDTA、1 mmol/L的PMSF,5 min,滴加10 mmol/L的DTT,超声15 min后16 000 r/min离心20 min,取上清液,加入10 mmol/L DTT处理1 h,56 ℃下操作。滴加MIAM试剂55 ml静置45 min,暗室操作,封闭半胱氨酸的烷基化,滴加冷丙酮,条件-20 ℃静置,2 h后25 000 r/min离心20 min,弃上清液,沉淀在200 μl 0.5 mol/L TEAB中超声溶解15 min,25 000 r/min离心20 min后取上清液定量[3]。
1.4.2蛋白质浓度测量 采用Bradford蛋白定量试剂盒,使用酶标仪测量595 nm的吸光度,由标准曲线判断样品浓度。
1.4.3SDS凝胶电泳 配置SDS聚丙烯酰胺凝胶,12%浓度。各样品与4×loading buffer分别充分混合,95 ℃下加热5 min。个体上样量30 μg,标记上样量10 μg。120 V恒压电泳120 min,考马斯亮蓝染色2 h,脱色5次,30 min/次[3]。
1.4.4液质联用分析 完成以上蛋白酶解、iTRAQ标记、SCX分离步骤,应用串联ESI质谱仪分析经过液相分离的肽段。
1.4.5数据库查询 应用质谱仪对数据进行峰识别得出峰列表。应用Mascot 2.3.02软件在蛋白质数据库中进行肽段及蛋白质的鉴定,比较样品之间蛋白的相对含量,获取有意义的蛋白。
1.4.6生物信息学分析 按照蛋白质数据库的使用标准,相对定量下,如同一蛋白量在样品间无显著变化,蛋白丰度比约为1。由此推断,若蛋白丰度比即差异倍数达到1.2倍或以上,且P<0.05时,可以认为该蛋白为差异蛋白。应用GO数据库(http://www.geneontology.org/)将差异蛋白质向的各个队组映射,计算每个队组的蛋白质数目,经几何检验后可比对所有蛋白质背景进而得出差异蛋白质中显著富集的GO条目。应用KEGG为单位(sourcel:http://www.genome.jp/ KEGG / pathway.htmll)进行富集分析,进行Pathway 显著富集方法同上述的GO功能富集分析,可以确定差异蛋白参与的最重要的生化代谢途径和信号转导途径[3]。
1.5 统计学处理本文主要关注了富集的脂质代谢、能量代谢等生物过程的蛋白变化,蛋白总体水平变化最显著蛋白具体信息和功能会在后续研究中重点关注,本部分未比较血脂数据等数值信息,使用数据库查询及生物信息学分析方法可以完成本论文讨论。
2 结果
2.1 蛋白定量分析以蛋白质丰度比即差异倍数达在1.2倍以上(P<0.05),作为差异蛋白的判断标准。图1中展示3次重复蛋白定量均值分布,差异倍数经过以2为底数的对数转化后的值作为横坐标,大于0的代表表达量上调(红色),小于0的代表表达量下调(绿色)。本次蛋白定量结果治疗组与模型组相比,分别得到上调差异蛋白70个、下调差异蛋白119个,总差异蛋白189个。见图1。
2.2 差异蛋白GO富集分析对189个差异蛋白进行GO富集分析发现,这些差异蛋白主要富集到绑定、催化活性、运输活性、结构分子活性等生物过程;细胞、细胞组分、细胞器、细胞膜、胞外区等细胞成分以及细胞过程、生物调节、生物过程调节、代谢过程、刺激应答、定位等分子功能。见图2。
2.3 差异蛋白KEGG富集分析对189个差异蛋白进行KEGG通路分析发现,细胞黏附分子(图3)通路变化最为显著,吞噬体、突出囊泡循环、氨基酸生物合成、胰岛素分泌、PPAR信号通路以及与脂代谢密切相关的脂肪消化和吸收(图4)、胆汁酸分泌(图5)通路显著变化。此外,与能量代谢密切相关的氧化磷酸化(图6)等通路蛋白亦发生改变。见图7。
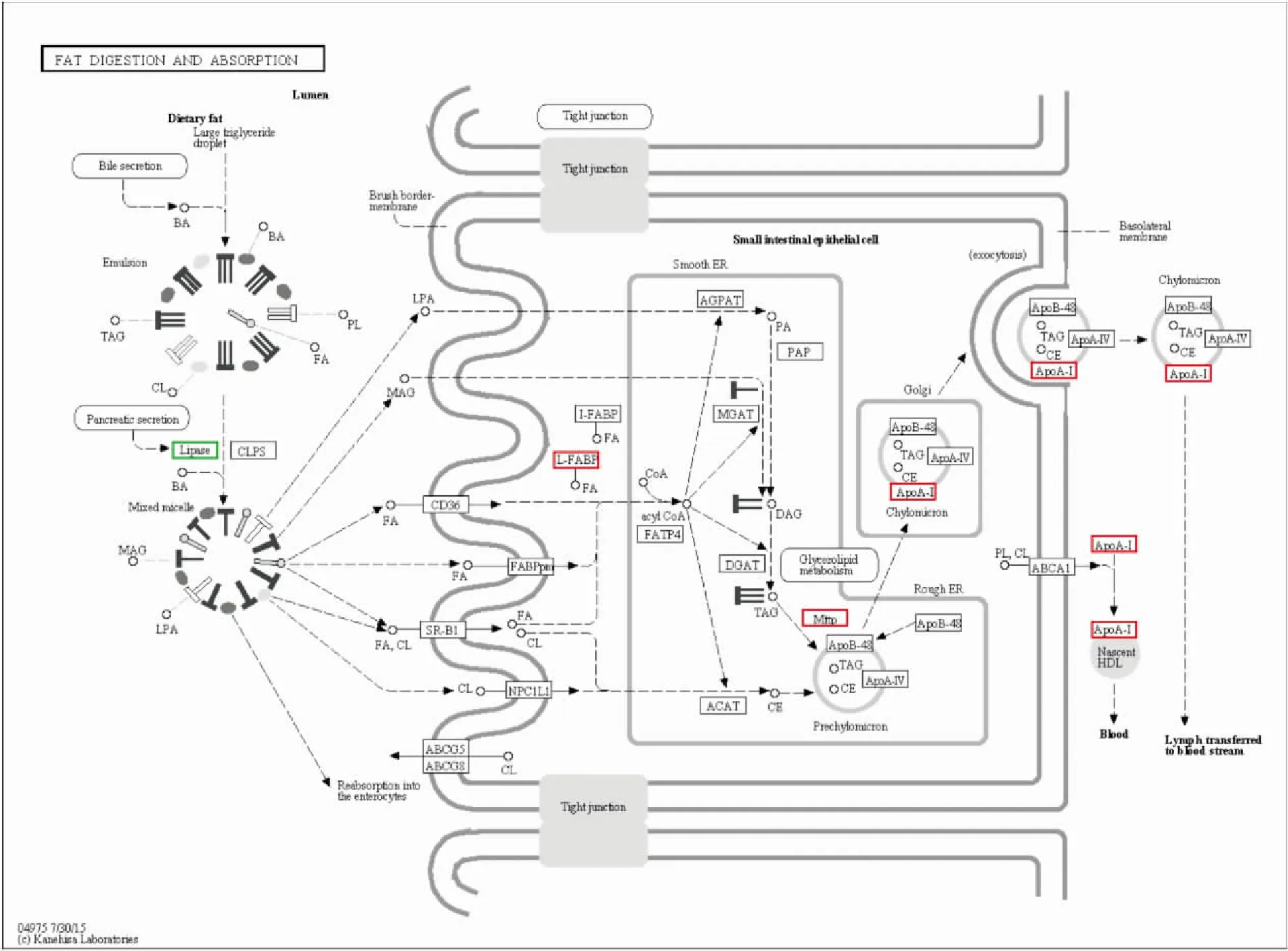
图4 脂肪消化与吸收通路图
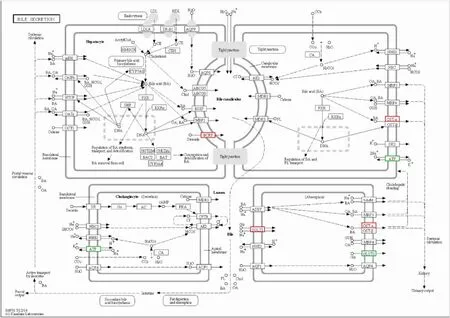
图5 胆汁酸代谢通路图
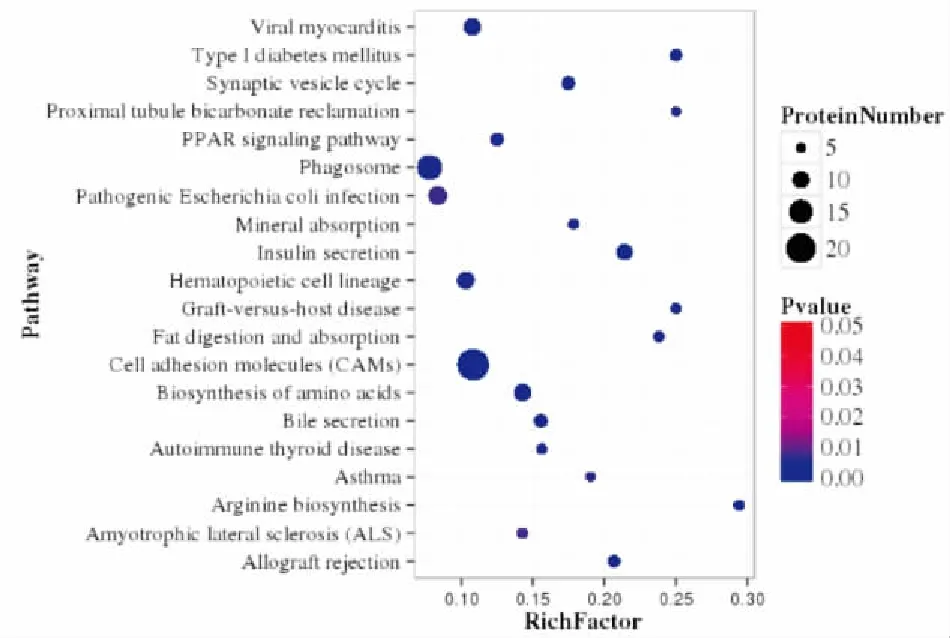
图7 治疗组/模型组KEGG富集分析图
3 讨论
AS的重要病理基础为脂质代谢障碍,而脂质代谢主要在小肠进行,小肠的消化吸收功能失常致使体内脂质代谢障碍,动脉内膜脂糖积聚、出血甚或形成血栓,进而出现纤维组织增生、钙质沉着,兼有动脉中层渐进性蜕变、钙化,最终动脉壁增厚变硬失去弹性、血管腔逐渐狭窄[6]。从中医角度,以上病理状态为痰证和瘀证,是AS中最具有典型性的两个综合征类型,课题组使用中医经典复合造模方法,造成痰瘀互结状态AS经典模型。
AS的病理机制已经明确,一些针对性治疗AS的药物作用,例如雷帕霉素抑制剂抗动脉粥样硬化作用、小檗碱改善高脂饮食引起的AS、以及通过多种药物调控巨噬细胞免疫代谢作用进而改善AS等,被广泛研究。从中医角度看,AS是气虚在前,气虚不能运血,血液淤滞;血水同源,血脉不行,痰湿不能运化,虚实夹杂,痰淤互见,因此益气活血化痰是治疗AS的主要治法[7]。中医药治疗AS从“痰瘀同治”、“痰瘀相关”角度出发已经获得公认[8]。辽宁中医药大学附属医院临床验方健脾祛痰化瘀方对模型组动物疗效作用靶点需要确认。iTRAQ技术可以把握差异表达蛋白的动态变化,它的“整体”“动态”与中医学的“整体观”及“辨证论治”相契合,因而逐渐成为中医认识疾病本质的重要手段。
根据上文结果,差异蛋白中,纤维蛋白原与AS炎症模式和促炎细胞因子形成具有相关性,与内皮炎症与血栓形成等密切相关[9-10];还有一些与甘油脂类代谢、胆汁酸分泌等过程密切相关的关键酶,如胰脂肪酶等与AS直接或间接相关[11]。高脂肪和热量的摄入容易导致心血管疾病、动脉硬化和结肠癌,通过药物或者食物干预胰脂肪酶等的活性可能成为治疗超重和肥胖甚至高脂状态的新途径[12-13]。炎症通路与 AS 关系密切,众多炎性细胞因子、趋化因子及黏附因子等相互作用,成倍速度扩大炎症反应级联,导致AS病变程度不断加深,“炎症学说”、“损伤-反应学说”成为目前AS 发病机制的主流学说。细胞黏附分子通路、泛素-蛋白酶体通路、转化因子通路等与AS进程相关[14]。细胞过程、脂肪代谢过程和免疫刺激应答等相关功能,与AS病理过程密切相关,影响炎症和血栓形成[15]。
本研究结果表明,临床验方健脾祛痰化瘀方干预下脾虚痰浊AS巴马猪小肠差异蛋白组学改变可能与细胞炎症反应、甘油脂类代谢、胆汁酸分泌等密切相关,脾虚高脂状态小肠消化吸收功能异常,细胞炎症反应可能与AS形成密切相关,健脾祛痰化瘀方治疗靶点作用于炎症通路、胆汁酸及脂肪代谢通路等,从蛋白质分子水平治疗AS。
