白介素-2及其受体在肾移植免疫耐受中对Fas/FasL的表达及T细胞凋亡的影响
2020-06-11曹荣华石小红
曹荣华,石小红
目前治疗终末期肾病最有效的方法为肾移植,但接受移植后需长期服用免疫抑制剂,且并不能完全避免排斥反应的发生[1]。骨髓间充质干细胞(mesenchymal stem cells,MSCs)是免疫治疗中最有前景的一类细胞,这类细胞可以修复组织、调节免疫,在移植免疫耐受中受到广泛应用,但仍不能达到理想的耐受状态[2-3]。白介素-2(interleukin-2,IL-2)是一种重要的调控免疫系统的细胞因子,IL-2发挥生物活性是通过与细胞表面的白介素-2受体(interleukin-2 receptor,IL-2R)结合,激活胞质内多种非受体型蛋白质-酪氨酸激酶(PTK),通过Jak-STAT途径控制基因转录、通过Ras-MAPK途径控制细胞增殖、凋亡并通过调控PI3K途径控制细胞骨架布局[4-6]。同时IL-2可以通过促进Fas或/和FasL的表达通过促进T细胞由G1期进入S期,同时由于S期细胞易诱发细胞凋亡,而达到促进T细胞凋亡来调控免疫耐受。牛坚 等[7]研究表明:白介素-10在受体在MSCs诱导肝移植免疫耐受中起重要作用。张黎黎 等[8]研究表明:大鼠肾移植时同时给予姜黄素与MSCs注射,可抑制免疫排斥反应的发生,保护肾功能。目前有关IL-2和IL-2R在MSCs诱导肾移植免疫耐受中的研究较少。该文旨在研究IL-2及IL-2R在MSCs诱导肾移植免疫耐受中的影响,以期了解IL-2及IL-2R在MSCs诱导肾移植免疫耐受中的作用机制,从而为MSCs诱导肾移植免疫耐受提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1动物 BALB/c小鼠和C57BL/6小鼠各30只,体质量20±20 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2017-0022,分12个笼子饲养,每个笼子5只。饲养于本院动物中心实验室。
1.1.2药物与试剂 sFas及sFasL ELISA试剂盒(货号:YY40009)购自美国R&D公司;中性福尔马林、酒精、二甲苯购自天津科密欧有限公司;IL-2和TGF-β1(ELISA试剂盒)购自武汉赛默飞世尔科技有限公司;DMEM细胞培养基购自美国Hyclone公司;TRIzol提取试剂购自美国Invitrogen公司;逆转录试剂盒购自南京铂优生物技术有限公司。
1.1.3仪器 低温高速离心购自德国Eppendorf公司;恒温水浴箱购自天津泰新特仪器公司;超低温冰箱购自昊昕仪器设备有限公司;Sysmex-chemix-180;BS-124s 型电子天平购自北京赛多斯仪器系统有限公司;光学显微镜购自东莞市同创仪器有限公司;切片机购自德国Leica公司;低温离心机购自湖南恒诺离心机有限公司。
1.2 方法
1.2.1建立模型 将小鼠麻醉后,腹主动脉插入灌注针,灌注含肝素钠的肾保养液,分离出双肾,置于4 ℃生理盐水保存,将双肾移植至肾脏已被切除的小鼠体内,吻合血管。具体操作参考顾凤娟等[9]研究。
1.2.2分组及药物干预 30只免疫缺陷的BALB/c小鼠和30只C57BL/6 小鼠,随机分为3组,分别为对照组、移植组和白介素-2组;每组2种小鼠各10只,分别为对照组、移植组和白介素-2组,对照组小鼠切下自身肾脏后在缝合消毒处理;移植组将 C57BL/6 小鼠肾脏移植给BALB/c小鼠缝合消毒处理,白介素-2组将 C57BL/6 小鼠肾脏移植给BALB/c小鼠,并将含有目的基因的MSCs细胞通过静脉注入到移植受体中,其他2组注射等量生理盐水。
1.2.3小鼠骨髓间充质干细胞的分离与培养 小鼠颈椎脱臼处死,无菌条件下取胫骨和股骨,将骨髓腔无菌封闭状态下置于体积分数75%乙醇浸泡3 min,抽取4 ml DMEM培养液,穿刺入骨髓腔,反复冲洗骨髓3~5次,收集至15 ml离心管,制成细胞悬液,使用恒温离心机在1 000 r/min条件下离心5 min,弃上清液;用含体积分数20%胎牛血清培养基重悬细胞,以1×107个接种于培养瓶中,置于37 ℃,体积分数5% CO2饱和湿度的培养箱培养,每隔3 d换液1次培养基,当细胞铺满培养瓶平底80~90%时进行传代,取第3代细胞进行实验,间充质干细胞表面无CD29、CD34、CD45等抗原,注入小鼠之前使用免疫荧光染色鉴定其表面不存在这些抗原则表明培养3代后没分化。
1.2.4细胞转染 取小鼠MSC细胞,将目的基因单独或联合转染SW620细胞。随后将含IL-2 基因的DNA构建到病毒载体中,转染后48 h待病毒复制转录后形成mRNA,进行后续实验。所有转染实验均严格按照转染试剂操作步骤进行。
1.2.5实时定量PCR(RT-PCR)检测 细胞转染完成24 h后采用实时荧光定量扩增仪分别检测细胞中IL-2 mRNA及IL-2R mRNA水平,TRIzol法提取各组细胞总RNA,采用逆转录试剂盒合成cDNA,进行RT-PCR反应,以GAPDH为内参蛋白。采用2-ΔΔCt法计算L-2mRNA及IL-2R mRNA的相对表达量,每组细胞设3个复孔,实验重复3次。
1.2.6ELISA法检测小鼠IL-2、TGF-β1、sFas及sFasL水平 采用酶联免疫吸附法( ELISA)检测小鼠IL-2、TGF-β1、sFas及sFasL水平,操作方法严格按照ELISA试剂盒说明书操作。
1.2.7Western blot 检测蛋白表达水平 按照Western blot 检测方法操作,使用蛋白质条带用扫描仪进行扫描,以β-actin为内参,应用Imagaquent 5.1软件对JAK、STAT3、p-STAT3蛋白质条带灰度进行相对定量分析。以目的蛋白条带与 β-actin 灰度比值表示蛋白相对表达水平。实验重复 3 次,取平均值为最终结果。
1.2.8小鼠生存期记录 记录小鼠生存时间:从造模成功后记为1 d,并开始记录小鼠的生存时间。
1.3 统计学处理采用SPSS 20.0软件和GraphPad Prism5软件对数据进行处理和分析作图,生存期限比较采用Log-rank法检验;计量指标采用“均数±方差”表示,两组间比较采用单因素方差分析,多组数据间比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 IL-2 mRNA及IL-2R mRNA表达水平相比对照组,移植组IL-2 mRNA及IL-2R mRNA表达升高,差异有统计学意义(P<0.05),与移植组相比,白介素-2组IL-2 mRNA及IL-2R mRNA表达升高,差异有统计学意义(P<0.05),见表1。

表1 IL-2 mRNA及IL-2R mRNA表达水平
与对照组比较:**P<0.05;与移植组比较:##P<0.05
2.2 小鼠血液中IL-2、TGF-β1、sFas 及sFasL水平相比对照组,移植组IL-2、TGF-β1、sFas 及sFasL水平升高,差异有统计学意义(P<0.05);与移植组相比,白介素-2组IL-2、TGF-β1、sFas 及sFasL水平升高,差异有统计学意义(P<0.05),见表2。

表2 小鼠血液中IL-2、TGF-β1、sFas 及sFasL水平
与对照组比较:**P<0.05;与移植组比较:##P<0.05
2.3 小鼠肾小管上皮细胞JAK、STAT3、p-STAT3表达情况相比对照组,移植组p-STAT3和JAK表达增加,差异有统计学意义(P<0.05);STAT3表达无统计学差异(P>0.05);相比移植组,白介素-2组p-STAT3和JAK表达增加,差异有统计学意义(P<0.05);STAT3表达无差异(P>0.05),见图1和表3。
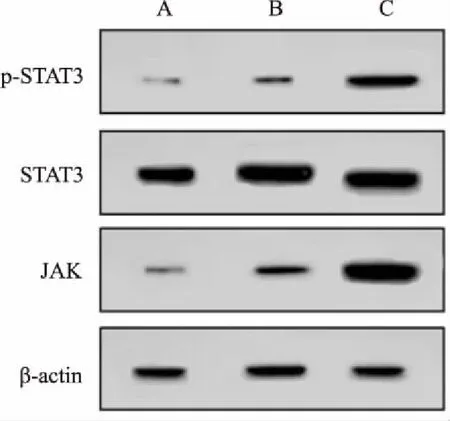
图1 小鼠肾小管上皮细胞JAK、STAT3、p-STAT3表达情况

表3 小鼠肾小管上皮细胞JAK、STAT3、p-STAT3表达情况
与对照组比较:**P<0.05;与移植组比较:##P<0.05
2.4 小鼠生存期记录结果空白对照组分别在第8天和第35天有小鼠死亡,IL-2组在44 d时全部死亡,移植组小鼠60 d生存率提高至50%(5只死亡,5只存活);相比IL-2,移植组小鼠60 d存活率提高,见图2。
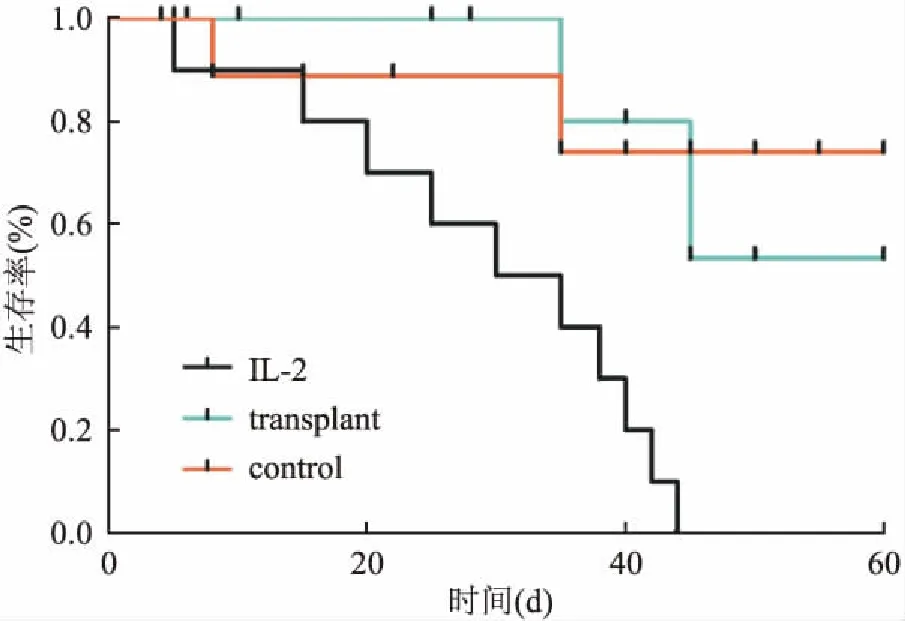
图2 小鼠生存期记录结果
3 讨论
MSCs主要存在于骨髓组织中,这种干细胞具有自我更新、横向分化和免疫调节功能。当供体植入后会促进T细胞使之表达Fas,而内正常肾脏组织细胞无FasL表达,故会导致T淋巴细胞对移植物的攻击[10]。翟志敏[11]研究表明:IL-2是一种Th1型细胞因子,可以诱导Th1型免疫反应。通过抑制Th2型细胞因子的产生,抑制巨噬细胞向Th1细胞递呈抗原,进而抑制Th1细胞的增殖与分化实现抑制移植中的排斥反应。不仅如此, IL-2可以通过促进Fas和FasL的表达而促进T细胞凋亡来调控免疫耐受。陈希炜 等[12]研究表明:IL-2是通过促进T细胞由G1期进入S期,同时S期细胞易诱发细胞凋亡,从而促进T细胞凋亡的发生。当机体内IL-2水平较高会刺激T细胞表达Fas、FasL,当Fas、FasL水平升高后会T淋巴细胞对移植物的攻击导致移植细胞的凋亡。
TGF-β1是肾脏的纤维化病变具有密切关系的细胞因子。TGF-β有共3种异构体,在不同组织的分布具有特异性。TGF-β1在肾脏的表达最多,主要由肾小球和肾小管的上皮细胞分泌,是TGF-β家族中最具特征性的分子。TGF-β1是重要的免疫调节因子,不仅可以参与多个生物过程,抑制T细胞的活化与扩增,同时也可维持机体的免疫稳态以及诱导自身耐受。TGF-β1具有较强的刺激纤维增生作用,促进纤维细胞的生长。本研究中发现:白介素-2组小鼠TGF-β1水平较高。说明IL-2的高表达会促进TGF-β1的表达,同时TGF-β1是重要的免疫调节因子,参与多个生物过程,特别是其过度表达与组织 纤维化密切相关,当小鼠TGF-β1的表达增加促进肾间质纤维化,使得移植的肾脏出现排斥反应。王平贤 等[13]研究表明:植肾患者中尿液中TGF-β1相对浓度高者肾功能差,与本研究得出的结论相一致。
Fas/FasL主要依靠介导的细胞程序性死亡在移植免疫耐受中发挥重要作用。FasL也为TNF/NGF家族成员,不仅可以有效诱导Fas+T淋巴细胞凋亡也可与Fas特异性结合,产生死亡信号传导到细胞内,使得细胞凋亡。Fas/FasL水平越高,细胞凋亡率越高。FasL与Fas作用后细胞内酪氨酸和丝/苏氨酸的磷酸化,并促进磷酸脂酶SMase活化,分解SM生成神经酰胺,同时通过膜结合性的丝/苏氨酸蛋白激酶和胞浆内丝/苏氨酸蛋白磷酸激酶导致IP3和DAG等第二信使的激活,使细胞内Ca2+的浓度升高并激活Ca2+/Mg2+依赖的核酸酶,使得DNA断裂且激活谷氨酰胺转移酶使胞浆内蛋白分子交联最终而导致细胞凋亡。本研究发现白介素-2组小鼠Fas/FasL水平升高,表明了移植的肾脏组织细胞凋亡程度较高、这可能和IL-2的表达激活了小鼠自身的免疫反应,增强了对移植器官的排斥作用。这可能和Fas/FasL水平升高促进T细胞凋亡增强了机体自身免疫功能相关。周文强 等[14]研究表明:Fas及FasL可能直接参与移植肾急性排斥反应,Fas及FasL水平越高排斥反应越严重,与本研究得出的结论相一致。
在肾脏损伤中JAK激酶可以与其下游的STAT组成的信号通路会被激活,同时STAT3蛋白的也会通过酪氨酸磷酸化被异常激活,能够诱导某些与免疫、细胞凋亡、炎症等多种生理的关键基因产物的表达,通过各种途径影响肾脏的功能。本研究发现:白介素-2组小鼠p-STAT3和JAK表达增加,说明高表达IL-2会促进STAT3的磷酸化,促进JAK/STAT3 信号降低肾移植中的免疫耐受。这可能是因为JAK 激酶与其下游的STAT组成了重要的信号途径,当该通路被激活后,可以与TGF-β1结合,相当于TGF-β1的启动子,促进了 TGF-β1的表达,使得肾脏纤维化,加重免疫排斥。李敏利 等[15]研究表明:IL-2可以通过影响 JAK/STAT3 信号通路发挥诱导免疫耐受的作用,与本研究得出的结论相一致。
