胰岛素生长因子2甲基化对高糖诱导滋养层细胞凋亡及PI3K/Akt通路的影响
2020-06-11谢莹莺
李 琴,谢莹莺
妊娠期糖尿病(gestational diabetes mellitus,GDM)是在妊娠期才首次出现或被确诊的糖尿病,可使胎盘滋养层细胞持续处于高糖环境中,使其增殖活性降低进而影响胎盘功能,诱导胎盘组织发生明显的体积、结构及血流灌注异常,增加畸胎、巨大儿、围产期死亡、流产等的发生率,严重威胁胎儿及孕妇的健康[1-2]。研究[3]表明,胰岛素生长因子2(insulin-like growth factor Ⅱ,IGF-Ⅱ)可调节机体合成代谢与细胞生长分化,在胎盘、胚胎早期发育中发挥着重要作用,其表达水平低,会使胎盘、胚胎发育异常,引起流产。甲基化是在转录水平对基因的一种修饰方式,对基因表达及细胞正常分化具有重要作用,去甲基化可使基因的表达增强[4],对叶酸缺乏孕鼠的研究[5]发现,胰岛素生长因子系统的甲基化异常升高会影响胎鼠宫内的生长发育,表明IGF-Ⅱ甲基化可影响IGF-Ⅱ蛋白表达,进而调控滋养层细胞增殖及凋亡,因而其甲基化可能影响高糖诱导的滋养层细胞凋亡。PI3K/Akt通路在细胞生长、发育、凋亡等生理过程中起重要的调节作用[6],可参与调节由牙龈卟啉单胞菌诱导的胚胎滋养层细胞的凋亡和炎症过程,抑制PI3K/Akt通路活性,可促进细胞凋亡和炎症因子的分泌[7],但IGF-Ⅱ甲基化对PI3K/Akt通路的影响目前还不清楚。现通过高糖培养基诱导滋养层细胞系HTR-8/SVneo凋亡,探究IGF-Ⅱ甲基化对高糖诱导滋养层细胞凋亡及PI3K/Akt通路的影响。
1 材料与方法
1.1 材料
1.1.1试剂 人绒毛膜滋养层细胞系HTR-8/SVneo(货号:HTX-1923)(深圳市豪地华拓生物科技有限公司);IGF-Ⅱ甲基化引物、IGF-Ⅱ非甲基化引物、IGF-Ⅱ nMS-PCR外侧引物(上海生工生物工程股份有限公司);5-氮杂-2'-脱氧胞苷(5-Aza-2′-deoxycytidine,5-aza-dc,货号:A119533)(上海恒斐生物科技有限公司);RPMI-1640培养基(货号:31800)、胎牛血清(FBS,货号:11011-8611)、青链霉素混合液(货号:P1400)、SDS-PAGE凝胶制备试剂盒(货号:P1200-50T)、PBS缓冲液(货号:P1022)、胰蛋白酶-EDTA消化液(货号:T1300)、D-葡萄糖粉(货号:G8150)(美国Solarbio公司);CpGenome DNA修饰试剂盒(货号:S7820)(美国Intergen公司);基因组DNA提取试剂盒(货号:YY-62019)(上海优予生物科技有限公司);TaKaRa LA Taq® with GC Buffer(货号:RR02AG)(日本TaKaRa公司);琼脂糖(货号:A3381)(上海士锋生物科技有限公司);AnnexinV-FITC/PI凋亡检测试剂盒(货号:V13242)、兔源GAPDH(货号:PA5-85082)、IGF-Ⅱ(货号:ab9574)、PI3K(货号:710400)、Akt(货号:44-609G)、p-Akt(货号:44-621G)、Bax(货号:PA5-11378)、caspase3(货号:PA5-86276)一抗,鼠源Bcl-2(货号:13-8800)一抗,羊抗鼠二抗(货号:A-11029),羊抗兔二抗(货号:A-11034)(美国Cell Singaling Technology公司);蛋白裂解液(货号:P0013K)、CKK-8试剂盒(货号:C0037)、BCA试剂盒(货号:P0011)、96孔板、25 cm2培养瓶、60 mm培养皿(上海碧云天公司)等。
1.1.2仪器 酶标仪(Model 680)、小型垂直电泳系统(美国Bio-Rad公司);PCR扩增仪(PC808)(美国Astec公司);流式细胞仪(CytoFLEX, 美国贝克曼库尔特公司);双人单面超净工作台、CO2培养箱(美国Thermo公司);高速离心机(Biofuge 28RS)(德国Heraeus);制冰机(XB-70,美国 GRANT 制冰机公司);恒温水浴锅(上海析达仪器有限公司生产)等。
1.2 方法
1.2.1细胞培养及分组处理 细胞完全培养基的配制:向RPMI-1640培养基中加入10% FBS、1%青链霉素混合液,上下颠倒,混合均匀。细胞高糖培养基的配制:参照文献[8],向细胞完全培养基(根据说明书可知葡萄糖终浓度为11.11 mmol/L)中加入D-葡萄糖粉,使培养基中葡萄糖终浓度为50 mmol/L。
购买的冻存细胞,在39 ℃左右水浴中快速融化,3 000 r/min,室温离心5 min,向细胞沉淀中加入5 ml完全培养基,轻轻吹打均匀接种在25 cm2培养瓶中,放置在37 ℃、5% CO2细胞培养箱中培养,每天观察细胞生长状态,当细胞长至85%左右时,胰酶消化后以1 ∶3的比例进行传代培养。
使用RPMI-1640培养基将5-aza-dc配制为50 mmol/L 的储备液备用。传代培养的细胞长至80%以上时,胰酶消化后接种于60 mm培养皿中,随机分为对照组、高糖组、5-aza-dc+高糖组,在37 ℃、5% CO2细胞培养箱中培养24 h后,高糖组、5-aza-dc+高糖组将培养基更换为高糖培养基,5-aza-dc+高糖组细胞加入5-aza-dc储备液,使终浓度为20 μmol/L[9],对照组细胞不做处理,继续在37 ℃、5% CO2细胞培养箱中培养48 h后收集各组细胞。
1.2.2巢式甲基化特异性聚合酶链式反应(nested methylation specific PCR,nMS-PCR)检测IGF-Ⅱ甲基化水平 将收集的各组细胞,参照文献[10]的方法,使用基因组DNA提取试剂盒提取各组细胞的基因组DNA,取各组细胞的基因组DNA样品约1 μg,采用CpGenomeDNA修饰试剂盒对DNA进行亚硫酸氢钠修饰后得到进行PCR反应的模板DNA,操作步骤分别参照各自说明书,以得到的亚硫酸氢钠修饰基因组DNA为模板,IGF-Ⅱ甲基化引物、IGF-Ⅱ非甲基化引物共同的nMS-PCR外侧引物P3为反应引物进行PCR扩增反应,再以PCR产物为模板,分别用IGF-Ⅱ甲基化引物P3M、IGF-Ⅱ非甲基化引物P3U为反应引物进行PCR扩增反应,反应条件的设定、反映体系的配制依照说明书进行,最终得到的IGF-Ⅱ甲基化、非甲基化PCR产物进行琼脂糖凝胶电泳,用凝胶成像分析仪成像并分析甲基化条带及甲基化条带的吸光度,计算甲基化水平,公式为:甲基化水平=甲基化吸光度(optical density,OD)值/(甲基化OD值+非甲基化OD值)×100%,引物序列见表1。

表1 引物序列
1.2.3细胞增殖、凋亡情况检测 细胞增殖检测:传代培养的细胞长至80%以上时,胰酶消化后计数,以5×105个/ml浓度接种在96孔板中,随机分为对照组、高糖组、5-aza-dc+高糖组,每组设4个孔,参照1.2.1项中处理细胞的步骤分别处理细胞,48 h后每孔中加入CKK-8试剂,继续培养2 h,采用全自动酶标仪测定450 nm波长下各孔OD,计算各组细胞的相对存活率,公式为:相对存活率(%)=药物处理组OD值/对照组OD值×100%。
细胞凋亡检测:1.2.1中收集的各组细胞分别加入完全培养基后,吹打均匀后计数,取含有约1×106个细胞的细胞混悬液到一个5 ml离心管中,1 000 r/min,室温离心5 min,细胞沉淀以PBS溶液漂洗2次后,加入200 μl的Binding Buffer及10 μl的ArmexinV-FITC轻轻震荡混匀,室温,避光反应15 min,再加入300 μl的Binding Buffer及5 μl PI震荡混匀,继续室温,避光反应15 min,1 000 r/min,室温离心5 min,细胞沉淀以PBS溶液漂洗2次后,加入PBS溶液混匀,在流式细胞仪中检测细胞凋亡情况。
1.2.4Western blot法检测蛋白表达水平 1.2.1中收集的各组细胞加入蛋白裂解液(含有蛋白酶抑制剂)提取总蛋白,使用BCA试剂盒并参照说明书的步骤测定总蛋白浓度,根据结果调整各组蛋白使浓度相同,采用SDS-PAGE凝胶制备试剂盒配制SDS-PAGE浓缩胶及分离胶,各组分比例及配制方法参照说明书,取20 μg总蛋白在垂直电泳仪中进行电泳并转移分离的蛋白至PVDF膜上,根据目的蛋白分子量截取相应的条带分别置于小盒中,加入5%脱脂牛奶,室温封闭2 h,加入1 ∶1 000的兔源GAPDH、IGF-Ⅱ、PI3K、Akt、p-Akt、Bax、caspase3一抗,鼠源Bcl-2一抗,4 ℃孵育过夜,TBST溶液漂洗3次,加入1 ∶2 000的羊抗鼠二抗、羊抗兔二抗,室温孵育2 h,TBST溶液漂洗3次,以ECL显色,在凝胶成像仪中观察蛋白条带并分析其相对表达量。
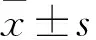
2 结果
2.1 各组细胞IGF-Ⅱ甲基化及蛋白表达水平的比较对照组、高糖组、5-aza-dc+高糖组细胞甲基化水平比较差异有统计学意义(F=24.857);三组间蛋白相对表达量比较差异有统计学意义(F=86.135)。其中与对照组相比,高糖组细胞IGF-Ⅱ甲基化水平升高(P<0.05),IGF-Ⅱ的蛋白水平降低(P<0.05);与高糖组相比,5-aza-dc+高糖组细胞IGF-Ⅱ甲基化水平降低(P<0.05),IGF-Ⅱ的蛋白水平升高(P<0.05)。见图1。
2.2 IGF-Ⅱ甲基化对细胞增殖的影响对照组、高糖组、5-aza-dc+高糖组细胞相对存活率分别为(100.00±0.00)%、(57.61±11.01)%、(82.60±15.02)%(F=47.128)。其中与对照组相比,高糖组细胞相对存活率明显降低(P<0.05);与高糖组相比,5-aza-dc+高糖组细胞相对存活率升高(P<0.05)。
2.3 IGF-Ⅱ甲基化对细胞凋亡的影响对照组、高糖组、5-aza-dc +高糖组细胞凋亡率比较差异有统计学意义(F=49.796)。其中与对照组相比,高糖组细胞凋亡率明显升高(P<0.05);与高糖组相比,5-aza-dc+高糖组细胞凋亡率降低(P<0.05)。见图2。
2.4 IGF-Ⅱ甲基化对细胞凋亡相关蛋白表达的影响对照组、高糖组、5-aza-dc+高糖组细胞Bcl-2蛋白相对表达量比较差异有统计学意义(F=314.900);Bax蛋白相对表达量比较差异有统计学意义(F=431.232);caspase-3蛋白相对表达量比较差异有统计学意义(F=220.667)。其中与对照组相比,高糖组细胞Bcl-2蛋白表达明显降低(P<0.05),Bax、caspase-3蛋白表达明显升高(P<0.05);与高糖组相比,5-aza-dc+高糖组细胞Bcl-2蛋白表达升高(P<0.05),Bax、caspase-3蛋白表达降低(P<0.05)。见图3。

图1 各组细胞IGF-Ⅱ的甲基化水平及蛋白水平
A:各组细胞IGF-Ⅱ的甲基化水平;M:IGF-Ⅱ的甲基化产物;U:IGF-Ⅱ的非甲基化产物;B:各组细胞IGF-Ⅱ的蛋白水平; a:对照组;b:高糖组;c:5-aza-dc+高糖组;与对照组比较:*P<0.05;与高糖组比较:##P<0.05

图2 各组细胞凋亡情况

图3 各组细胞凋亡相关蛋白表达
A:对照组;b:高糖组;c:5-aza-dc+高糖组;与对照组比较:*P<0.05;与高糖组比较:##P<0.05
2.5 IGF-Ⅱ甲基化对细胞PI3K、p-PI3K、Akt、p-Akt蛋白表达的影响对照组、高糖组、5-aza-dc+高糖组细胞p-PI3K蛋白相对表达量比较差异有统计学意义(F=110.576);p-Akt蛋白相对表达量比较差异有统计学意义(F=58.469)。其中与对照组相比,高糖组细胞p-PI3K、p-Akt蛋白表达明显降低(P<0.05),PI3K、Akt蛋白表达无明显变化(P>0.05);与高糖组相比,5-aza-dc + 高糖组细胞p-PI3K、p-Akt蛋白表达升高(P<0.05),PI3K、Akt蛋白表达无明显变化(P>0.05)。见图4。
3 讨论
胎盘是母亲与胎儿进行营养物质交换的重要枢纽,是妊娠建立的基础,而胎盘滋养层细胞的增殖活性对胎盘组织的形成、发展及胎儿的生长发育至关重要,其在妊娠早期向子宫内膜的侵袭确保了胚胎的着床植入及营养物质的传递,保证了胎盘正常功能和妊娠的顺利进展,而滋养层细胞增殖活性在妊娠早期受抑制可导致胎盘发育不良,诱发流产,在妊娠中晚期受抑制则会造成胎儿营养物质供应不足,引起胎儿慢性宫内缺氧及生长发育迟缓[11]。GDM使胎盘滋养层细胞持续处于高糖环境中,降低其增殖及侵袭活性,损害胎盘功能,导致早期流产、胎盘形成不良、胎儿宫内发育迟缓与畸形等严重后果[12],因此关于高糖引起的滋养层细胞凋亡的预防及作用机制的研究具有重要的临床意义。研究[13]发现,IGF-Ⅱ可促进滋养层细胞中PKB和P70S6K蛋白表达,进而促进滋养层细胞增殖,维持胎盘的正常发育,而IGF-Ⅱ甲基化异常增高,可抑制IGF-Ⅱ表达,引起胚胎停育[14],因此IGF-Ⅱ的甲基化可能影响高糖诱导的滋养层细胞凋亡。本文研究结果显示,与对照组相比,高糖组细胞相对存活率、IGF-Ⅱ蛋白表达明显降低,IGF-Ⅱ甲基化水平、细胞凋亡率明显升高;与高糖组相比,5-aza-dc+高糖组细胞相对存活率、IGF-Ⅱ蛋白表达升高,IGF-Ⅱ甲基化水平、细胞凋亡率降低,表明在高糖诱导的滋养层细胞凋亡过程中,IGF-Ⅱ甲基化水平升高,IGF-Ⅱ蛋白表达降低,而以5-aza-dc降低其甲基化水平后,可促进IGF-Ⅱ蛋白表达,抑制滋养层细胞凋亡,增强滋养层细胞增殖活力,揭示IGF-Ⅱ甲基化可促进高糖诱导的滋养层细胞凋亡,抑制IGF-Ⅱ甲基化可抑制其凋亡。

图4 各组细胞PI3K、p-PI3K、Akt、p-Akt蛋白表达
a:对照组;b:高糖组;c:5-aza-dc+高糖组;与对照组比较:*P<0.05;与高糖组比较:##P<0.05
细胞凋亡是细胞的一种自主、有序的死亡过程,多种基因及蛋白参与其中,caspase-3是细胞凋亡过程中最主要的终末剪切酶,在细胞凋亡中起着不可替代的作用,细胞中抑凋亡蛋白Bcl-2与促凋亡蛋白Bax表达量的比值在细胞凋亡的调节中具有关键作用[15]。在尤文肉瘤的研究[15]中发现,miR-30d可通过下调PI3K/Akt通路抑制Bcl-2表达,促进caspase-3、Bax表达,进而增强尤文肉瘤凋亡。肖艳平 等[16]发现脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)可激活PI3K/Akt/mTOR信号,提高人滋养层细胞HTR-8/Svneo增殖和侵袭能力,因此激活PI3K/Akt信号可能是IGF-Ⅱ低甲基化抑制高糖诱导的滋养层细胞凋亡的作用机制。本研究结果显示,与对照组相比,高糖组细胞Bcl-2、p-PI3K、p-Akt蛋白表达明显降低,Bax、caspase-3蛋白表达明显升高,PI3K、Akt蛋白表达无明显变化;与高糖组相比,5-aza-dc+高糖组细胞Bcl-2、p-PI3K、p-Akt蛋白表达升高,Bax、caspase-3蛋白表达降低,PI3K、Akt蛋白表达无明显变化,表明在高糖诱导的滋养层细胞凋亡过程中,PI3K/Akt通路被抑制,而激活PI3K/Akt通路,滋养层细胞凋亡减少,增殖增强,揭示PI3K/Akt信号可能是IGF-Ⅱ甲基化调节高糖诱导的滋养层细胞凋亡的作用靶点,降低IGF-Ⅱ甲基化水平可能通过激活PI3K/Akt信号抑制高糖诱导的滋养层细胞凋亡。
