雷公藤甲素通过抑制细胞色素P450 3A4酶增强肝损伤研究
2020-06-11杨新华夏宏光
杨新华,夏宏光,金 涌
雷公藤(tripterygium wilfordii hook F,TWHF)是一种藤本植物,TWHF的粗提物已被广泛用作治疗自身免疫性疾病和炎症性疾病的处方[1],如类风湿性关节炎(rheumatoid arthritis,RA)、IgA肾病、狼疮性肾炎、肾小管间质性肾炎、系统性红斑狼疮(systemic lupus erythematosus,SLE)并对组织和器官移植有益[2]。雷公藤甲素(triptolide,TP)又称雷公藤内酯醇,是从TWHF的粗提取物中分离的复合三环氧化物二萜。作为TWHF的主要生物活性成分之一,它在体外和体内均具有独特的生物活性。然而在TP达到其临床潜力之前,仍然需要克服众多问题,如水溶性差、治疗窗口狭窄和多器官毒性(包括损害消化系统、泌尿生殖系统、血液循环系统以及骨髓)。长期使用可导致严重的不良事件,如肝肿大、丙氨酸氨基转移酸(alanine transaminase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)升高等[3]。目前TP诱发肝脏损伤的确切作用机制尚不明确。细胞色素P450(cytochrome P450,CYP450)是一组结构和功能相关的超家族基因编码的同工酶,主要存在于生物体的内质网内,是混合功能氧化酶中最重要的一种酶系[4]。CYP3A 酶有3A4、3A5、3A7和3A43 4个亚型[5],成人CYP3A酶分别占肝脏和小肠总P450酶的40%和80%,以3A4为主[6]。CYP3A酶参与机体内源性物质和外源性物质的生物转化,在调节机体与外环境的相互作用以及保持机体内环境稳态中发挥重要作用[7]。CYP3A酶活性受多种因素影响,例如遗传多态性、机体生理或病理状态以及合并用药情况,尤以遗传多态性最为显著。TP在大鼠肝微粒体中代谢主要由CYP3A介导。该文主要研究TP对其主要代谢酶CYP3A4的影响以及与肝损伤之间的关联性。
1 材料与方法
1.1 材料
1.1.1细胞株与动物 L-02细胞购自中国科学院上海细胞库。生长于含10%胎牛血清培养液中,在37℃、5% CO2恒温恒湿培养箱内换液传代培养,实验均采用对数期细胞。24只C57BL/6雄性小鼠(6~8周,18~20 g)购自安徽医科大学动物实验中心,小鼠的饲养环境为SPF级动物房,室温20~25 ℃,湿度为40%~60%,每笼2只。
1.1.2主要试剂 TP(成都普思生物);卡马西平(carbamazepine, CBZ)(上海阿拉丁)、氨氯地平(amlodipine,AML)(上海阿拉丁)、甲醇(色谱纯) 购自上海化学试剂总厂;RPMI 1640培养基购自美国 Gibco公司;胎牛血清购自杭州四季青公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma 公司;β-actin抗体和山羊抗兔 IgG均购自北京博奥森科技有限公司;CYP3A4抗体购自武汉三鹰生物技术有限公司;BCA蛋白浓度试剂盒购自上海碧云天生物科技有限公司; ALT、AST检测试剂盒购自南京建成公司。
1.1.3主要仪器 全波长酶标仪(美国Biotek公司);显影仪(上海欧翔科学仪器有限公司);色谱柱:Shim-pack ODS C18柱,4.6 mm×250 mm,高效液相色谱仪(日本岛津)。
1.2 方法
1.2.1MTT法筛选CBZ(CYP3A4酶诱导剂)、AML(CYP3A4酶抑制剂)[8]和TP对L-02细胞株的生长抑制率 取消化后的L-02细胞,以每孔1×104个细胞密度接种于96孔板。观察细胞贴壁后加入药物CBZ,浓度分别为25、50、60、70、80、90、100、110、120 μmol/L,每组做6个复孔,再取消化后的L-02细胞,以每孔1×104个细胞密度接种于96孔板。观察细胞贴壁后加入药物AML,浓度分别为10、11、12、13、14、15、16、17、18、19 μmol/L,每组做6个复孔,再取消化后的L-02细胞,以每孔1×104个细胞密度接种于96孔板。观察细胞贴壁后加入药物TP,浓度分别为23、24、25、26、27、28、29、30、31 nmol/L, 每组做6个复孔。加药刺激24 h。并于实验结束后均加入MTT(5 mg/ml)20 μl并继续培养4 h。将上清液倒掉,每孔再加入DMSO 200 μl,震荡至溶解完全,以酶标仪测定490 nm吸光度。
1.2.2细胞实验分组及对肝细胞存活的影响 取消化后L-02细胞,以每孔5×105个细胞密度接种于6孔板。观察细胞贴壁后将细胞分为C组、TP组、TP+CBZ组、TP+AML组。C组加入少量DMSO作空白对照,TP组加入23 nmol/L的TP,TP+CBZ组加入23 nmol/L的雷公藤甲素和25 μmol/L的CBZ,TP+AML组加入23 nmol/L的TP和10 μmol/L的AML,作用24 h。贴壁细胞的收集用不含有乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)的胰酶消化(胰酶消化的时间不易过长,否则易引起假阳性),1 000 r/min 离心5 min后收集,用PBS洗涤细胞3次,收集细胞(1~5)×105个,然后加入100 μl的Binding Buffer悬浮细胞,再加入5 μl Annexin V-FITC混匀后,最后加入2 μl Propidium Iodide,充分混匀。避光、室温37 ℃、反应时间5~15 min,在1 h内,使用流式细胞仪进行检测。并单独收集各组细胞的培养液用于检测。
1.2.3动物实验分组 取24只C57BL/6雄性小鼠(6~8周),喂养1周适应环境后分别喂食正常饲料、TP(0.6 mg/kg/d)、TP(0.6 mg/kg/d)+AML(1.0 mg/kg/d)、TP(0.6 mg/kg/d)+CBZ(24 mg/kg/d),喂食2周后安乐死,取血清、肝脏。
1.2.4小鼠苏木精-伊红(HE)染色 将活组织用4%多聚甲醛溶液固定后包埋在石蜡中。将切片(4 μm)用苏木精(5%)染色10 min。首先将组织切片在蒸馏水中漂洗、酸化,然后在伊红中染色5 min。脱水和盖玻片安装后,在明视野显微镜下观察组织切片。
1.2.5ALT、AST的检测 按照试剂盒说明书用酶标仪测定各组L-02细胞上清液和小鼠血清中AST、ALT的含量。
1.2.6CYP3A4 mRNA的检测 采用RT-PCR法,首先按照takara试剂盒说明书提取4组L-02细胞及小鼠肝脏的RNA,根据逆转录试剂盒说明书操作合成cDNA。使用qPCR试剂盒进行扩增反应,反应体系为20 μl。
CYP3A4上游引物:5′-GCACCGAGTGGATTTCCTTC-3′;下游引物:5′-CGTGGTTTCATAGCCAGCAA-3′。β-acting上游引物:5′-AGTGTGACGTTGACATCCGT-3′,下游引物:5′-TGCTAGGAGCCAGAGCAGTA-3′。以β-actin为内参,采用2-△△Ct计算mRNA表达量,实验重复3次。
1.2.7CYP3A4的Western blot分析 采用Western blot 法,收取4组L-02细胞和小鼠肝脏并加入RIPA细胞裂解液提取蛋白质,1 ∶4加入5X上样缓冲液。沸水浴加热10 min冷却后上SDS-PAGE电泳分离蛋白质,半干转法将蛋白质转移至 PVDF 膜;5%脱脂奶粉封闭;滴加CYP3A4一抗(CYP3A4抗体,兔,武汉三鹰,1 ∶1 000;β-actin抗体,小鼠,中杉金桥,1 ∶1 000),4 ℃过夜;加入适当稀释度的辣根过氧化物酶(horseradish peroxidase,HRP) 标记的二抗(山羊抗兔辣根过氧化物酶,中杉金桥,1 ∶5 000),室温孵育2 h,然后TBST洗涤3次;加入 ECL曝光液,曝光显影后,使用 Image J 软件进行条带分析。
1.2.8TP含量检测 取L-02细胞上清液和小鼠血清,加入地西泮溶液作为内标溶液,溶剂为甲醇,流动相为甲醇 ∶水(50 ∶50),流速1 ml/min,柱温40 ℃,检测波长217 nm。精密吸取200 μl内标液(0.5 μg/ml)于玻璃试管中,40 ℃氮气吹干。先后于此玻璃管中加入2 ml培养液,涡旋混合3 min,1 200 r/min离心5 min,取上清液后加入1 ml乙酸乙酯,静置分层后,12 000 r/min离心30 min,离心后取上清液,用氮气吹干,溶解于100 μl甲醇中,取20 μl进样。
2 结果
2.1 MTT实验结果不同浓度的CBZ对L-02细胞的抑制率如图1A所示,不同浓度的AML对L-02细胞的抑制率如图1B所示,不同浓度的TP对L-02细胞的抑制率如图1C所示,但在选择药物对细胞作用的最佳浓度时,应考虑到细胞存活率这个影响因素,若细胞存活率过低,提示药物对细胞造成过度损伤,过度损伤的细胞再用药物进行作用,效果不明显。故本研究最终选择CBZ的药物作用浓度为25 μmol/L,AML的药物作用浓度为10 μmol/L,TP的药物作用浓度为23 nmol/L,因为这个药物浓度对L-02细胞的损伤作用较小,L-02细胞的存活率较高。
2.2 药物联合应用后各组细胞凋亡率如图2所示,在L-02细胞中单独加入TP后与正常组相比细胞凋亡率升高,加入CYP3A4酶诱导剂TP+CBZ 组细胞凋亡率与TP组相比有所降低,但仍高于正常组的凋亡率,CYP3A4酶抑制剂的TP+AML组细胞凋亡率与TP组相比有所升高。
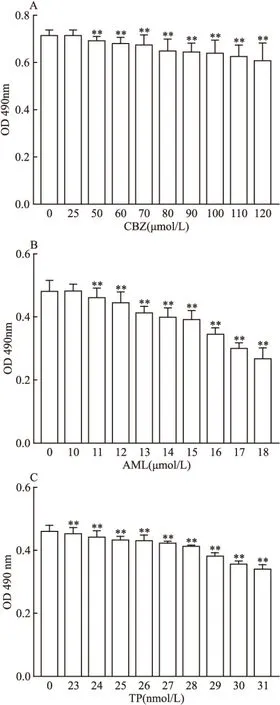
图1 MTT实验结果
A:CBZ;B:AML;C:TP;0 nmol/L比较:**P<0.01
2.3 各组细胞上清的ALT、AST含量使用试剂盒检测细胞培养液中的ALT、AST结果如图3所示,在图中可以看出TP+AML且中的AST、ALT含量最高,说明抑制剂组的L-02细胞损伤最为严重,其次是TP组,再然后是TP+CBZ组。
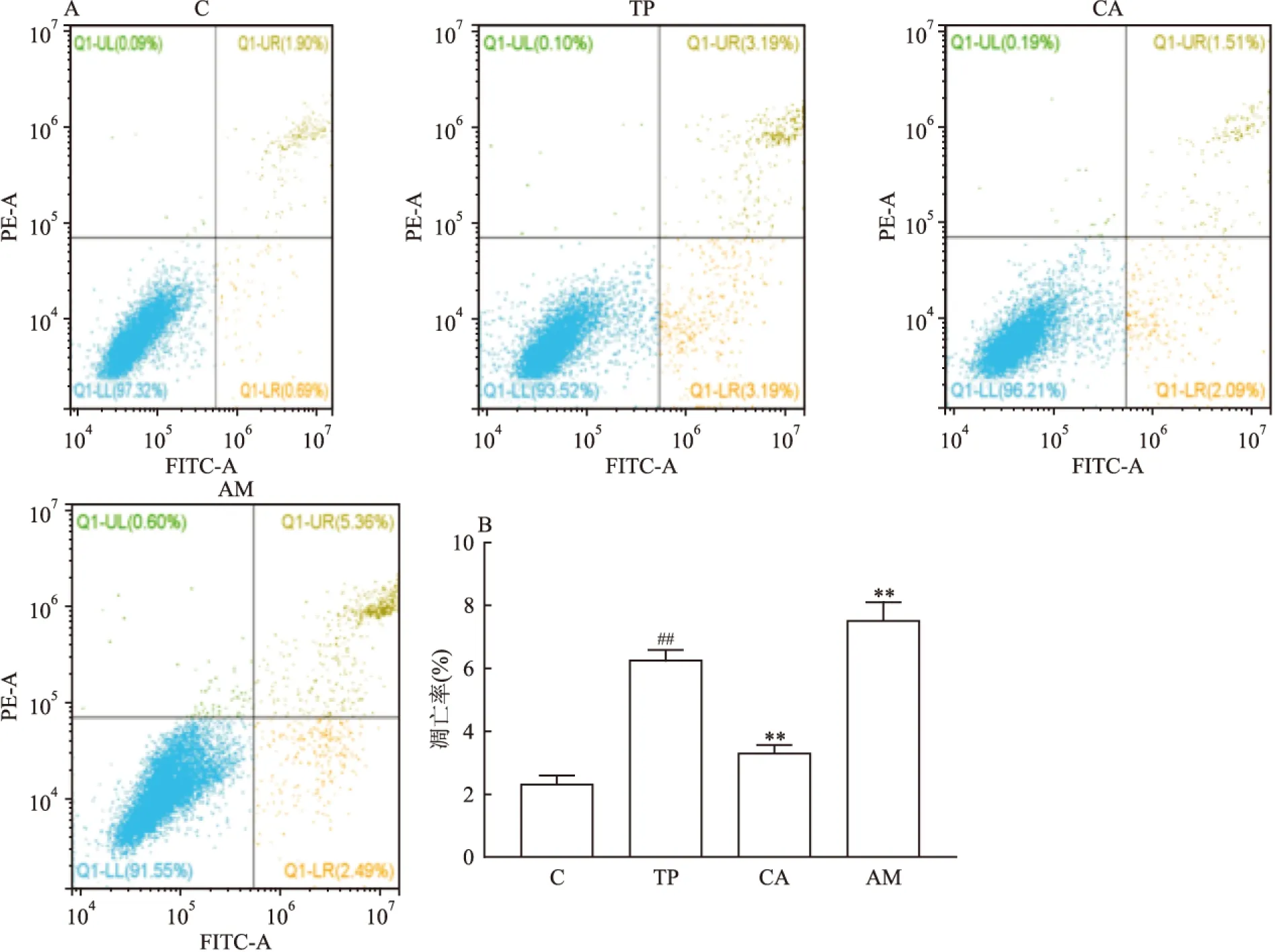
图2 各组细胞凋亡结果 A: 细胞流式图;B:凋亡定量分析图;C:正常组;TP:TP组;CA:TP+CBZ组;AM:TP+AML组;与C组比较:##P<0.01;与TP组比较:**P<0.01

图3 各组细胞上清AST和ALT含量
A:各组细胞上清AST含量;B:各组细胞上清ALT含量;C:正常组;TP:TP组;CA:TP+CBZ组;AM:TP+AML组;与C组比较:##P<0.01;与TP组比较:**P<0.01
2.4 各组肝脏细胞CYP3A4 mRNA和蛋白质表达水平定量PCR结果表明,TP明显下调肝脏细胞CYP3A4 mRNA表达,CBZ显著拮抗TP对肝脏细胞CYP3A4 mRNA表达的下调效应,而AML进一步加剧TP对肝脏细胞CYP3A4 mRNA表达的下调效应(图4A)。Western blot结果显示,TP明显下调肝脏细胞CYP3A4 蛋白质表达,CBZ显著拮抗TP对肝脏细胞CYP3A4 蛋白质表达的下调效应,而AML进一步加剧TP对肝脏细胞CYP3A4 蛋白质表达的下调效应(图4B)。
2.5 各组细胞上清中TP的含量高效液相色谱结果显示,该方法的校正曲线公式为Y=503.5X-0.564(R2=0.999)。高效液相色谱图结果如图5,各组培养基中剩余TP的含量如表1,结果显示TP+AML组中TP的含量最高,TP+CBZ组中TP的含量最低。
表1 各组中剩余TP含量
与TP组比较:*P<0.05
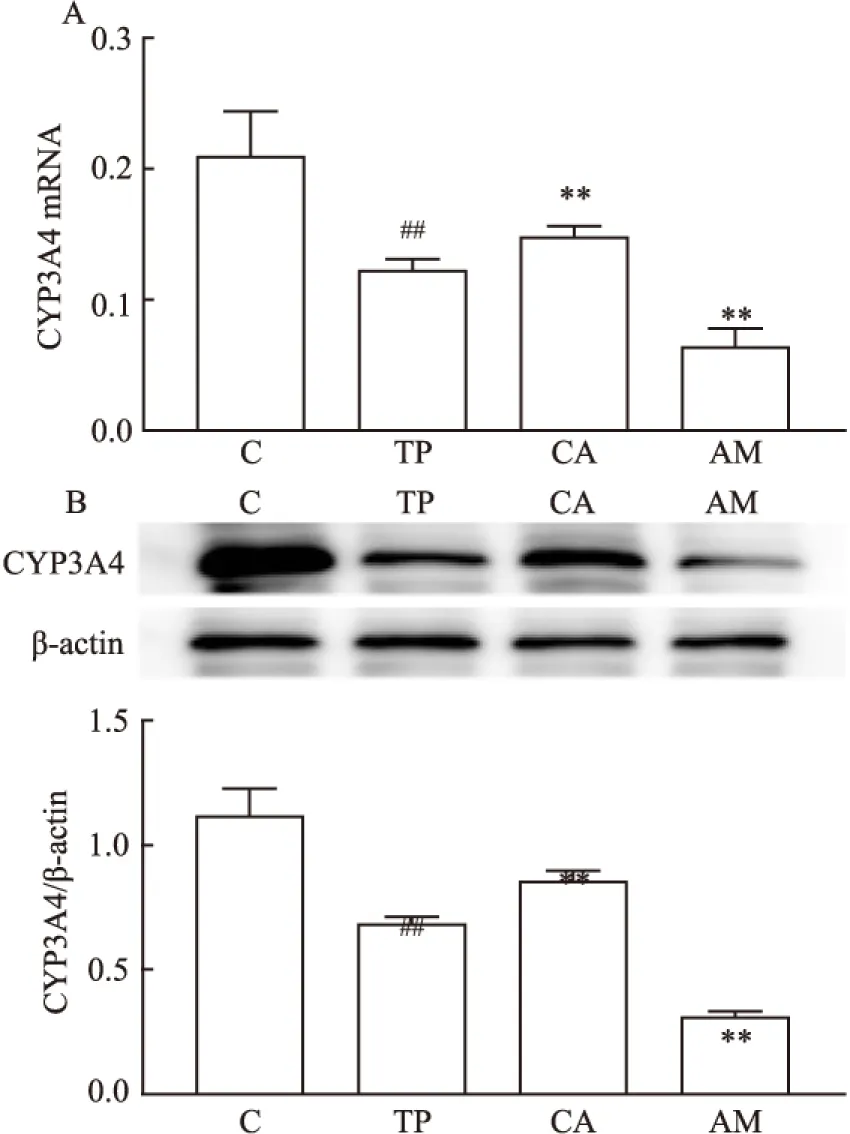
图4 联合用药后各组CYP3A4 mRNA和蛋白表达水平
A:CYP3A4 mRNA水平;B:CYP3A4蛋白表达水平;C: 正常组;TP:TP组;CA:TP+CBZ组;AM:TP+AML组;与C组比较:##P<0.01;与TP组比较:**P<0.01
2.6 小鼠肝脏HE染色结果与血清AST、ALT的含量HE染色结果显示TP+AML组肝脏损伤最为严重,AST及ALT的含量最高。其次是TP组,程度最轻的是TP+CBZ组。见图6。
2.7 各组小鼠肝脏中CYP3A4的mRNA及蛋白表达水平结果显示TP+AML组的CYP3A4的mRNA及蛋白表达最低,其次是TP组,降低最少的是TP+CBZ组。见图7。
2.8 各组小鼠血清中TP的含量高效液相色谱结果显示各组小鼠血清中TP的含量如表1,结果显示TP+AML组中TP的含量最高,TP+CBZ组中TP的含量最低。
3 讨论
既往研究[9]表明,TP可通过多种机制引起肝损伤,如诱导细胞凋亡、诱导氧化应激、诱导诱导型一氧化氮合酶表达、引起免疫损伤等,其中CYP450代谢异常是药物性肝损伤的主要发病机制之一[10]。一项关于肝脏小鼠模型的研究[11]报道,肝脏CYP450的失活抑制了肝脏中的TP代谢,导致该化合物的生物利用度和毒性增加。

图5 高效液相色谱图
A:未添加;B:添加TP;C:添加地西泮;D:添加地西泮和TP;1:地西泮(内标);2:TP
CYP450酶参与大多数异生化合物的生物转化[12]。CYP3A4是CYP450的一种亚型,TP主要被CYP3A代谢[10]。CYP3A4不仅参与了TP的代谢,TP对它还有一定的抑制作用[13]。本研究以正常肝细胞L-02 和C57BL/6雄性小鼠为对象,探讨CYP3A4在TP对肝损伤中的作用。
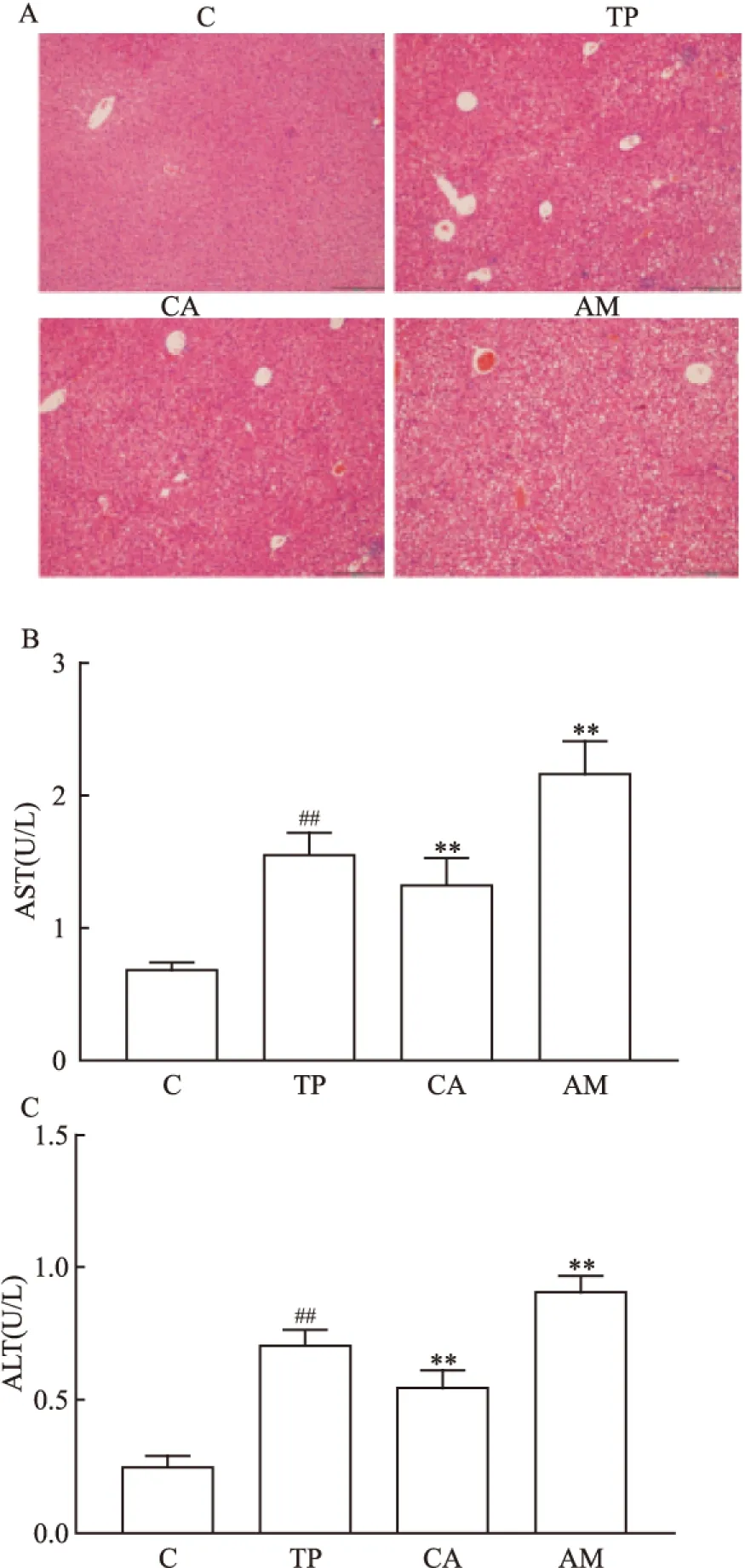
图6 肝脏HE染色结果与血清AST、ALT的含量
A: HE染色结果×200(空泡代表肝脏损伤);B:小鼠血清中AST含量;C: 小鼠血清中ALT含量; C:正常组;TP:TP组;CA:TP+CBZ组;AM:TP+AML组;与C组比较:##P<0.01;与TP组比较:**P<0.01
本研究的体内外实验结果显示TP对L-02细胞和C57BL/6雄性小鼠的CYP3A4的表达均有明显的抑制作用,与此同时,TP对L-02细胞和C57BL/6小鼠肝脏均有损伤作用。加入CYP3A4抑制剂AML后,CYP3A4的表达进一步减少,TP含量明显增加,提示TP代谢降低,其结果是TP对L-02细胞以及小鼠肝脏的损伤增大;与之相反,加入CYP3A4诱导剂CBZ后,CYP3A4的表达明显增加,TP含量明显降低,提示TP代谢加速,产生的结果是TP对L-02细胞和小鼠肝脏的损伤则显著降低。

图7 联合用药后各组CYP3A4的蛋白及mRNA结果
A:CYP3A4 mRNA水平;B:CYP3A4蛋白表达水平;C: CYP3A4/β-actin; C:正常组;TP:TP组;CA:TP+CBZ组;AM:TP+AML组;与C组比较:##P<0.01;与TP组比较:**P<0.01
由上述结果可能得出结论,TP通过抑制了CYP3A4的表达,减慢自身代谢,因而造成对了肝脏的损伤,但是否是产生肝损伤的主要机制还有待下一步的实验证明。
