miR-486-5p靶向FOXO1抑制结肠癌干细胞干性的初步研究
2020-06-11龚立刚艾成思王梦萍
龚立刚,艾成思,王梦萍
结肠癌(colorectal cancer, CRC)是常见的消化系统恶性肿瘤,在世界肿瘤相关死亡中位居第四位[1]。虽然CRC的手术治疗和化疗在过去几年取得了较大的进展,但CRC患者的预后较差,5年生存率仅为50%~65%[2]。CRC是较为复杂的疾病,以腺瘤开始在慢性炎症和持续感染等因素作用下经过上皮细胞和癌前细胞突变的累积演变而来,但其发生发展的具体作用机制尚未明确[3]。同时CRC的重要特征为淋巴细胞浸润和转移,而转移导致的治疗困难是CRC患者死亡的重要原因[4]。因此,寻找CRC恶性进展过程中发挥关键作用的调控因子,抑制其恶性生物学行为有助于改善患者预后。miRNAs是一类非编码小RNA,在肿瘤中表达异常,参与肿瘤的增殖、侵袭和转移等过程,广泛调控肿瘤细胞的恶性行为[5-6]。而肿瘤干细胞(cancer stem cells, CSCs)是肿瘤发生、复发、转移和耐药的主要原因[7],而miRNAs在调控CSCs中的重要作用已经在多种肿瘤中被证实[8]。miR-486-5p是目前研究较为成熟的miRNAs之一,在多种肿瘤中表达异常,其在CRC中低表达,并靶向多形性腺瘤基因1样锌指2(pleomorphic adenoma gene 1 like zinc finger 2, PLAGL2)参与致癌作用[9-10]。但miR-486-5p是否调控CRC CSCs未见有文献报道,故该文旨在研究miR-486-5p与CRC CSCs的调控作用及初步作用机制。
1 材料与方法
1.1 主要试剂TRIzol、反转录和qRT-PCR试剂盒购自日本TaKaRa公司;CRC细胞系和正常结肠细胞系NCM460购自美国ATCC细胞库;细胞培养基及FBS购自美国Gibco公司;miR-486-5p mimic、突变型和野生型对叉头盒O1(forkhead box class O1,FOXO1)的3’-非翻译区(3’-UTR)荧光素酶报告载体(FOXO1-wt、FOXO1-mut)及miR-486-5p过表达质粒购自上海生工公司;MTS购自美国Promega公司;Transwell小室购自美国Corning公司;Nanog、SOX2、OCT4、GAPDH抗体购自英国Abcam公司;裸鼠购自北京维通利华实验技术有限公司。
1.2 qRT-PCRTRIzol裂解液提取细胞总RNA。设计合成miR-486-5p引物 F:5′-ACACTCCAGCT GGGTCCTGTACTGAGCTGCCC-3′ ,R:5′- CTCAACT GGTGTCGTGGAGTCGGCAATTCAGTTGAGCCCCGAG-3′,以总RNA逆转的cDNA作为模板按照说明书进行qRT-PCR。分析各样品的循环阈值(threshold cvcle,Ct),采用2-ΔΔCt法分析各组实验数据。
1.3 细胞培养与转染DMEM高糖+10% FBS培养SW480、SW620和HT29细胞,McCoy’s 5A+10% FBS培养HCT116细胞,RPMI-1640+10% FBS培养NCM460细胞。将HCT116细胞无血清培养出的肿瘤球制成单个细胞后依次与小鼠抗人CD133抗体、小鼠抗人CD44抗体包被的磁珠孵育,分选出CD133/CD44双阳性的细胞,无血清培养基中继续培养。流式细胞仪检测CSCs中CD133/CD44双阳性细胞率。CSCs铺至6孔板中,按说明书将对照组(NC)和miR-486-5p mimic转染试剂与脂质体2000混合后转染至CSCs中,放至培养箱中培养。
1.4 MTS实验收集转染48 h的各组细胞,以每组每孔2×103个细胞接种于96孔板中培养,共铺0、24、48和72 h的细胞量,组内设置6个复孔,在相应的时间每孔加入30 μl MTS试剂,并在37℃细胞培养箱中孵育2 h,酶标仪490 nm处检测各孔的吸光度(optical density, OD)值。
1.5 Transwell小室法检测细胞转移能力收集转染48 h后的各组细胞无血清培养基洗3次,以每孔1×105个细胞、100 μl无血清培养基接种于Transwell小室中,500 μl的完全培养基加入下室,放至培养箱中培养,10 h终止培养,甲醛固定5 min,苏木精染色。显微镜下随机计数5个视野膜上的细胞数目。
1.6 Boyden法检测细胞侵袭能力收集转染48 h后的各组细胞无血清培养基洗3次,以每孔1×105个细胞、100 μl无血清培养基接种于Boyden上,其他步骤同Transwell小室实验。
1.7 裸鼠移植瘤模型的构建miR-486-5p过表达质粒及其对照质粒vector,与脂质体2000混合后转染CSCs,96 h后更换含1.0 μg/ml 遗传霉素 (geneticin, G418)的新鲜培养基筛选稳定表达的细胞,隔天更换1次,直至所有细胞均可观察到荧光。将筛选的稳转细胞株CSCsmiR-486-5p和CSCsvector以6×107个/ml分别注射到4周龄左右的裸鼠右侧腋下。每4 d测量1次瘤子的体积,4周后处死裸鼠,该实验的所有操作均符合动物伦理学。
1.8 miR-486-5p靶基因的验证TargetScan 7.1软件(http://www.targetscan.org/)预测miR-486-5p的靶基因。双荧光素酶报道基因实验分别将以下4组共转染到CSCs中:FOXO1-wt与miR-486-5p mimics共转染组(FOXO1-wt + miR-486-5p);FOXO1-wt与NC共转染组(FOXO1-wt+NC);FOXO1-mut与miR-486-5p mimics共转染组(FOXO1-mut+miR-486-5p);FOXO1-mut与NC共转染组(FOXO1-mut+NC),收集转染48 h的各组细胞,根据双荧光素酶报道基因检测说明书检测各组荧光素酶活性。
1.9 Western blot检测蛋白表达各组细胞加入RIPA冰上裂解10 min后,超声仪裂解30 min后离心。将上清液移至新的EP管中,BCA液检测蛋白浓度后煮沸变性,50 μg蛋白上样进行SDS-PAGE电泳分离,湿转,8%脱脂牛奶室温封闭1 h,Nanog、SOX2、OCT4、GAPDH(稀释浓度为1 ∶1 000)一抗4 ℃孵育过夜,TBST洗3次后,室温孵育兔二抗(稀释浓度为1 ∶8 000)1 h,采用ECL化学发光法曝光条带。
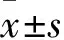
2 结果
2.1 qRT-PCR检测miR-486-5p在CRC细胞系中的表达qRT-PCR检测miR-486-5p在CRC细胞系SW480、HCT116、SW620和HT29中的表达分别为0.45±0.08、0.67±0.09、0.38±0.10、0.81±0.13,在正常结肠细胞系NCM460中的表达为1.01±0.04,miR-486-5p在CRC细胞系中的表达低于正常CRC细胞系中的表达(F=15.43,t=0.036)。见图1。
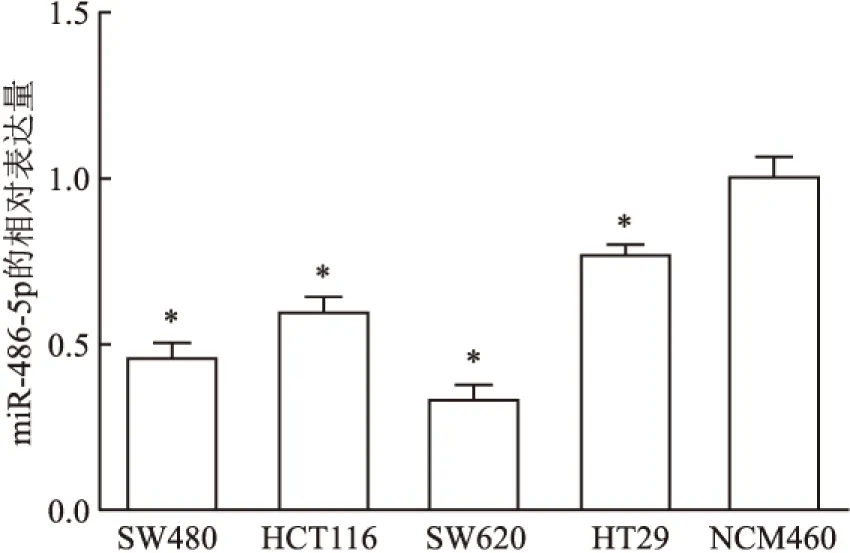
图1 miR-486-5p在CRC细胞系中的表达
2.2 CRC CSCs的分选与鉴定利用抗体包被的磁珠从HCT116细胞培养的肿瘤球中(图2A)分选出CD133/CD44双阳性的细胞(图2B),扩大培养后流式细胞仪检测CD133/CD44双阳性细胞为94.06%,Western blot检测Nanog、OCT4和SOX2干性标志蛋白在CD133/CD44双阳性细胞中的表达高于在CD133/CD44非双阳性细胞中的表达(图2C)。
2.3 miR-486-5p在CRC CSCs中的表达qRT-PCR结果显示miR-486-5p在CSCs(CD133/CD44双阳性)中的表达为0.31±0.06 低于在HCT116(CD133/CD44非双阳性)中的表达1.01±0.04。miR-486-5p mimic转染CSCs,qRT-PCR检测显示miR-486-5p mimic组中miR-486-5p的表达(9.36±1.15)高于NC组(1.05±0.05),均P<0.05(图3)。

图2 CRC CSCs的分选与鉴定
A:无血清培养的HCT116细胞肿瘤球 ×100;B:磁珠分选出的HCT116细胞肿瘤球 ×100;C:Nanog、OCT4和SOX2干性标志蛋白在CD133/CD44双阳性细胞中的表达
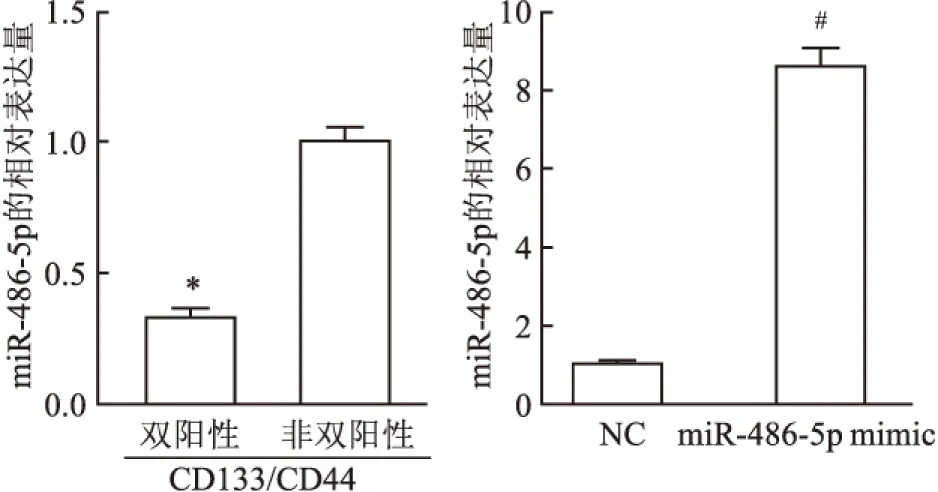
图3 qRT-PCR检测miR-486-5p在CRC CSCs中的表达水平
与CD133/CD44非双阳性细胞比较:*P<0.05;与NC组比较,#P<0.05
2.4 MTS检测miR-486-5p过表达对CSCs增殖的影响采用MTS法研究miR-486-5p对CSCs细胞增殖能力的影响,与NC组相比,miR-486-5p mimic组细胞增殖能力减慢(P<0.05,图4)。
2.5 Transwell小室检测miR-486-5p过表达对CSCs转移能力的影响采用Transwell小室研究miR-486-5p对CSCs细胞转移能力的影响, miR-486-5p mimic和NC组细胞穿膜数分别为(110.01±10.99)、(168.22±15.37)个。miR-486-5p mimic组细胞转移能力低于NC组(P<0.05,图5)。
2.6 Boyden检测miR-486-5p过表达对CSCs侵袭能力的影响采用Boyden小室研究miR-486-5p对CSCs侵袭能力的影响miR-486-5p mimic和NC组细胞穿膜数分别为(82.35±14.67)、(138.68±11.93)个。miR-486-5p mimic组细胞侵袭能力低于NC组(P<0.05,图6)。
2.7 miR-486-5p对CSCs体内致瘤能力的影响将稳转细胞系CSCsmiR-486-5p和CSCsvector注射到裸鼠右侧腋下,观察皮下瘤体的生长速度,每隔3 d测量1次成瘤体积,绘制瘤体积曲线,4周左右时处死裸鼠,解剖出瘤体,观察瘤体的大体观。结果显示:CSCsmiR-486-5p组裸鼠体积显著低于CSCsvector组(图7A、B),差异有统计学意义。

图7 miR-486-5p对CRC CSCs细胞体内致瘤性的影响
A:裸鼠解剖瘤体大小;B:裸鼠成瘤体积;与CSCsvecto比较:*P<0.05
2.8 miR-486-5p对FOXO1的调控TargetScan 7.1软件在线预测显示FOXO1启动子区有miR-486-5p的结合位点(图8A)。近一步双荧光素酶报道基因实验显示:与FOXO1-wt+NC共转染组相比,FOXO1-wt+miR-486-5p共转染组的荧光素酶活性降低(P<0.05);而FOXO1-mut+NC和FOXO1-mut+miR-486-5p组之间的荧光素酶活性无显著差异(P>0.05,图8B)。qRT-PCR结果显示,与NC转染组比较,miR-486-5p mimic组CSCs中FOXO1 mRNA表达水平下降(P<0.05,图8C)。
3 讨论
CRC是世界范围内常见的恶性肿瘤,肿瘤转移、复发及耐药导致患者的生存率不佳[1-2],虽然CRC的发病机制引起广大学者的关注,但是具体的发病机制尚未明确,因此从分子水平研究CRC的发生发展机制以寻找治疗CRC的候选靶点仍迫切需要。miRNAs是非编码RNA家族中的小RNA,长度为19 ~ 25 bp,密切参与人类肿瘤的发生发展。研究[6]发现CRC中存在miRNAs异常表达谱,miR-34a在奥沙利铂耐药CRC患者组织中低表达,外源性miR-34a的异位表达可使多药耐药的CRC HCT-8/OR细胞重新奥沙利铂的治疗增敏,而miR-34a的抑制增强了HCT-8细胞对奥沙利铂的抗性,提示miRNAs具有作为药物靶点的潜能,为研究肿瘤治疗的热点。
图8 miR-486-5p对FOXO1的调控作用
A:TargetScan 7.1软件预测FOXO1与miR-486-5p的结合位点;B:双荧光素酶报道基因试验检测miR-486-5p靶向FOXO1;C:qRT-PCR检测FOXO1 mRNA在miR-486-5p mimic组中的表达水平;与NC组比较:*P<0.05,#P<0.05
CSCs是可以从肿瘤组织和细胞中培养分离出的具有干细胞相似功能,即多能性和分化潜能的一类细胞[7],CSCs的分离和培养方法的日渐成熟,从CSCs的角度研究CRC新的治疗方法具有重大意义。CSCs的恶性生物学行为即增殖、侵袭、转移和体内致瘤性等统称为CSCs的干性[11],miRNAs在调控CSCs干性方面的重要作用也逐步被证实。文献报道miR-486-5p在CRC中低表达,其中Liu et al[9]研究发现miR-486-5p下降与TNM晚期、肿瘤大小、淋巴结转移和预后不良有关,上调miR-486-5p抑制CRC细胞增殖和迁移。Zhang et al[10]报道miR-486-5p通过靶向PIK3R1减少AKT信号通路的激活来抑制CRC的进展。miR-486-5p在CRC中低表达是否调控CRC CSCs的干性未见有报道,Shaham et al[12]在儿童急性髓性白血病研究中发现miR-486-5p的异位表达可以增强原发性胎肝造血祖细胞的自我更新能力,提示miR-486-5p可能参与调控CSCs的干性。本研究显示miR-486-5p在CRC细胞系中的表达水平均低于正常细胞系中的表达水平,与已有的报道研究一致[9-10],表明miR-486-5p在CRC中可能为抑癌因子。为研究miR-486-5p是否调控CRC CSCs的干性,首先培养CRC CSCs,qRT-PCR检测结果显示miR-486-5p在CSCs中的表达低于CD133/CD44非双阳性的细胞,而miR-486-5p mimic转染CSCs,MTS增殖实验、Transwell、Boyden和体内裸鼠成瘤实验结果显示miR-486-5p过表达后CSCs增殖、转移、侵袭和体内致瘤能力均下降。
已经观察到miR-486-5p过表达抑制CRC CSCs的干性,但是其具体的作用机制需进一步研究。miRNAs 通过与靶基因mRNA的3’UTR区结合在转录后水平负调控靶基因的表达。已经证实的miR-486-5p的miR-486-5p靶基因为PLAGL2、PIK3R1等基因[9-10]。TargetScan7.1预测软件预测miR-486-5p存在上百个靶基因,其中转录因子FOXO1属于叉头O家族蛋白,在多种肿瘤中表达异常,在CRC中表达增加为癌基因[13]。而同时FOXO1与CSCs的调控具有密切关系,FOXO1在乳腺癌中促进CSCs肿瘤球形成[14];FOXO1在人急性髓性白血病CD34+细胞中的表达促进其自我更新能力,是激活干细胞分子特征所必须的,靶向FOXO1可能是在白血病前期和白血病期消除干细胞的潜在治疗策略[15]。因此课题组设想miR-486-5p可能通过靶向抑制FOXO1的表达调控CRC CSCs的干性,对此采用双荧光素酶报道基因实验验证miR-486-5p是否直接靶向调控FOXO1,结果证实FOXO1为miR-486-5p直接调控的靶基因。同时CRC CSCs转染miR-486-5p mimic后,qRT-PCR结果显示CSCs中FOXO1 mRNA表达水平减少,表明miR-486-5p可能通过靶向负调控FOXO1抑制CRC CSCs的干性,但其深入的作用机制需在后续研究中进行探讨。
综上所述,miR-486-5p低表达于CRC细胞系和CSCs中,在CSCs中过表达miR-486-5p显著抑制CSCs的增殖、转移、侵袭和体内致瘤能力,其初步机制可能是通过负调控FOXO1抑制CSCs的干性,miR-486-5p可能为消除CSCs治疗CRC的潜在靶点。
