经颈动脉插管行Krebs-Henseleit液预交换的离体心脏灌注技术
2020-06-09郭书栋李彤米睿郑伟锋胡晓旻齐振昌宋元申王成蕊
郭书栋 李彤 米睿 郑伟锋 胡晓旻 齐振昌 宋元申 王成蕊
1天津医科大学三中心临床学院(天津300170);2天津市第三中心医院心外科(天津300170);3天津市人工细胞重点实验室,卫生部人工细胞工程技术研究中心(天津300170)
离体心脏灌注技术是指将实验动物心脏离体后,连接到特定的体外灌流装置,以血液或灌流液灌注心脏,进行心脏体外研究的实验技术[1]。目前常用的离体心脏灌注模式有Langendorff 和Working heart 两种[2-3]。因为排除了神经体液干扰,具有较好的稳定性和可重复性等优点,离体心脏灌注技术在心血管生理、生化及药理等研究领域得到了广泛应用[4-8]。然而,传统的心脏离体手术中存在一些不可避免的局限性[9-11]:心脏离体过程中存在缺氧、停止灌注;修剪、排空心脏过程中的停跳和机械损伤;恢复灌注后缺血-再灌注损伤及心律失常等。为了弥补传统心脏离体灌注技术的不足,本实验探索了一种新的心脏离体灌注技术,避免了大鼠心脏离体过程缺血、缺氧、停跳,缺血再灌注等损伤,克服了再灌注后心律失常等局限性,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF 级SD 大鼠20 只,雄性,体质量300~350 g,由中国食品药品检定研究院(大兴)提供[SCXK(京)2017-0005],本研究在实验动物饲养和实验过程中完全做到按实验动物使用“减少、替代和优化”3R 原则给予人道的关怀,并经天津医科大学三中心临床学院医学伦理委员会批准实验。
1.1.2 设备及试剂离体心脏灌流系统(中国普升科技有限公司,Radnoti)、PH 仪(中国上海仪电科学仪器股份有限公司,PHS-3C)、多导联生理记录仪(美国Biopac MP150)、小动物呼吸机(美国Kent Scientific 公司,TOPO)、小动物外科器械包、肝素钠(森诺生物科技有限公司)、余分析纯试剂均购于天津福成化学试剂有限公司。
1.2 实验方法
1.2.1 Krebs-Henseleit液(K-H液)配置配置K-H液,以1 L为例:氯化钠6.924 g、碳酸氢钠2.080 g、氯化钾0.350 g、磷酸二氢钾0.163 g、葡萄糖1.800 g、硫酸镁0.144 g、二水氯化钙0.265 g,将前6 种分析纯试剂依次溶于常温去离子水,二水氯化钙单独溶解后缓慢倒入,充分搅拌至完全溶解,定容至1 L;K-H 液pH 7.3~7.4,所有K-H 液配置完成后均进行过滤。
1.2.2 分组及离体心脏灌注模型制备应用随机数字表法将20 只SD 大鼠随机分为两组:传统离体心脏灌注技术组(T 组,n= 10)和改进离体心脏灌注技术组(M 组,n=10)。
1.2.2.1 传统离体心脏灌注技术组(T 组)及操作步骤(1)禁食12 h;(2)称重;(3)全身肝素化:以200 IU/100 g 剂量肝素于术前1 h 腹腔注射;(4)麻醉:以3%的戊巴比妥钠溶液(50 mg/kg)进行腹腔注射;(5)固定;(6)快速开胸,暴露心脏;(7)游离心脏:提起心脏根部,剪断心脏远端血管,尽量保留较长的主动脉;(8)心脏排血与修剪,将心脏放到含有4 ℃的生理盐水平皿中按压心脏,挤出心腔中残余血液,修剪主动脉,方便挂机灌注;(9)心脏挂机灌注,灌注针插入主动脉不宜过深,以免插入左室,影响心脏灌注;从开胸到心脏离体灌注保持在90 s 以内完成。
1.2.2.2 改进离体心脏灌注技术组(M 组)及操作步骤(1)禁食12 h;(2)称重;(3)麻醉:以3%的戊巴比妥钠溶液(50 mg/kg)进行腹腔注射;(4)固定、脱毛、消毒。(5)颈部切开,气管插管;(6)开胸和心脏暴露;(7)游离胸腺;(8)游离右侧颈动脉;(9)游离主肺间隔;(10)颈动脉插管;(11)经颈动脉K-H 液预交换:用医用延长导管将颈动脉灌注针头和Radnoti 灌注系统连接,连接前注意全程管路预充K-H 液排气。剪破下腔静脉与右侧上腔静脉,剪破左心耳,打开动脉夹,开始经颈动脉灌注心脏,待心脏跳动5 s 后,夹闭主动脉,再持续灌注2 min,使心脏血液交换为K-H 液;(12)心脏游离;(13)颈动脉-主动脉交换灌注:关闭颈动脉灌注通道,交换至主动脉灌注(图1)。
1.2.2.3 灌注策略两组均采用Radnoti 离体心脏灌注系统灌注,维持以下恒定状态:恒温:(37 ±0.5)℃,恒压:(65 ± 5)mmHg;以95%O2+5%CO2混合气持续对K-H 液进行鼓泡式氧合。
1.2.3 心脏复苏及存活时间记录以K-H 液灌注开始为时间零点,分别记录两组(1)离体心脏灌注-复跳时间:灌注开始到心脏第一次起跳的时间;(2)复跳-稳定跳动时间:心脏复跳到第1 次1 min内无心律失常的时间;(3)存活时间:心脏灌注复跳开始到心脏停跳时间。
1.2.4 冠脉流量测定两组均在以下时点测量:开始灌注后1、5、10、15、30 min、1、2 h 时1 min 内的冠脉流量。

图1 改进离体心脏灌注技术手术流程图Fig.1 The modified surgical procedure diagram of isolated cardiac perfusion technique
1.2.5 心率与心律失常评分两组开胸前均记录基础心率,改进组在心脏未离体前以3 个电极分别接到大鼠的右上肢,左下肢,右下肢记录心电,心脏离体后两组均以接触式电极贴于心尖部,以Biopac MP150 多导联生理记录仪持续记录心电图参数。心律失常评判参考Curis-Walker Score E 评分标准[12]:(1)0 分:<20 次室性早搏(VPB);(2)1分:21 ~100次VPB;(3)2分:>100次VPB和/(或)1 ~3 次室性心动过速(VT);(4)3 分:>3 次VT;(5)4 分:可自发转为窦律的室颤(SVF);(6)5 分:1 ~2 次不可转为窦律的室颤(NVF);(7)6 分:3 ~5 次NVF;(8)7 分:>5 次NVF,对两组2 h 内心律失常发生进行评分。
1.3 统计学方法采用SPSS 22.0 软件分析数据,生存及复跳时间以中位数表示,组间比较采用两组独立样本秩和检验;符合正态分布的计量数据以(>)表示,组间比较采用两独立样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组离体心脏灌注-复跳及复跳-稳定跳动情况离体心脏经过缺血再灌注会导致心律失常,观察结果显示:传统组离体心脏最长灌注-复跳时间5 s,最短灌注-复跳时间2 s,灌注-复跳中位时间3 s;传统组离体心脏最长复跳-稳定跳动时间8.8 min,最短复跳-稳定跳动时间4.2 min,复跳-稳定跳动中位时间5.05 min;改进组离体心脏持续稳定跳动,不存在停止灌注情况,不存在心律失常情况,与传统组相比差异具有统计学意义(P<0.001),离体后更好的保持了心脏功能的稳定(表1)。

表1 两组离体心脏灌注-复跳时间,复跳-稳定跳动时间情况Tab.1 Heart Perfusion-Rebeat time and Rebeat-Steady beat time of two groups
2.2 两组离体心脏存活时间心脏离体后生理功能会持续恶化,导致心脏生存时间有限。实验结果表明:改进组离体心脏存活时间(8.55 h)显著长于传统组(5.2 h)(P<0.001);相比于传统的心脏分离方式,改进组对心脏功能保护和心脏生理状态维持更具有优势,使离体状态下心脏存活更长时间(图2、表2)。
2.3 两组冠脉流量比较离体心脏心肌代谢水平和冠脉流量密切相关,同时也反应了冠脉通畅水平。实验结果显示:传统组离体心脏灌注后1 min内冠脉流量为(5.17±0.94)mL/min,改进组为(9.59±0.80)mL/min,两组灌注后1 min 内冠脉流量差异具有统计学意义(P<0.001)。灌注开始前,传统组心脏处于缺血、缺氧、低温的应激状态,本实验观察到传统组离体心脏在灌注刚开始时,生理和代谢状态仍处于较低的水平,表现为初始冠脉流量低于正常值;相比于改进组,离体心脏经过缺血、缺氧、低温的打击后,冠脉流量在30 min、1、2 h 时出现显著降低,差异具有统计学意义(P<0.05),并随着时间增加冠脉流量进一步下降(图3、表3)。

图2 两组心脏存活时间比较Fig.2 Comparation of the survival time between the two groups

表2 两组心脏存活时间Tab.2 Heart survival time of two groups h

图3 两组冠脉流量随时间变化情况Fig.3 Changes of coronary flow with time in the two groups
表3 两组不同时点冠脉流量情况Tab.3 Coronary flow at different time points in the two groups ±s>
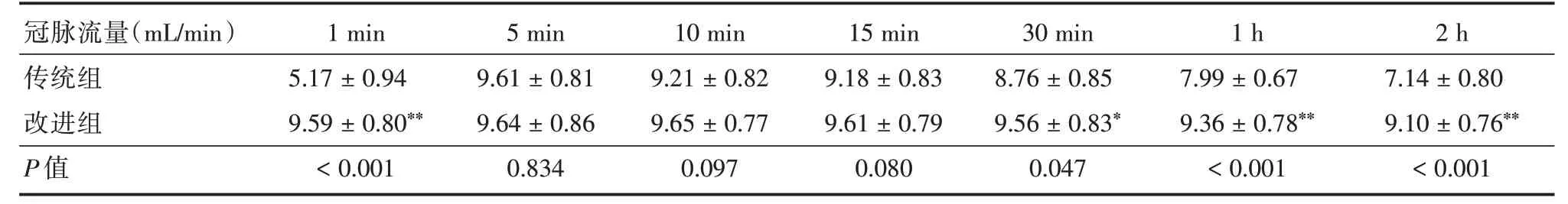
表3 两组不同时点冠脉流量情况Tab.3 Coronary flow at different time points in the two groups ±s>
注:与传统组相比,*P <0.05,**P <0.001
冠脉流量(mL/min)传统组改进组P 值1 min 5.17±0.94 9.59±0.80**<0.001 5 min 9.61±0.81 9.64±0.86 0.834 10 min 9.21±0.82 9.65±0.77 0.097 15 min 9.18±0.83 9.61±0.79 0.080 30 min 8.76±0.85 9.56±0.83*0.047 1 h 7.99±0.67 9.36±0.78**<0.001 2 h 7.14±0.80 9.10±0.76**<0.001
2.4 两组心率情况两组心脏在离体前基础心率差异不具有统计学意义(P>0.05);与传统组相比,改进组离体心脏于再灌注1、5、10、15、30 min、1 h、2 h 时的心率显著高于传统组,差异具有统计学意义(均P<0.001),且心率差距随着时间增加而增大(图4、表4)。
2.5 两组心律失常比较传统组心脏离体方式不可避免的导致再灌注后心律失常,实验结果表明:传统组离体心脏在0 ~30 min 内的心律失常评分为(2.5 ± 1.6)分,心律失常发作总时程为(153 ±48.7)s,心律失常发生率为100%,其中心律失常类型以室早、室速为主,发生率均为100%,而室颤发生率相对较低,仅为20%。随着离体心脏跳动时间增加,更严重的心律失常类型和发生频率也随之增加;实验结果表明0 ~2 h 总评分为(3.2±1.8)分,心律失常发作总时程为(349 ± 67.1)s,室颤发生率上升至40%。与传统组相比,改进组组所有离体心脏全程均未有心律失常发生,差异具有统计学意义(P<0.001,表5、6)。

图4 两组心率随时间变化情况(次/min)Fig.4 The changes of heart rate with time in the two group(BPM)
表4 两组不同时间的心率情况Tab.4 Heart rate at different time in the two groups ±s>

表4 两组不同时间的心率情况Tab.4 Heart rate at different time in the two groups ±s>
注:与传统组相比,*P <0.05,**P <0.001
心率(次/min)传统组改进组P 值基础401.0±22.1 400.9±21.6 0.992 1 min 165.1±18.7 316.8±7.6**<0.001 5 min 251.8±15.7 317.2±7.6**<0.001 10 min 279.6±7.3 318.1±7.6**<0.001 15 min 280.1±5.7 319.3±7.6**<0.001 30 min 282.6±4.9 321.5±7.6**<0.001 1 h 277.5±6.6 320.6±7.6**<0.001 2 h 272.1±6.1 320.4±7.7**<0.001

表5 两组0 ~30 min 心律失常评分比较Tab.5 Comparison of Arrhythmia score between two groups at 0 ~30 min

表6 两组0 ~2 h 心律失常评分比较Tab.6 Comparison of Arrhythmia score between two groups at 0 ~2 h
3 讨论
Langendorff 提出的离体心脏灌注方法使心脏研究领域获益100 余年,众多研究者不断对其进行改进并扩展应用于各类型哺乳实验动物,如大鼠、小鼠、兔、狗、猪等[11-15],使之成为了近现代心脏研究领域广泛应用的模型。其中应用最为广泛的离体心脏研究动物为大鼠,然而该模型所采用的心脏分离方法至今未有显著改进,应用传统的心脏分离方法不可避免的存在缺血、缺氧损伤,机械操作损伤及心律失常等问题,进而在一定程度上影响离体后心脏生理状态和功能。
大量研究表明心脏经过缺血再灌注会导致心律失常,其机制主要涉及钙超载[16-18]和氧自由基增加[19-21]等,避免心脏离体过程中缺血再灌注可以有效的减少心律失常的发生。从改进组心律失常的观测结果可以看出,未经历缺血再灌注的心脏在实验全程中均未有心律失常出现,这与现有理论相一致。传统方法分离的心脏需要等待10 ~20 min 作为心脏稳定期,才能开始实验,而改进组在心脏离体后就已经处于稳定跳动状态,不需要等待稳定,可以更快开展实验。
相比于传统组,改进组离体心脏未经历过缺血再灌注,缺氧,低温,操作损伤的离体心脏,其心率,冠脉流量均显著提高,其反应的就是改进组的离体心脏具有更好的生理状态、更高的心肌活性,酶活性及代谢水平[22-25],心脏功能得到了最大限度的保持,生理活性更接近在体时的心脏。
本研究创新地改变大鼠心脏离体的手术方式,通过颈动脉插管来实现持续灌注状态下分离心脏,从根本上克服了传统心脏分离方式的局限性,实现了大鼠离体心脏模灌注模型制备技术的重大突破。
本研究的改进心脏离体灌注方法的优势有:(1)心脏离体过程实现了持续灌注,全程无热缺血,冷缺血,缺氧,挤压心脏,停跳,缺血再灌注等问题。特别是对于离体心脏凋亡,自噬等研究具有重要意义。(2)复跳后心脏无心律失常,心脏功能和存活时间显著高于经典方法。该改进方法同时也存在局限性,如:实现离体心脏持续灌注对外科手术技术要求较高,该技术学习周期相对较长等缺点。本实验团队将在后续阶段进行左室测压、心肌酶、分子生物学、代谢组学等方面实验,进一步完善该改进技术的优势论证,简化手术操作。综上所述,本实验探索的改进大鼠心脏离体灌注技术可以为心脏生理学,药理学等研究提供更合适的离体心脏模型,以此模型开展的心脏药理学研究可以更好的指导临床药物应用,并且此种心脏分离方法可以广泛应用于心脏移植中的供体获取与保存,为将来无损心脏获取和保存提供新手段。
