PD-L1在肿瘤细胞中表达调控机制研究进展
2020-06-09宋若飘臧爱民贾友超
宋若飘 臧爱民 贾友超
河北大学附属医院肿瘤内科,河北省肿瘤放化疗机制与规程研究重点实验室(河北保定071000)
程序性死亡受体1/程序性死亡配体1 信号通路(programmed cell death protein 1/Programmed death-ligand 1,PD-1/PD-L1)作为肿瘤免疫逃逸的重要途径是目前研究的热点。肿瘤细胞表达PDL1,抗PD-L1 抗体减少肿瘤发生和肿瘤侵袭性,增强细胞毒性T 细胞介导的肿瘤细胞溶解。但由于PD-L1 在肿瘤细胞中表达的多样性,这使得PD-L1表达的调控机制成为了人们关注的焦点。靶向细胞PD-1/PD-L1 的药物在免疫检查点治疗中取得了巨大的临床进展,包括黑色素瘤,非小细胞肺癌,霍奇金淋巴瘤,膀胱癌,头颈部鳞状细胞癌[1],错配修复缺陷实体肿瘤[2]等。但其持久客观反应在不同肿瘤类型之间是不同的,PD-L1 的表达与抗PD-1/PD-L1 阻滞剂在不同肿瘤中的预后及客观反应率相关,但效果却不尽相同。研究发现,PD-L1高表达与非小细胞肺癌、胃癌、食管癌、卵巢癌和其他癌症的总体生存率显著降低相关。然而,某些研究报道高PD-L1 表达可预测良好的预后。PD-L1 阳性表达对部分黑色素瘤(客观反应率26%)和非小细胞肺癌(客观反应率30%)患者的预后和客观反应较好[3]。此外,研究发现抗PD-1/PD-L1 药物不仅对PD-L1 阳性表达的患者有益,对PD-L1 低表达或者阴性表达的肿瘤患者仍可受益,在非小细胞肺癌患者中,纳武单抗和ipilimumab 联合一线治疗的总生存期比化疗的长,与PD-L1 表达水平无关[4]。然而,一些研究发现在常规抗肿瘤药物如mTOR 抑制剂治疗肿瘤过程中,潜在的宿主免疫细胞上诱导表达的PD-L1 可能是不可忽视的贡献于肿瘤免疫逃逸的力量。因此,阻断PD-1/PD-L1 通路在肿瘤治疗中有效性以及PD-L1 表达对免疫检查点抑制剂的不同反应突出了研究PDL1 调控机制的重要性。本文对免疫细胞上表达的PD-L1 对免疫调控做初步说明,并根据PD-L1 在肿瘤细胞中表达,回顾了PD-L1 表达的多层调控机制。
1 PD-L1在肿瘤细胞和宿主免疫细胞中表达
程序性死亡配体1(programmed cell death ligand 1,PD-L1),一种由激活的CD8+T 细胞表达的抑制性受体,主要在两大类细胞中表达,包括一些宿主免疫细胞和大部分肿瘤细胞。PD-L1 在宿主免疫细胞上的表达分为诱导性表达和组成型表达。例如,在造血系统中选择性抑制mTORC1 信号通路会使得造血干细胞和前体细胞偏向于分化为一种高表达PD-L1 的新发现的先天髓样淋巴母细胞效应细胞。IFN-α和IFN-β可以诱导内皮细胞、单核细胞和树突状细胞中PD-L1 的表达[5]。研究发现,宿主免疫细胞上PD-L1 的表达可以促进肿瘤免疫逃逸。在肉瘤细胞中分别敲除和过表达PD-L1,证实了肿瘤细胞中的PD-L1 是促进肿瘤免疫逃逸的关键,在用IFN-γ阻断抗体治疗小鼠,在很大程度上消除了肿瘤细胞上的PD-L1 表达,但仅部分降低了肿瘤相关巨噬细胞上的PD-L1 水平,表明宿主细胞上PD-L1 的表达对肿瘤免疫逃逸也很重要[6]。
PD-L1 在肿瘤细胞中的表达是由内外因素共同作用的。PD-L1 的表达又可分为诱导性表达、微环境中的外源性因素表达和组成性表达、内源性肿瘤驱动基因改变表达。外源性因素,如γ-干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、表皮生长因子(epidermal growth factor,EGF)、白介素-17(IL-17)、白介素-27(IL-27)等细胞因子可以通过不同信号通路诱导PD-L1 表达[7]。内源性因素,是指癌基因或抑癌基因的改变可导致PD-L1 在癌细胞中的结构性表达,如MYC 蛋白过表达、RAS 癌基因突变、EGFR基因的激活突变均可以上调PD-L1,从而促进肿瘤免疫逃逸。
PD-L1 的生理功能是与T 细胞上的PD-1 受体结合,传递免疫抑制信号从而抑制效应T 细胞的活性来阻碍其对肿瘤细胞的杀伤。在肿瘤细胞中,PD-L1 利用这一通路抑制T 细胞活化,从而促进肿瘤免疫逃逸。在许多癌症中,肿瘤固有的PD-L1 信号通路通常处于异常激活状态。PD-L1异常激活的机制主要包括基因组改变(扩增和调节)、组成性癌基因信号激活、外源性因素和表观遗传机制如癌基因miRNAs 的上调、抑癌基因miRNAs 的下调、异常的DNA 甲基化和组蛋白修饰)。下面,回顾了近年来基因组改变、表观遗传机制和组成型癌基因信号激活水平调节PD-L1 表达的调控机制。
2 基因组扩增对PD-L1 表达的调控
PD-L1 基因位于9p24.1 号染色体上。研究发现9p24.1 的扩增与恶性细胞中PD-L1 表达增加密切相关。小细胞肺癌、宫颈癌、卵巢癌和前列腺癌等显示PD-L1所在的9p24染色体拷贝数增加。ZANUSSO 等[8]发 现,PD-L1 基 因Rs4143815 是 前列腺癌局部晚期前列腺癌放疗后生化复发的一个新的免疫遗传标志物。然而,在实体瘤中PD-L1 扩增的频率要低得多,在118 187 例未鉴定的肿瘤标本中,PD-L1 扩增在843 例中被鉴定,其中包括100 多种实体肿瘤[9]。并且免疫组化分析发现PD-L1 扩增与PD-L1 高阳性表达并不总是相关的。有PD-L1 基因改变的弥漫性大B 细胞淋巴瘤患者在一线化学免疫治疗后有较低的无进展生存期[10]。原发性中枢神经系统B 细胞淋巴瘤和原发性睾丸B 细胞淋巴瘤中PD-L1 的高表达也与9p24.1 的扩增相关,对抗PD-1 治疗有较高反应。
3 染色质修饰对PD-L1 表达的调控
DNA 甲基化和组蛋白修饰是最基本的表观遗传学,是癌症发展和进展的中心机制。DNA 甲基化和组蛋白修饰可以促进PD-L1 表达。在乳腺癌干细胞中研究发现上皮间充质转换相关的PD-L1过表达与翻译后组蛋白修饰密切相关[11]。PD-L1基因启动子区的组蛋白乙酰化是PD-L1 表达所必需的。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)增强了人黑色素瘤细胞系和小鼠黑色素瘤模型中PD-L1 的表达。在黑色素瘤中,通过增加PD-L1 启动子片段的活性,抑制一种i 类组蛋白去乙酰化酶8(histone deacetylase8,HDAC8)被证明能提高PD-L1 的表达[12]。最近的研究表明PD-L1 启动子的DNA 甲基化状态可以作为各种恶性肿瘤预后生物标志物[13]。在非小细胞肺癌小鼠模型中,抗PD-1 治疗可能通过PD-L1 启动子的甲基化促进耐药[14]。在原发性乳腺癌和大肠癌患者的外周血中发现PD-L1 异常的启动子甲基化可能是导致其表达上调的潜在机制[15]。因此,去甲基化抑制剂联合抗PD-L1 抗体可能是更有效的肿瘤治疗策略。然而,DNA 甲基化和组蛋白修饰也可以降低PD-L1 的表达。在头颈部鳞状细胞癌中PD-L1 启动子的低甲基化与其mRNA 和蛋白表达呈负相关[14],在大肠癌、前列腺癌[16]、胶质母细胞瘤[17]中同样发现PD-L1 甲基化与其mRNA 呈负相关。
4 PD-L1 表达的转录调控
4.1 MicroRNAs 对PD-L1 表达的调控MicroRNAs(miRNAs)是一类小的(18~25 个核苷酸)非编码RNA 分子,其主要能够通过与靶标基因3′UTR的完全或不完全配对,降解靶标基因mRNA 或抑制其翻译,调节不同类型癌症的基因表达、转录后和免疫反应。研究发现,miRNAs 与靶基因mRNA的3′-非翻译区(3′-UTR)结合,导致mRNA 切割或翻译抑制,从而起到负调控PD-L1 表达的作用。miRNAs 通过多种机制调节PD-L1 的表达。MiR-15a/b、MiR-16 和MiR-193a-3p 靶向PD-L1 3′UTR 降低恶性胸膜间皮瘤细胞PD-L1 表达[18]。在非小细胞肺癌中,野生型P53 诱导的miR-34a/b/c 可与PDL1 的3′-UTR 结合,促进PD-L1 mRNA 的降解,从而抑制非小细胞肺癌免疫逃逸。研究发现,miR-193a、miR-214、miR-200、miR-200c 等均可以调节PD-L1 表达,从而促进免疫逃逸(表1)。
HALVORSEN等[37]发现了7 个miRNAs(miR-215-5p、miR-411-3p、miR-493-5p、miR-494-3p、miR-495-3p、miR-548j-5p 和miR-93-3p)与免疫检查点抑制剂纳武单抗治疗后的总生存率密切相关。更重要的是,最近的一项研究已经证实miR-146a 是黑色素瘤中一种可比较的免疫检查点分子,联合抑制PD-L1 和miR-146a 可能是一种增强抗PD1/PDL1 治疗的抗肿瘤效果,这表明miRNAs 可能是一种新的免疫检查点治疗的组合靶点[38]。
4.2 LncRNAs 对PD-L1 的调节LncRNAs 是 高度保守的非编码RNA 的一个主要子集,可以在不同水平上控制癌症的病理生理过程,包括转录、转录后和翻译。最新研究发现,lncRNAs 可以与miRNAs 相互作用,通过抑制靶mRNA 转运或促进mRNA 降解来调节生理和病理过程,从而促进PD-L1 表 达。lncRNAs 以多种方式调节PD-L1 的表达(表1)。在非小细胞肺癌中,lncRNA 转移相关的肺腺癌转录本1(MALAT1)通过调节PD-L1 的下游目标miR-200a-3p 间接调控PD-L1 的表达[21]。在卵巢癌中,lncRNA HOTTIP 可以通过促进IL-6的分泌上调PD-L1 的表达,进而加速肿瘤的免疫逃逸[39]。此外,lncRNA 还可以作为竞争性内源RNA(ceRNA)调控PD-L1 的表达。乳酸脱氢酶a(LDHA)可以作为ceRNA 促进PD-L1 的表达而导致三阴性乳腺癌的不良预后。lncRNAs 抑制剂与miRNAs 在抑制PD-L1 表达方面是否有协同作用仍需进一步研究。
5 PD-L1 表达的转录后调控
已知多种肿瘤信号通路参与PD-L1 转录后的调节。其中最主要的两个信号通路是JAK/STAT/PI3K/AKT/MEK/ERK 和SHP2/RAS/RAF/MEK/ERK 途径。JAK/STAT 信号通路是调节PD-L1 表达的途径之一。成纤维细胞生长因子受体2(FGFR2)在大肠癌中高表达,最新研究表明,FGFR2通过JAK/STAT3 信号通路诱导人大肠癌细胞PDL1 表达,并促进大肠癌异种移植小鼠PD-L1 的表达[40]。信号通路JAK1/JAK2 功能缺失突变导致肿瘤细胞中PD-L1 表达缺失,从而导致对PD-1 阻断治疗的原发性和获得性耐药。此外,在检查点阻断后复发的患者中可以检测到IFNGR/JAK/STAT通路的失活突变[41]。这可能揭示了对免疫检查点耐药或治疗后复发的内在抵抗机制。IFN-γ主要通过JAK/STAT1/干扰素调节因子1(IRF-1)途径在多种癌症中发挥作用[42],IFN-γ信号通路是肿瘤免疫微环境中诱导PD-L1 表达的另一重要途径。内源性IFN-γ 在头颈部鳞癌中可以通过IFNAR1/STAT1 通路促进肿瘤细胞中PD-L1 的表达,从而促进肿瘤的免疫逃逸[43]。miR-150 和miR-223 靶向STAT1 3′UTR 减少STAT1 的表达,同时减少干扰素依赖和非干扰素依赖STAT1 介导的信号转导;IRF1 蛋白和IRF1mRNA 的表达在mir-383 转染的睪丸胚胎性癌细胞中均明显降低。
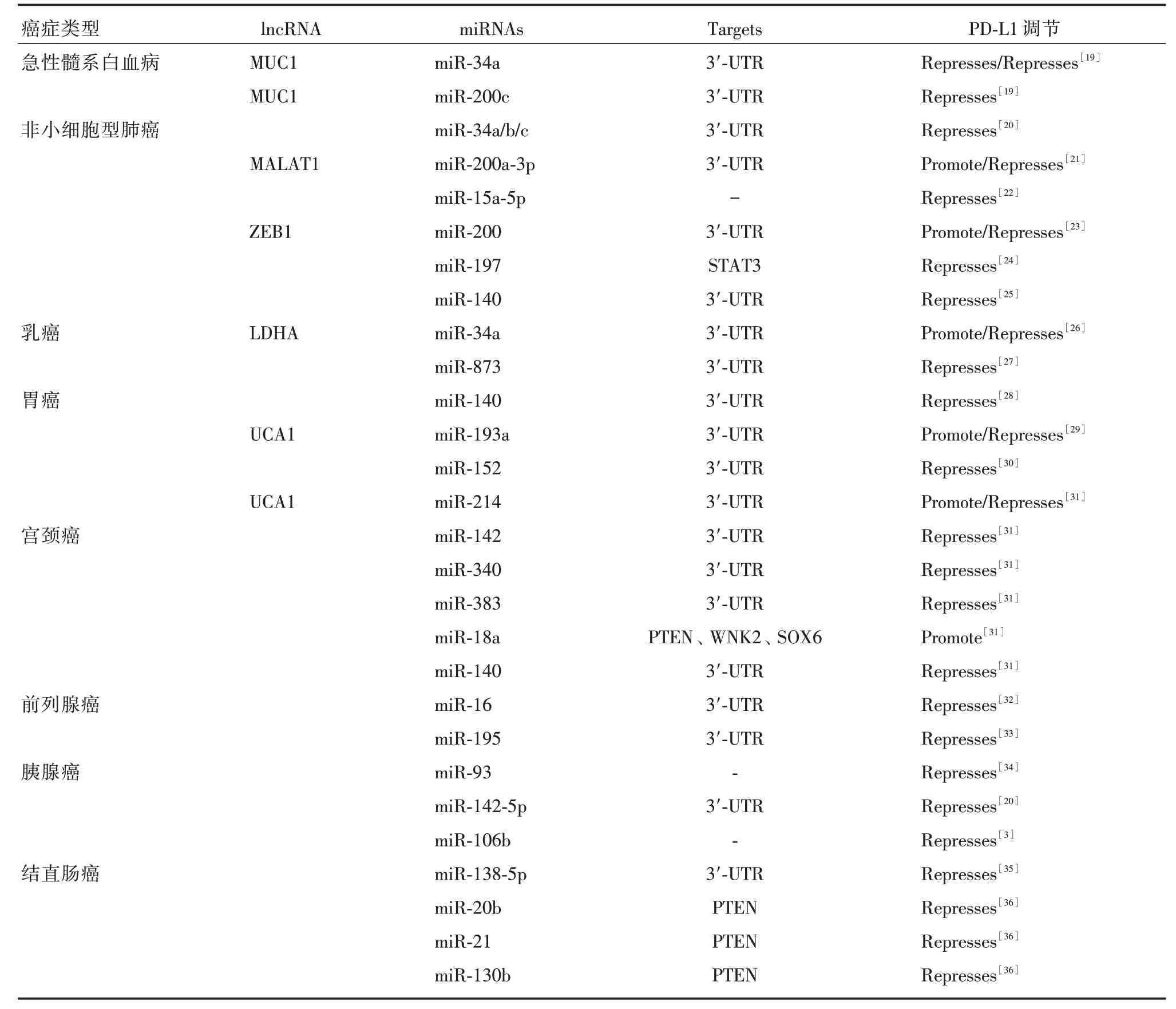
表1 非编码RNA 对PD-L1表达的调控Tab.1 Regulation of PD-L1 expression by non-coding RNA
PD-L1 转录还受到PTEN/PI3K/AKT/mTOR 通路上PTEN 和mTOR 调节。研究 发 现,PTEN 的缺失或者mTOR 的激活可以促进PD-L1 的表达。在胶质瘤、乳腺癌和前列腺癌中,PTEN 丢失或PIK3CA 突变可以激活AKT-mTOR 通路,并随后增加PD-L1 的表达[44]。在非小细胞肺癌中发现肿瘤和IFN-γ诱导的PD-L1 的表达都依赖mTOR,他们证实了AKT-mTOR 通路的致癌激活通过驱动PD-L1 的表达促进免疫逃避,并且证明mTOR 抑制剂联合PD-L1 抗体可以阻止这一过程[45]。因此,mTOR 抑制剂与免疫检查点抑制剂联合可能是肿瘤免疫治疗的新方向。然而,在肺鳞癌小鼠模型中显示肿瘤细胞中高PD-L1 的表达还促进细胞PTEN 表达的缺失[46]。由此得知,PTEN 与PD-L1可能一个相互作用的过程。
6 小结与展望
近年来,越来越多研究证明PD-L1 在肿瘤细胞中表达的调控机制,基于PD-L1 表达调控的分子机制,一些潜在的治疗方法已经出现。例如,MEK/ERK 激酶对IFN-γ诱导PD-L1 的表达起着关键作用。U0126(mek1/2 的抑制剂)通过抑制MEK/ERK通路阻断IFN-γ诱导的PD-L1在多发性骨髓瘤浆细胞和肝星状细胞中的表达。ZHOU 等[47]研究表明,Pevonedistat(MLN4924)是一种特异的NEDD8 激活酶抑制剂,可提高PD-L1 mRNA 水平并阻止PD-L1 蛋白质的降解,并证明联合MLN4924 和抗PD-1/PD-L1 抑制剂作为一种潜在的治疗策略来治疗胶质母细胞瘤。
虽然PD-1/PD-L1 信号通路介导的免疫逃逸是抗肿瘤研究和癌症转化医学领域的热门话题。但是靶向PD-1/PD-L1 免疫治疗尚未达到预期目标,因此,在未来研究中仍有许多待解决的问题。PD-L1在不同类型的癌细胞中的表达调控机制已经被发现,在染色质修饰、转录、转录后等多个水平上发挥作用,但是哪种水平占优势仍需进一步探索。并且这些调控因子是否可以与免疫抑制剂协调发挥抗肿瘤作用仍待解决。
因此,针对PD-1/PD-L1 抗体治疗是有效的,但仍会出现耐药或复发,PD-L1 高表达为预后不良的主要标志物,因此,深入研究PD-L1 表达调控机制为完善肿瘤免疫治疗提供新方向。
