基于GEO数据库对结肠癌BMI1基因筛选及其对人结肠癌细胞增殖及侵袭迁移机制研究
2020-06-09卢敏郑相涛毛华沙卫红
卢敏 郑相涛 毛华 沙卫红
1南方医科大学珠江医院消化内科(广州510282);2南方医科大学第二临床医学院(广州510282);3广东省人民医院消化内科,广东省医学科学院(广州510080)
据2018年全球癌症统计数据,结肠癌是导致癌症死亡的第四大原因[1]。结直肠癌的复发和转移是预后不良和导致高病死率的重要因素。BMI1基因在结直肠癌中高度表达[2],且BMI1 参与癌细胞增殖、侵袭、远处转移。然而,通过生物信息学分析对结肠癌差异表达的BMI1 基因研究较少,且其参与结肠癌增殖和转移的机制尚不清楚。本研究基于GEO 数据库获取结肠癌基因芯片数据,对结肠癌生存预后进行生物信息学分析,寻找结肠癌治疗的靶基因BMI1,并通过RNA 干扰技术检测干扰靶基因后对人结肠癌细胞增殖、侵袭和转移力的影响及作用机制,为结肠癌的治疗新靶点提供理论依据。
1 材料与方法
1.1 主要试剂胎牛血清(FBS,Hyclone),培养基(DMEM,Gibco),脂质体Lipofectamine 2000(Invitrogen,美国),transwell 小室(costar,美国),matrigel胶(BD,美国)。 SYBR RT PCR Kit 为TaKaRa 生物科技有限公司产品,BMI1、P16ink4a、E-cadherin、Vimentin 一抗均为美国Abcam 公司Santa cruz 公司产品。
1.2 生物信息学分析在GEO数据库下载GSE50760序列号相关的结直肠癌信息;收集了结直肠癌原发癌组织、转移瘤组织以及正常组织各18 例。另外通过Oncomine 数据库收集结直肠癌相关的资料。(筛选条件:(1)cancer type:colorectal cancer;(2)gene:BMI1;(3)data type:mRNA 或DNA;(4)analysis type:cancer vs normal analysis)。利用R 软件及相关软件包对GSE50760 表达谱数据进行过滤及标准化,筛选差异基因。差异基因筛选标准:|logFC|≥2,校正后P<0.05。同时绘制差异表达基因热图及火山图,分析BMI1 表达与结直肠癌预后的关系,当P<0.05 为差异有统计学意义。
1.3 细胞培养LOVO 结肠癌细胞株由南方医科大学消化疾病研究所赠送。将细胞置于37 ℃、5% CO2培养箱,含10%胎牛血清的DMEM 培养基中培养。
1.4 细胞转染靶向敲除BMI1 mRNA(siBMI1)的三对siRNA 序列由苏州吉玛生物科技有限公司(中国上海)合成。将LOVO 细胞用胰蛋白酶消化并接种到24 孔板中,细胞密度为105个细胞/孔,每个孔添加不含抗生素的培养基500 μL,直到细胞在转染时达到70%~80%汇合。细胞转染时使用Lipofectamine 2000(Invitrogen,USA)进行转染,同时用荧光标记的FAM-siRNA 评估转染效率。
1.5 实时定量PCR转染后48 h,用Trizol 从细胞中提取RNA,然后进行逆转录和实时PCR(RT-qPCR)以检测BMI1 mRNA 表达情况并筛选出具有最大抑制效率的siBMI1。使用SYBR®PremixEx Taq TM(Takara)试剂盒进行qPCR 检测。本研究中使用的BMI1 基因的引物序列如下所示:有义链5′GCCAACAGCCCAGCAGGAGG3′,反义链:5′TTGGTGGTTACCGCTGGGGC3′。扩增的长度为203 bp。PCR 循环为95 ℃30 s,39 个循环,95 ℃5 s 和60 ℃30 s。所有样本重复3 次;将β-catenin 作为内参,使用2-ΔΔCt方法计算表达水平。选取最有效的siRNA 序列用于以下实验。
1.6 CCK-8 检测细胞增殖能力将LOVO 细胞悬液分别接种在96 孔板中培养约24 h 后进行细胞转染,分别以特异性BMI1 的siRNA 序列(siBMI1组)和非特异性siRNA 序列(NC 组)进行转染,然后培养48 h 后。每孔加入10μL CCK-8 溶液,然后在37 ℃温箱中继续培养2 h。最后用分光光度计在450 nm 处读取吸光度(OD值)。
1.7 Transwell 小室检测细胞迁移能力使用transwell 小室迁移实验检测LOVO 细胞的侵袭性,将含有5 μL Matrigel 基底膜基质的transwell 小室置于24孔培养板中。将细胞分为2组:siBMI1组和阴性对照(NC)组。转染后在24 h 和48 h 收集细胞,并以5 × 105个细胞/mL 的密度接种到transwell室中下室中加入完全培养基。24 h 和48 h 后取出transwell 小室,将细胞染色并在显微镜下计数。将细胞染成蓝色,而聚碳酸酯膜孔显示为黑点。实验重复3 次。
1.8 流式细胞学检测细胞周期变化结肠癌细胞也分为2 组:siBMI1 组和阴性对照(NC)组,转染后在24 h 和48 h 收集细胞。然后用PBS 洗涤细胞两次,用70%乙醇在冰上固定20 min,随后用PBS洗涤3 次。然后,将细胞悬浮于含有0.2 mL RNase和0.5 mL PI 染色液的200 μL PBS 中,并在37 ℃下染色15 min,接着在流式细胞仪(FACSVerse;BD Biosciences,USA)上分析细胞。
1.9 Western Blot检测从转染siBMI1和scramble siRNA 转染的LOVO 细胞中提取蛋白进一步检测相关分子表达变化。细胞离心后收集沉淀并在冷的细胞裂解缓冲液中裂解。在4 ℃下离心10 min后,通过12%SDS-PAGE 分离上清液并转移到硝酸纤维素膜上。将膜与封闭溶液(5%脱脂乳;Sigma-Aldrich Corporation,St.Louis,MO)在室温下培养1 h,然后与下列一抗在4 ℃培养一夜:兔抗人BMI1 抗体(Abcam 公司,美国),兔抗人P16ink4a 抗体,兔抗人E-钙粘蛋白抗体,兔抗人Vimentin 抗体(Santa cruz,美国)。接下来,用含有Tween-20(1 mL/L)的1X tris 缓冲盐水洗涤膜,并与二抗一起温育。 使用ECL 系统检测膜上的抗体-抗原复合物,并用Image Pro Plus 软件定量蛋白质条带的相对强度。
1.10 统计学方法统计学分析采用SPSS 22.0 统计软件(IBM,美国)和Graphpad prism 6.0 进行数据分析,计量资料以均数±标准差表示。CCK-8细胞增值实验,Transwell 细胞迁移实验均采用两独立样本t检验统计。以P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌差异基因筛选使用GEO 数据库对GSE50760 表达谱数据进行分析,根据筛选标准筛选出差异基因,绘制结直肠癌组织样本与正常组织样本差异表达基因热图(图1)以及火山图(图2)。通过Oncomine 数据库分析,BMI1 在结直肠癌中的表达量高于正常组织(P<0.05,图3)。
2.2 BMI1在结直肠癌和正常组织之间的表达差异及其与预后的分析通过分析数据集GSE50760 中18 例结直肠癌患者原发癌、转移癌及癌旁组织的BMI1 基因表达的丰度值,发现BMI1 在同一患者原发结直肠癌组织中的转录水平显著高于其癌旁组织,而在同一患者转移癌组织的转录水平显著高于原发癌组织(P<0.01,图4)。通过生存分析发现,BMI1 的表达水平与结直肠癌患者生存预后之间存在相关性,高表达BMI1的患者总体病死率较高,低表达BMI1 的患者预后较好(P<0.05,图5)。
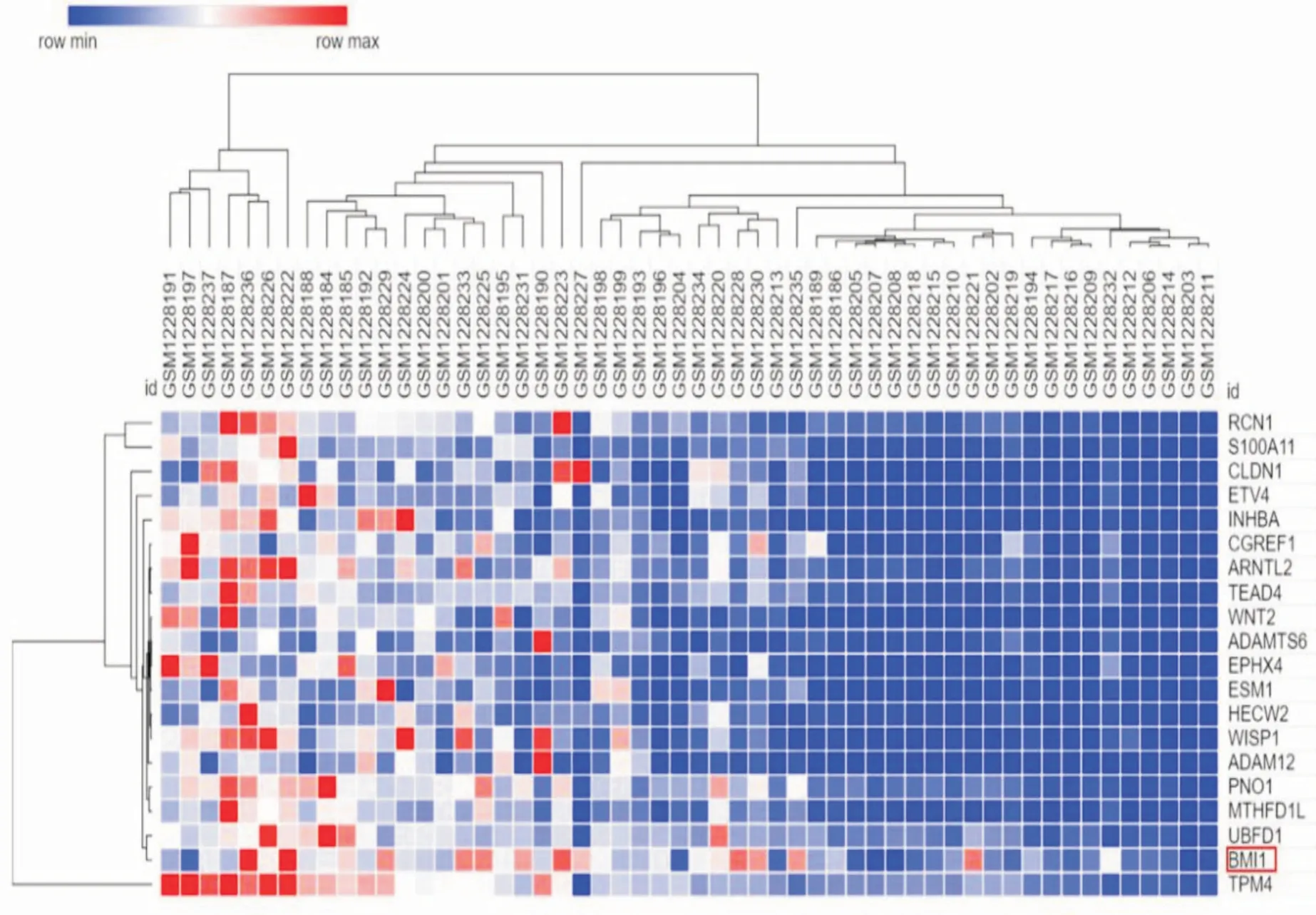
图1 结直肠癌组织样本与正常组织样本差异表达基因热图Fig.1 Thermogram of differentially expressed genes between colorectal cancer and normal tissue samples
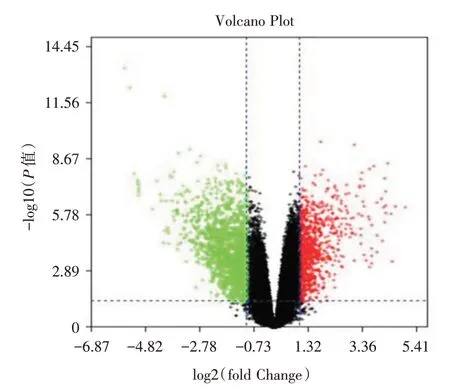
图2 结直肠癌组织样本与正常组织样本差异表达基因的火山图Fig.2 Volcanic map of differentially expressed genes between colorectal cancer and normal tissue samples

图3 Oncomine 数据库中关于BMI1 在结直肠癌总的表达Fig.3 The expression of BMI1 in colorectal cancer in Oncomine database

图4 BMI1 蛋白在结直肠癌原发癌组织、转移瘤组织及正常组织中的表达Fig.4 The expression of BMI1 protein in primary cancer,metastasis of colorectal cancer and normal tissues
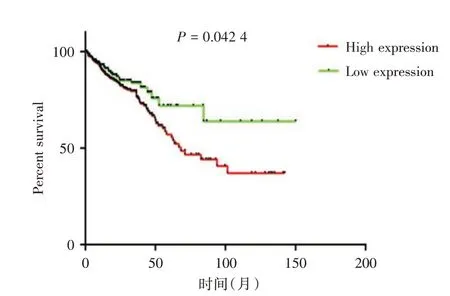
图5 数据集GSE50760 中BMI1 表达与结直肠癌预后之间的生存曲线Fig.5 The survival curve between BMI1 expression and colorectal cancer prognosis in GSE50760
2.3 选择最大抑制效率的siBMI1 序列首先通过RT-PCR 评估了3 种siBMI1 的效能,发现第一种siBMI1 在LOVO 细胞中具有最强的抑制效率(约80%)。该siBMI1 的上游引物序列为5′GGAUCGGAAAGUAAACAAATT3′,下游引物序列为5′UUUGUUUUUUUCCGAUCCTT3′,见图6。

图6 BMI1 基因干扰抑制结肠癌细胞mRNA 的表达Fig.6 BMI1 gene interference suppresses mRNA expression by siRNA in colorectal cancer cells
2.4 BMI1 敲除抑制结肠癌细胞增殖通过CCK8测定细胞生长时间,BMI1 基因干扰后发现siBMI1显著抑制了结肠癌细胞增殖(图7)。

图7 BMI1 敲除抑制结肠癌细胞的增殖Fig.7 BMI1 knockout inhibits proliferation of colorectal cancer cells
2.5 BMI1 敲除抑制人结肠癌细胞侵袭和迁移Transwell 小室迁移试验确定BMI1 敲除对结肠癌细胞侵袭力的影响。与NC 组相比,siBMI1 组的迁移明显较弱(307±12.12vs.181.33±8.14,P<0.05,图8)。表明BMI1 敲除可以抑制结肠直肠癌LOVO细胞的侵袭。

图8 BMI1 敲除抑制结肠癌细胞的侵袭和迁移Fig.8 BMI1 knockout inhibits invasion and migration of colorectal cancer cells
2.6 BMI1 敲除抑制结肠癌细胞周期进展进一步通过流式细胞技术检测BMI1 敲除对结肠癌细胞的细胞周期进程的影响。BMI1 敲除后,促使结肠癌细胞细胞周期中G1 期的停滞和S 期的缩短,因此BMI1 敲除可通过抑制癌细胞细胞周期来抑制癌细胞增殖(图9)。
2.7 BMI1 敲除上调P16ink4a 表达并抑制EMT表达siBMI1 组中的BMI1 蛋白表达在转染后48 h显着低于NC组(P<0.05)(图10A、B)。降低的BMI1水平与siBMI1 组中P16ink4a 表达水平的增加相一致(P<0.05)(图10A、C)。进一步检测EMT 相关的E-cadherin 和Vimentin 的表达。如Western 印迹所示(图10A、D、E),在SiBMI1 转染后,E-钙粘蛋白表达增加,但波形蛋白表达降低。这些研究表明,BMI1 的敲除可能通过抑制EMT,上调E-钙粘蛋白的表达和下调波形蛋白的表达,从而抑制LOVO 细胞的侵袭。
3 讨论
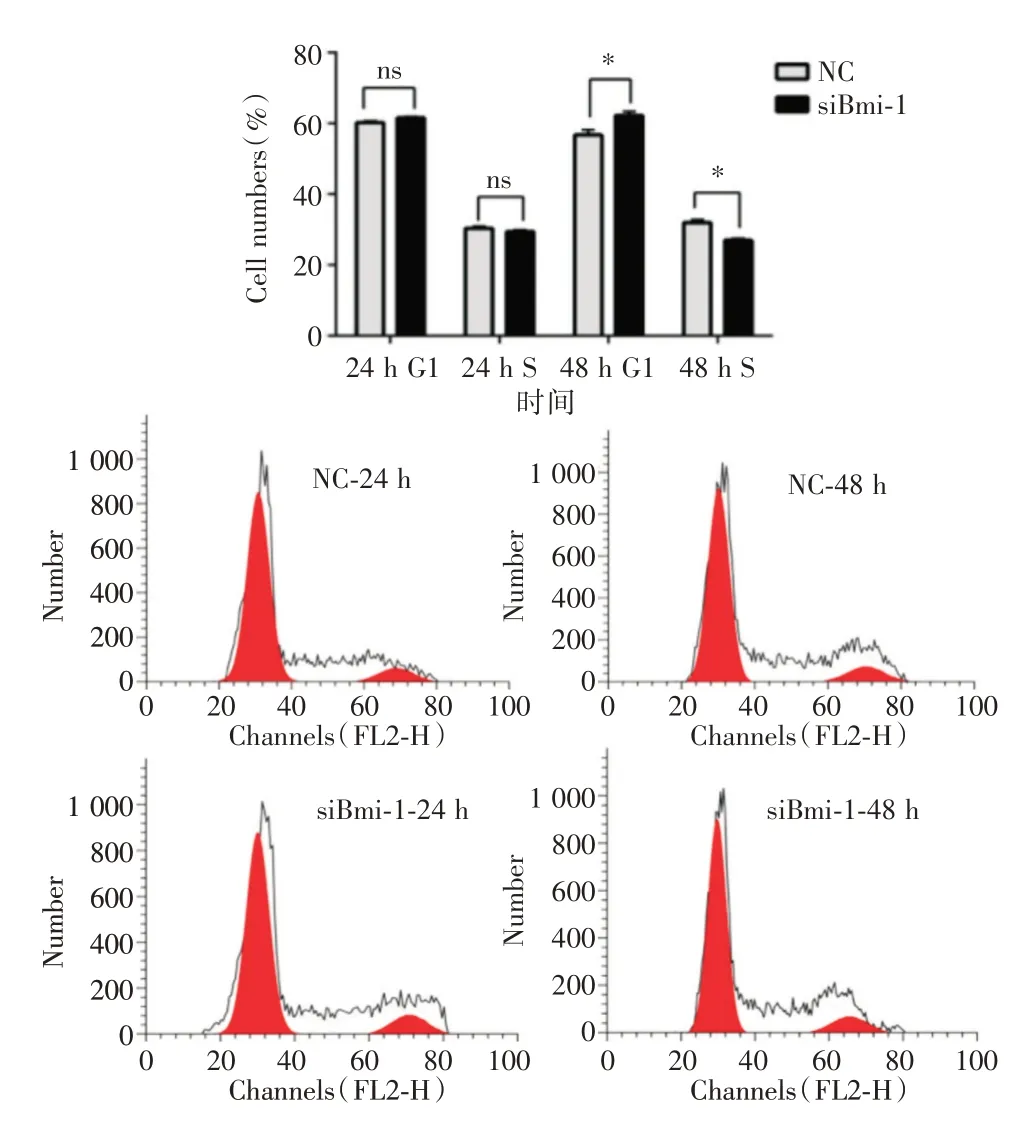
图9 BMI1 敲除抑制结肠癌细胞周期进展Fig.9 BMI1 knockout inhibits the progression of colorectal cancer cells cycle
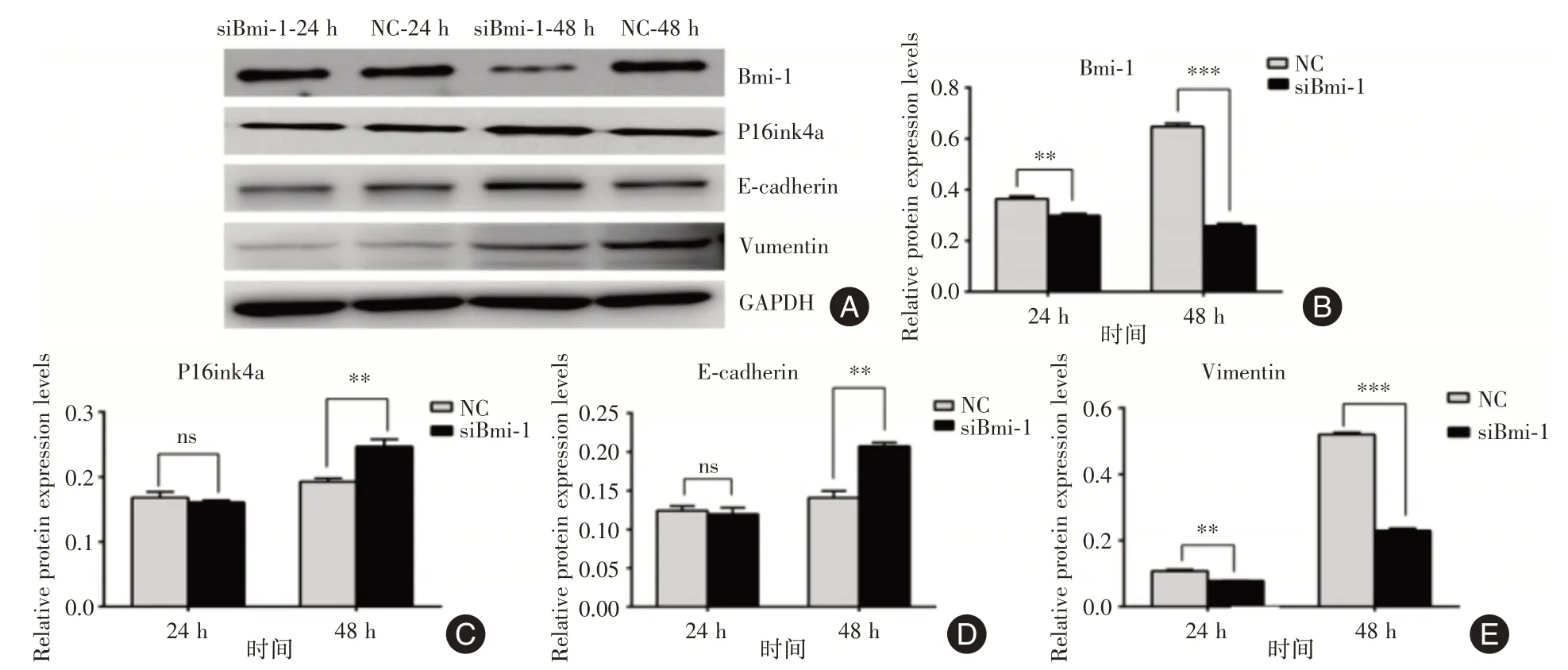
图10 BMI1 基因敲除对结肠癌细胞中P16INK4a 及EMT 表达的调节Fig.10 Regulation of P16INK4a and EMT expression by BMI1 gene knockout in colorectal cancer cells
结肠直肠癌是消化道的常见恶性肿瘤。国际癌症研究机构2018年的最新报告显示,结直肠癌的病死率在全球排名第4 仅次于肺癌、乳腺癌和前列腺癌[3]。结肠癌的侵袭和转移是影响预后最重要的因素。因此,需积极寻找结肠癌治疗的新方法。
HAUPT 等[4]首先在小鼠淋巴瘤中鉴定出BMI1基因,并证明BMI1 是一种关键的多梳蛋白,参与调节造血干细胞的增殖。同时发现BMI1 和c-myc基因共同引起细胞转化和肿瘤发生[5]。BMI1 在许多恶性肿瘤中均有过表达,包括前列腺癌,乳腺癌,卵巢癌和结肠癌[6-9]。在结直肠癌组织中,BMI1的表达水平显着增加;并且与远处转移和TNM分期密切相关[9]。所有研究表明BMI1 是致癌基因,其沉默会抑制肿瘤细胞的增殖和迁移。在本研究中,从GEO 数据库下载结肠癌芯片数据GSE50760,分为癌组织和正常组织,利用GEO2R在线对其处理分析,结果发现,BMI1 在结肠癌组织中呈高表达,且BMI1 的表达水平与结直肠癌患者生存预后之间存在相关性。siRNA 可沉默转录后基因的表达水平,转染48 h 后可抑制靶基因的表达。有研究[10]表明,利用小干扰RNA(siRNA)技术干扰酰基辅酶A 一胆固醇酰基转移酶1(ACATl)基因在人结肠癌HT29 细胞中的表达,可抑制人结肠癌HT29 细胞增殖和侵袭迁移能力。在本研究中,用RNA 干扰技术将siBMI1 转染至人结肠癌细胞,可有效抑制BMI1 的表达,从而进一步抑制癌细胞增殖迁移。
上皮-间质转化(EMT)可促进结肠癌等恶性肿瘤的侵袭和转移,有研究表明,BMI1 通过E-cadherin 的下调促进了结肠CSCs 的侵袭和迁移,这可能是由于EMT 增加所致[11]。然而,结肠癌细胞中BMI1 和EMT 之间确切机制尚不清楚。据报道,在子宫内膜癌细胞中,可以通过miRNA 靶向敲除PTEN 和其他EMT 相关基因(例如Twist1,ZEB1 和BMI1)来激活或减弱EMT和CSC[12]。此外,P16ink4a通过miR-141/miR146b-5p 抑制EMT。但结肠癌细胞中BMI1 是否通过P16ink4a 促进EMT 尚不清楚。
编码自INK4a 基因的P16ink4a 可以灭活CDK,且与细胞周期调控密切相关[12],P16ink4a 抑制视网膜母细胞瘤蛋白并使肿瘤细胞停止在G1/S期[14]。一些关于肿瘤进展的研究表明,P16ink4a是BMI1 的下游基因,其表达被BMI1 抑制[15]。本研究发现BMI1 敲除不仅增加了P16ink4a 的表达,也使细胞停滞在G1期,从而阻碍了结直肠癌LOVO细胞的细胞周期进程,并抑制细胞增殖,这与之前研究结论一致。
肿瘤侵袭和转移是涉及各种因素和多种信号传导途径的复杂过程。EMT 是结肠肿瘤侵袭和转移的一种常见过程[16]。在这个过程中,上皮细胞失去其上皮特征,并在特定的生理和病理条件下转分化为间充质细胞。已有的研究表明EMT 促进肿瘤细胞的转移,且在EMT 过程中观察到E-钙粘蛋白水平降低,而波形蛋白和纤维连接蛋白等间质标志物增加[17]。由此推测,其促进肿瘤转移的机制可能是:E-钙粘蛋白的减少导致细胞间粘附减少,促进肿瘤细胞的侵袭和转移[18-19]。在进一步的研究验证中发现,BMI1 敲除增加了E-钙粘蛋白的表达并减少了波形蛋白的表达,最后抑制EMT。结果表明BMI1 与E-钙粘蛋白呈负相关,而与波形蛋白呈正相关,BMI1 基因敲除通过上调E-钙粘蛋白抑制LOVO 细胞的侵袭和转移。目前,BMI1 通过EMT 促进肿瘤迁移和转移的机制尚不清楚。据报道,BMI1 介导Hes1 诱导的细胞增殖和迁移,下调PTEN 并激活Akt/GSK3β途径,从而诱导EMT 和细胞骨架重建并导致癌细胞的侵袭性增强[20]。相应地,BMI1 敲除通过PTEN/p-Akt/p-NFκB/MMP-2 途径逆转EMT 改变,显著抑制黑色素瘤的侵袭行为[21]。笔者推测BMI1/PTEN/Akt/信号传导与结肠癌进展中的EMT 活化相关。此外,还有研究证明BMI1 在乳腺癌进展期间调节P16ink4a和细胞周期蛋白D1 的表达[22]。更重要的是,已证明P16ink4a 通过miR-141/miR146b-5p 及其靶标AUF1 抑制EMT 相关转录因子来控制衰老[23]。本研究结果发现,P16ink4a 与E-钙粘蛋白呈正相关,与波形蛋白呈负相关。因此,笔者推测沉默BMI1可能通过上调P16ink4a 的表达来抑制EMT。
综上,本研究发现,BMI1 基因与结肠癌的增殖,侵袭和迁移密切相关,RNA 干扰可下调BMI1表达,抑制结肠癌的侵袭和转移,其机制可能通过上调P16ink4a 的表达而抑制EMT 相关。但BMI1有无通过其他信号通路促进结肠癌侵袭和迁移,其具体的机制仍有待进一步研究。
