肠道菌群调控2型糖尿病发生发展的研究进展
2020-06-09郭丽璇胡琼英熊大迁
郭丽璇 胡琼英 熊大迁
1成都中医药大学医学技术学院(成都610075);2成都中医药大学附属医院检验科(成都610072)
2型糖尿病(type 2 diabetes mellitus,T2DM)主要由外周组织胰岛素抵抗或胰岛β细胞胰岛素分泌功能缺陷导致,以慢性高血糖为特征的慢性代谢性疾病,与肠道菌群密切相关[1]。肠道菌群是人体肠道微生态的重要组成部分,其结构组成、能量代谢等均可影响T2DM的发生发展及预后[2]。已有文献表明T2DM患者的肠道细菌组成与T2DM的低度炎症[3]、空腹血糖浓度及胰岛素抵抗状态[4]密切相关。T2DM患者的肠道菌群含有大量革兰阴性菌,产生内毒素并被机体吸收,形成“代谢性内毒素血症”[5]。本文拟对肠道菌群的组成和代谢与T2DM的相关研究进行综述。
1 肠道菌群与机体的关系
1.1 正常人体肠道菌群与机体平衡肠道菌群是寄居在人体肠道中的微生物群,目前研究显示,其种类超过1 000种,数量达1014,且绝大多数为厌氧菌,和人体细胞之间的比例约为1.3∶1[6]。目前人类粪便微生物组已鉴定约990 万个微生物基因,是一个庞大的结构和功能系统[7]。肠道内的微生物主要包括拟杆菌门、厚壁菌门、变形菌门和放线菌门,其他菌门还包括螺旋菌门、蓝菌门、疣微菌门等,其中厚壁菌和拟杆菌的比例高达90%[8]。不同的肠道细菌与宿主的营养吸收和代谢息息相关,如厚壁菌主要与食物中热量摄取有关,而拟杆菌与短链脂肪酸(short chain fatty acid,SCFA)的形成相关,这些细菌的相关功能互相依存制约,形成生态平衡[9-10]。肠道菌群不仅在组成和功能上具有一定的稳定性,当平衡被干扰时还可以进行“微生物恢复”[11],如处于稳态的肠道菌群对食品添加剂、外界的感染、抗生素治疗或者剧烈饮食等干扰产生相对“抵抗力”以维持机体的内稳态[12]。另一方面,肠道菌群抵抗力与微生物群的多样性密切相关(也是个体水平差异的来源),当肠道微生态的抵抗力降低时可干扰肠道菌群的多样性,可使其结构产生持久性变化,原始的生物群落无法“复原”,造成肠道菌群的生态失调,促使其达到一种新的具有更强恢复力的“病态平衡”,使T2DM 等慢性病的易感性增加[13]。由此可见,无论在生理还是病理情况下,人体和肠道菌在肠道内均形成了一种相互平衡的微生态系统。
1.2 肠道菌群代谢物与机体的关系肠道共生菌能完成人体自身不能进行的代谢活动。肠道菌群可发酵膳食纤维等难消化的碳水化合物,产生重要的代谢物,如SCFA和琥珀酸等。SCFA 用于平衡肠道中的氧化还原状态,通过结合G 蛋白耦联受体41(G-protein coupled receptor 41,GPR41)和GPR43 抑制组蛋白脱乙酰酶活性来发挥作用[14]。SCFA 主要包括乙酸、丙酸和丁酸,在肠道中的含量摩尔比分别为60∶20∶20,已证实SCFA 对体质量、葡萄糖稳态和胰岛素敏感性存在积极的调节作用[15-16]。
氨基酸代谢是与胰岛素敏感性相关的最为主要的代谢途径,包括支链氨基酸(branched-chain amino acid,BCAA)、芳香族氨基酸等代谢[17]。宿主的芳香族氨基酸和BCAA 供应主要由肠道微生物群完成。缬氨酸、亮氨酸、异亮氨酸等支链氨基酸可被细菌进一步分解形成支链脂肪酸;苯丙氨酸、色氨酸、酪氨酸等芳香族氨基酸则进一步被分解为酚类和吲哚类物质,有利于合成人体中多种维生素如维生素K和部分B族维生素等。如维生素K2 通过维生素K 依赖性蛋白骨钙素、抗炎特性及降脂作用等提高胰岛素敏感性,改善T2DM[18];维生素B 可通过miR21的甲基化影响T2DM 代谢相关基因[19]。
2 肠道菌群与T2DM的关系
2.1 肠道菌群相对丰度与T2DM的关系T2DM 患者肠道菌群的特征是中度微生物菌群失调,大量文献显示梭菌纲(Clostridiales)等产丁酸盐的细菌丰度下降,拟杆菌(Bacteroidetes)、部分芽孢杆菌(Bacilli)和部分变形杆菌(Proteobacteria)为机会致病菌,在T2DM患者中的丰度增加,且微生物的氧化应激抗性功能增强[20-22,24,33,53,55-58,61-62,70]。T2DM 小鼠肠道中拟杆菌门和疣微菌门的丰度均减少,但厚壁菌、变形杆菌和还原硫酸盐的脱硫杆菌门较正常对照均升高[23,49-52,54,59,60,63-65]。研究发现,在纲水平上,T2DM 小鼠和人类T2DM患者的肠道菌群与正常对照菌群丰度变化明显;其中,两者拟杆菌纲、梭菌纲和β变形杆菌纲的丰度改变趋势有明显差异[20,23,24,49-58,60-63,65]。
SHARMA 等[22]发现T2DM 肥胖小鼠乳酸杆菌(Lactobacillus)丰度更高,其中苏黎世菌(Turicibacter)属和梭菌(Clostridiaceae)属SMB53仅T2DM小鼠中观察到。SEDIGHI 等[24]对T2DM 人群和正常人群的粪便样品中微生物组进行分析,证实了T2DM患者的肠道菌群中具有高丰度的乳酸杆菌(Lactobacillus),而健康人群肠道菌群中双歧杆菌(Bifidobacterium)相对丰度更高。SHIN 等[25]发现T2DM 小鼠肠道中艾克曼菌(Akkermansia muciniphila)增加有利于T2DM 相关代谢改变以及症状改善。这与之前研究发现正常人群中艾克曼菌具有较高丰度的研究结果一致[26]。另有研究[22]发现,相同基因型和相似饮食模式的小鼠因为肠道菌群的差异出现不同的葡萄糖代谢情况,说明肠道菌群对T2DM 相关代谢的影响至关重要[22]。
2.2 肠道菌群代谢物与T2DM的关系(表1)
2.2.1 SCFASCFA 一般是由1~6个碳原子组成的有机酸,通过肠道微生物分解发酵碳水化合物产生,包括甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸[27]。乙酸盐、丙酸盐和丁酸盐以腺苷一磷酸激活的蛋白激酶(Adenosine 5′-monophosphateactivated protein kinase,AMPK)依赖性方式下调过氧化物酶受体增殖激活受体-γ调节肝脏脂质并维持葡萄糖稳态,但SCFA 激活AMPK的机制尚不清楚[28]。此外,有研究证实通过肝脏增加丙酸盐通量可减少肝内甘油三酯,维持肝脏和葡萄糖稳态[29]。乙酸与脂肪细胞脂肪分解相关,可使肝脏中脂肪生成基因的转录物减少,腹肌中肌红蛋白和葡萄糖转运蛋白(glucose transporter type 4,Glut4)基因的转录物增加,故乙酸可以通过影响肝脏和肌肉中的脂质代谢对抗肥胖相关T2DM[30]。游离脂肪酸受体2(free fat acid receptor 2,FFAR2)和FFAR3两个SCFA 受体是GPRs的亚类,在胰腺β细胞中共表达形成受体异聚体,异聚体可以通过CATPB和YM25489 敏感机制诱导p38 磷酸化[31],激活细胞MKK3/P38/PRAK 途径改善饮食引起的胰岛素抵抗和T2DM 代谢异常,对临床治疗T2DM 有重要意义[33,67]。
2.2.2 BCAABCAA是指α碳上含有分支侧链的氨基酸,属于必需氨基酸,不仅是合成含氮化合物的底物,还通过调节PI3K-AKT-mTOR 信号通路影响葡萄糖、脂质和蛋白质合成及肠道免疫[38-39]。WANG 等[40]发现糖尿病与支链氨基酸浓度的相关性。FLORESGUERRERO 等[41]又对6 244例受试者进行了7.5年的巢式病例对照研究(nested case control study,NCCS),发现支链氨基酸可以预测T2DM的发展,其机制主要与胰岛素抵抗相关,且不受其他因素的影响。研究显示,增加BCAA 摄入量对T2DM 葡萄糖稳态具有积极作用[68]。
2.2.3 芳香族烃类芳香族烃类包括吲哚、吲哚乙酸和吲哚丙酸,是肠道微生物分解色氨酸产生的代谢产物,也是芳香族烃类受体配体,对代谢类疾病有改善作用[34]。吲哚既可以促进GLP-1的分泌,也能抑制其分泌,对糖尿病的作用复杂[35]。吲哚丙酸(indoleproprionic acid,IPA)由微生物群分解膳食色氨酸产生的脱氨代谢产物,在宿主血清中积累并表现出高度的个体差异。IPA在宿主体内作为孕烷X受体(pregnane X receptor,PXR)的配体与微生物组α多样性正相关,与T2DM的发生呈负相关[36]。IPA与PXR 结合可调节肠道屏障功能,研究表明,PXR 缺陷型(Nr1i2-/-)小鼠因无法与IPA 结合,肠道上皮细胞通透性明显增大,同时Toll 样受体(toll-like receptor,TLR)信号传导途径上调,但Nr1i2-/-Tlr4-/-小鼠中肠道上皮屏障功能缺陷得到纠正,故IPA 可与PXR 相互作用,通过下调TLR 信号传导来强化肠道屏障[37]。
2.2.4 胆汁酸胆汁酸是由肝脏中的胆固醇合成的内源性分子,通过肠道微生物群进一步代谢后激活肠道、肝脏和外周受体调节T2DM 相关代谢,是微生物产生的重要代谢产物[45]。人类主要胆汁酸是鹅去氧胆酸(chenodeoxycholic acid,CDCA)和胆酸(cholic acid,CA),而啮齿动物产生CA和鼠胆酸(muricholic acids,MCAs)[45]。肠道菌群不仅可以调节胆汁酸在肝脏合成的胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7α1)等关键酶活性,参与胆汁酸的合成代谢与微生物转化,也可以产生次级胆汁酸作为G-蛋白耦联胆汁酸受体(G protein-coupled receptor for bile acids,TGR5)配体,通过核受体法尼醇X受体(Farnesoid X receptor,FXR)和TGR5 两种途径调节胆汁酸的合成和代谢,进一步刺激胰腺GLP-1的释放,调控葡萄糖代谢[66]。
2.2.5 三甲胺氧化物三甲胺氧化物(trimethylamine N-oxide,TMAO)的循环浓度是糖尿病的危险因素之一[42]。一方面,TMAO 依赖性升高的N-亚硝基化合物被证实是包括糖尿病在内的胰岛素抵抗性疾病的驱动因素[43];另一方面,由于胆汁酸作为信号传导分子和细胞受体配体能激活FXR和GPR,通过FXR 抑制糖异生基因的表达,在葡萄糖的代谢中发挥重要作用,而TMAO 则可通过抑制胆汁酸介导的肝脏FXR 信号传导,影响肝脏葡萄糖的代谢[44]。

表1 T2DM 相关的肠道菌群代谢物及作用机制Tab.1 Metabolites of intestinal flora and mechanism related to T2DM
3 肠道菌群调控T2DM的作用机制(图1)
3.1 SCFASCFA 可通过抑制蛋白脱乙酰基酶(histone deacetylase,HDAC)和激活MKK3/p38/PRAK途径减轻高胰岛素血症和全身胰岛素抵抗[67]。SCFA 抑制HDAC 可促进MKK3和p38的磷酸化,增强PPAK的磷酸化,进一步激活MKK3/p38/PRAK 信号通路,同时SCFA 也可刺激MKK3/p38/PRAK 乙酰化,促进GLP-1 受体的保护作用,改善T2DM 代谢异常和T2DM 并发的心脏功能障碍[69]。
3.2 BCAABCAAs 主要激活磷脂酰肌醇3-激酶(PI3K)-AKT(也称为蛋白激酶B,PKB)途径诱导mTOR 调节葡萄糖和脂质的代谢[38]。BCAA的减少激活PI3K-AKT 通路,同时降低mTOR 活性,但是亮氨酸可通过传感器Sestrin2 正向调控TORC1防止血浆葡萄糖浓度增加,改善胰岛素抵抗,刺激骨骼肌吸收葡萄糖,还可以预防内脏肥胖和高胰岛素血症的发展[38]。
3.3 胆汁酸胆汁酸对人体糖类代谢有至关重要的作用。胆汁酸合成受到FXR 负反馈抑制的严格调节,FXR 通过肠道微生物影响胆汁酸合成代谢,调节葡萄糖稳态[45]。肝肠均为FXR 信号依赖性糖脂调控的中枢器官。在肝脏中,FXR抑制胆汁酸主要合成途径的Cyp7α1 基因的表达[47]。FXR 介导的胆汁酸改变依赖于肠道微生物群,胆汁酸也可通过促进胆汁酸代谢细菌和抑制胆汁敏感细菌来调节肠道微生物群落[66]。除了肝脏外,肠上皮细胞中的FXR被远端回肠中的胆汁酸激活,诱导成纤维细胞生长因子(fibroblast growth factor,FGF)表达后与肝脏中的FGFR4/b-klotho 异二聚体复合物结合,触发JNK和ERK信号级联反应,抑制Cyp7α1的表达和高血糖素样肽1(glucagon-like peptide,GLP-1)的合成[71]。胆汁酸对T2DM的作用与肠道菌群密切相关并依赖于FXR 信号,但其相关机制尚需进一步探索。
胆固醇通过Cyp7α1 催化生成次级胆汁酸,次级胆汁酸结合TGR5 后刺激肠L 细胞合成和释放GLP-1 改善T2DM[46]。FXR和TGR5 可以相互作用改善机体糖脂代谢,也可作为信号影响宿主不同的代谢过程,通过胆汁酸和肠道微生物群的相互作用改变代谢过程,对机体的葡萄糖稳态产生不同的效果[48]。
4 问题与展望
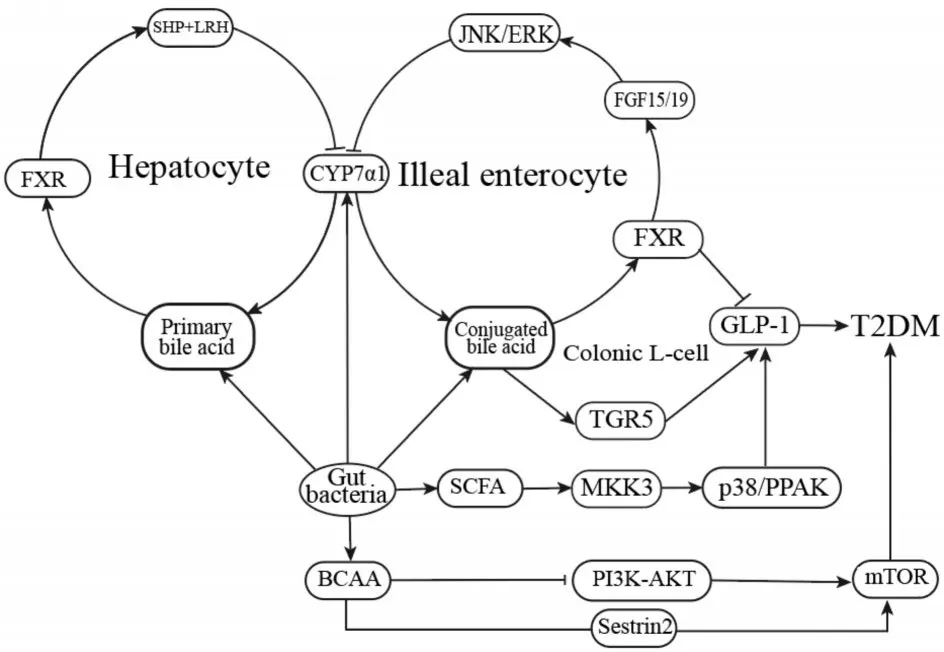
图1 肠道菌群与T2DM的作用机制Fig.1 Mechanism of intestinal flora and type 2 diabetes
T2DM患者肠道菌群种类和数量的改变造成肠道菌群失调和代谢物的变化,涉及肠道屏障完整性、肠道免疫、炎症、氧化应激、糖脂代谢和肠道微生态平衡等。肠道菌群代谢物对T2DM的糖类代谢和相关并发症有不同程度的调节作用,同时也可以影响肠道菌群,但代谢物影响T2DM的机制尚需进一步挖掘和验证。研究肠道菌群的结构及其代谢产物对T2DM的影响有助于对T2DM 进行早期干预,并对T2DM的微生态制剂的治疗以及菌群移植相关治疗提供进一步证据。但是,由于鉴定深度的不同和检测手段的不同,当前测定的菌群丰度和基因丰度在数量和表现方式上均有差异,且目前鉴定的细菌种类局限,肠道菌群与T2DM 之间的相关性需要更多大规模前瞻性实验进一步认识并深入探索其相关机制。
