茶树菇膳食纤维的提取工艺优化
2020-06-08刘学成王文亮黄泽天李永生贾凤娟
刘学成,王文亮,黄泽天,李永生,贾凤娟*
(1.山东省农业科学院农产品研究所,山东济南 250100;2.农业部新食品资源加工重点实验室,山东济南 250100;3.山东省农产品精深加工技术重点实验室,山东济南 250100;4.阳谷县农业农村局,山东聊城 252300)
膳食纤维(dietary fiber,DF)是一种多糖,被称为“第七大营养素”,主要存在于粗粮、蔬菜、水果以及菌菇中,它既不能被消化,也不能为人体提供能量,按照其是否溶于水可分为可溶性膳食纤维(soluble dietary fiber,SDF)和不可溶性膳食纤维(insoluble dietary fiber,IDF)[1],都具有独特的功能。可溶性膳食纤维包括存在于水果蔬菜中的果胶,海藻中的藻胶以及魔芋中葡甘聚糖,它能够改善肠道菌群结构,减少肠道对葡萄糖和脂类吸收,降低血液的血糖、血脂、胆固醇指标,减少心脑血管病、糖尿病和某些癌症的发病风险[2-4]。不溶性膳食纤维包括纤维素、木质素、半纤维素等,主要存在于谷物中,能够增加餐后饱腹感,吸收水分并促进胃肠蠕动,预防便秘并能起到减肥的功效[5]。根据医学研究显示,成人的膳食纤维摄入量应为每天25~35 g[6],然而现代人们的生活水平越来越高,食物越来越精细化,导致膳食纤维的摄入量远远不足,因此提高大众的健康意识,增加膳食纤维的摄入是十分必要的。
茶树菇(Agrocybe aegerita),学名为柱状田头菇,是一种食药两用的真菌,属担子菌纲伞菌目田头菇属,因生长在油茶树的枯干上,从而得名茶树菇。茶树菇主要分布在亚热带和温带地区,在我国主要产地为福建江西等地。茶树菇含有丰富的多糖和蛋白质,并且茶树菇菌丝体中还含有多种矿物质元素和维生素[7]。茶树菇具有糖高脂低、热量低和盐量少等特点,是少有的“一高三低”的保健食品。茶树菇有很好的保健功能,有清热、平肝、明目、利尿、健脾之功效,因而有“中华神菇”之称[8]。茶树菇中的膳食纤维含量丰富,以β-葡聚糖为主,同时存在于可溶性膳食纤维和不溶性膳食纤维中,具有很强的保健功能,因此提取茶树菇的膳食纤维具有非常重要的意义[9]。刘勇男等[10]以刺芹侧耳子实体为原料,采用碱法提取可溶性膳食纤维,在最佳提取条件下可溶性膳食纤维得率为4.05%;黄家莉等[11]以金针菇下脚料为原料,采用碱结合酶法,通过正交试验优化水不溶性膳食纤维的提取。结果表明,在最佳工艺条件下,金针菇水不溶性膳食纤维的得率达到64.88%。张明等[12]以银耳下脚料为原料,利用纤维素酶法提取银耳可溶性膳食纤维,在最佳工艺下可溶性膳食纤维得率为36.7%。碱法在膳食纤维提取中应用较多,但以碱法提取的膳食纤维活性会遭到破坏,并产生大量污水而对环境造成严重污染,酶法在提取中无污染,但提取得率较低。研究发现超声波辅助酶提取方法能提高膳食纤维的得率。超声波辅助酶法提取膳食纤维在红枣、生姜等原料中已经有相关研究[13-14],但在食用菌中却鲜有报道。
本研究以茶树菇为原料,利用超声波辅助酶法提取膳食纤维,并在单因素试验基础上,利用响应面优化提取膳食纤维条件,旨在提高膳食纤维的得率,为茶树菇的产品开发提供新的思路。
1 材料与方法
1.1 材料与试剂
茶树菇(Agrocybe aegerita):济南市华联超市;α-淀粉酶(酶活4 000 U/g)、复合蛋白酶(酶活12 000 U/g):上海源叶生物科技有限公司;体积分数95%乙醇:天津富宇精细化工有限公司;丙酮:烟台远东精细化工有限公司;氢氧化钠:国药集团化学试剂有限公司;盐酸:烟台莱阳精细化工厂。试验所用试剂均为分析纯。
1.2 仪器与设备
HH-S6恒温水浴锅:江苏金怡仪器科技有限公司;SHZ-A恒温水浴振荡器:上海博讯医疗生物仪器有限公司;SG2便携式pH计:梅特勒-托利多(上海)仪器有限公司;GZX-9240MBE电热鼓风干燥箱:上海博讯实业有限公司;SCIENTZ-10N冷冻干燥机、SB25-12DTD超声波清洗机:宁波新芝生物科技股份有限公司;SHB循环水式多用真空泵:郑州长城科工贸有限公司;ZN-20L小型粉碎机:北京兴时利和科技发展有限公司。
1.3 实验方法
1.3.1 原料预处理
将购买的茶树菇用清水洗净,平铺在鼓风干燥箱中60℃干燥48 h,粉碎过60目筛,将过筛后的茶树菇粉装入自封袋中,放置在干燥皿中室温保存。
1.3.2 茶树菇膳食纤维提取工艺流程
茶树菇→烘干粉碎→料液比1∶30(g∶mL)加水溶解→调节pH值为7→控温超声处理(60 ℃、150 W处理30 min)→加入α-淀粉酶(酶添加量1.5%)→恒温水浴振荡酶解(55 ℃酶解2 h)→高温灭酶(95 ℃灭酶5 min)→冷却至55 ℃→加入复合蛋白酶(酶添加量1.2%)→恒温水浴振荡酶解(55 ℃酶解2 h)→高温灭酶(95 ℃灭酶5 min)→加入4倍体积体积分数为95%乙醇醇沉→沉淀用丙酮洗涤→抽滤→冷冻干燥(-40 ℃真空干燥)→茶树菇膳食纤维
1.3.3 茶树菇膳食纤维提取工艺优化单因素试验
准确称取2.0 g样品,以膳食纤维得率为评价指标,分别探究料液比(1∶25、1∶30、1∶35、1∶40、1∶45(g∶mL))、α-淀粉酶用量(0.5%、1.0%、1.5%、2.0%、2.5%)、复合蛋白酶用量(0.4%、0.8%、1.2%、1.6%、2.0%)、超声功率(50 W、100 W、150 W、200 W、250 W)、超声时间(20 min、25 min、30 min、35 min、40 min)、超声温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)对茶树菇膳食纤维得率的影响。
1.3.4 茶树菇膳食纤维提取工艺优化响应面试验
通过单因素试验,发现料液比、α-淀粉酶用量、复合蛋白酶用量、超声功率4个因素对茶树菇膳食纤维得率影响较大,因此选用此4因素为响应变量,以膳食纤维得率为响应值,设计4因素3水平响应面分析,共取29个试验点,其中5个点为零点,根据Box-Behnken试验设计原理,并对试验结果进行优化[15],试验因素与水平见表1。

表1 Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Behnken experimental design
1.3.5 分析检测
水分:按照GB5009.3—2016《食品中水分的测定》[16];蛋白质:按照GB 5009.5—2010《食品中蛋白质的测定》[17];脂肪:按照GB/T 14772—2008《食品中粗脂肪的测定》[18];灰分:按照GB 5009.4—2010《食品中灰分的测定》[19];膳食纤维:按照GB 5009.88—2014《食品中膳食纤维的测定》[20];总糖:按照GB/T15672—2009《食用菌中总糖含量的测定》[21]。
1.3.6 茶树菇膳食纤维理化性质测定
(1)持水力测定[22]
取2.0 g干燥样品,置于50 mL离心管中,称质量为m0,加入40 mL蒸馏水,室温下振荡30 min,静置12 h,5 000 r/min离心10 min,弃掉上清液,称质量为m1,持水力计算公式如下:
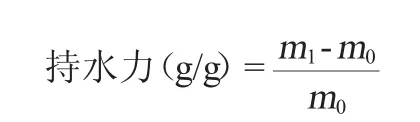
(2)膨胀力测定[23]
取1.0 g干燥样品(m),置于20 mL带刻度试管中,记录样品体积V0,准确加入10 mL蒸馏水,室温下振荡摇匀,静置12 h,记录其膨胀后体积V1,膨胀力计算公式如下:

(3)持油力测定[24]
取2.0 g干燥样品(m0),置于50 mL离心管中,加入玉米胚芽油40mL混合均匀,室温静置12h,5000r/min离心10min,弃掉上清液,称量剩余质量m1,持油力计算公式如下:

2 结果与分析
2.1 茶树菇的营养成分分析
对干燥粉碎后的茶树菇粉进行营养成分分析,以鲜质量计,结果见表2。

表2 茶树菇各组分含量检测结果Table 2 Determination results of each component contents of Agrocybe aegerita%
由表2可知,新鲜茶树菇中水分含量极高,高达90.59%。而在干质量中总糖含量最高,占比为56.1%,其中包含膳食纤维(37.7%),其次为蛋白质,占比为28.9%,灰分含量占比为12.3%,其主要成分为无机盐。脂肪含量最低,占比为2.6%。
2.2 茶树菇膳食纤维提取工艺优化单因素试验
2.2.1 料液比对茶树菇膳食纤维得率的影响
料液比对膳食纤维得率的影响,结果见图1。

图1 料液比对茶树菇膳食纤维得率的影响Fig.1 Effect of material to liquid ratio on dietary fiber yield of Agrocybe aegerita
由图1可知,随着料液比在1∶25~1∶30(g∶mL)范围内的减少,茶树菇膳食纤维得率呈现增加的趋势;当料液比在1∶30(g∶mL)时,茶树菇膳食纤维得率最高为37.8%;当料液比<1∶30(g∶mL)之后,会造成膳食纤维得率降低。综合考虑,选取最适料液比为1∶30(g∶mL)。
2.2.2α-淀粉酶用量对茶树菇膳食纤维得率的影响
α-淀粉酶用量对膳食纤维得率的影响,结果见图2。

图2 α-淀粉酶用量对茶树菇膳食纤维得率的影响Fig.2 Effect of α-amylase addition on dietary fiber yield of Agrocybe aegerita
由图2可知,当α-淀粉酶用量在0.5%~1.5%时,茶树菇膳食纤维得率随着酶用量的增加呈现快速上升趋势;当α-淀粉酶用量在1.5%时,茶树菇膳食纤维得率最高达到38.2%;当α-淀粉酶用量>1.5%之后,茶树菇膳食纤维得率逐渐降低。由于膳食纤维结构中的部分成分由α-糖苷键构成,当酶添加量过高时,酶解过度可能造成膳食纤维结构的破坏。综合考虑,选取最适α-淀粉酶用量为1.5%。
2.2.3 蛋白酶用量对茶树菇膳食纤维得率的影响
蛋白酶用量对膳食纤维得率的影响,结果见图3。
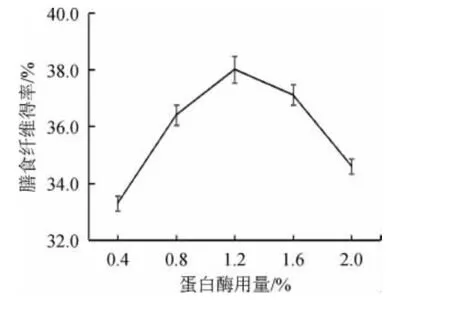
图3 蛋白酶用量对茶树菇膳食纤维得率的影响Fig.3 Effect of protease addition on dietary fiber yield of Agrocybe aegerita
由图3可知,在蛋白酶用量为0.4%~1.2%时,随着蛋白酶用量逐渐增加,茶树菇膳食纤维得率快速增加;当蛋白酶用量为1.2%时,茶树菇膳食纤维得率最高达到38%;当蛋白酶酶添加量>1.2%之后,可能使膳食纤维中少量碳氧键断裂,造成膳食纤维得率减少。综合考虑,选取最适蛋白酶用量为1.2%。
2.2.4 超声功率对茶树菇膳食纤维得率影响
超声功率对膳食纤维得率的影响,结果见图4。
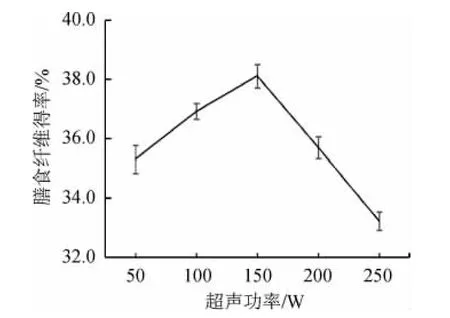
图4 超声功率对茶树菇膳食纤维得率的影响Fig.4 Effect of ultrasonic power on dietary fiber yield of Agrocybe aegerita
由图4可知,随着超声功率在50~150 W范围内逐渐增加,茶树菇膳食纤维得率随超声波功率增大逐渐增加;当超声功率为150 W时,茶树菇膳食纤维得率最高达到38.1%;当超声功率>150 W之后,可能使膳食纤维结构遭到破坏,造成膳食纤维得率迅速减少。综合考虑,选取最适超声功率为150 W。
2.2.5 超声时间对茶树菇膳食纤维得率的影响
超声时间对膳食纤维得率的影响见图5。

图5 超声时间对茶树菇膳食纤维得率的影响Fig.5 Effect of ultrasonic time on dietary fiber yield of Agrocybe aegerita
由图5可知,在超声时间为20~30 min时,茶树菇膳食纤维得率随超声时间增加呈现逐渐增加的趋势;当超声时间为30 min时,茶树菇膳食纤维得率最高达到37.6%;当超声时间>30 min之后,能使膳食纤维结构遭到破坏,造成膳食纤维得率减少。综合考虑,选取最适超声时间为30 min。
2.2.6 超声温度对茶树菇膳食纤维得率的影响
超声温度对膳食纤维得率的影响见图6。
由图6可知,当超声温度为30~60 ℃时,茶树菇膳食纤维得率随超声温度升高呈现缓慢上升的趋势;当超声时间为60 ℃时,茶树菇膳食纤维得率最高达到36.5%;当超声温度>60 ℃之后,高温会使膳食纤维键断裂,造成膳食纤维得率减少。综合考虑,选取最适超声温度为60 ℃。
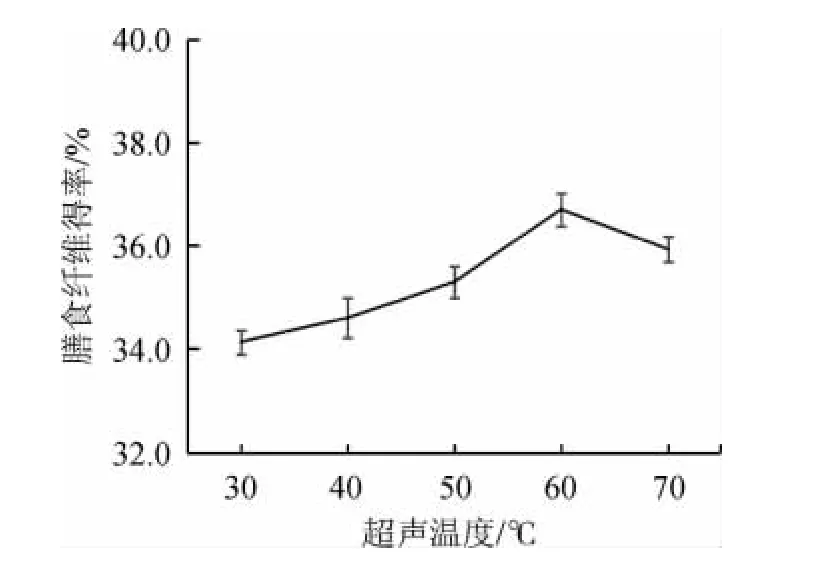
图6 超声温度对茶树菇膳食纤维得率的影响Fig.6 Effect of ultrasonic temperature on dietary fiber yield of Agrocybe aegerita
2.3 茶树菇膳食纤维提取工艺优化响应面试验结果分析
2.3.1 响应面优化试验设计与结果
在单因素试验基础上,固定超声时间为30 min,超声温度为60 ℃,选择料液比(A)、α-淀粉酶用量(B)、蛋白酶用量(C)和超声功率(D)为影响因素,以茶树菇膳食纤维得率为响应值(Y),根据Box-Behnken试验设计原理,选用4因素3水平设计方案优化试验[25],试验设计及结果见表3,方差分析见表4。

表3 Box-Behnken试验设计与结果Table 3 Design and results of Box-Behnken tests

续表
利用Design-Expert 8.0.5对表3中试验数据进行二次多项式回归拟合,得到回归方程为:


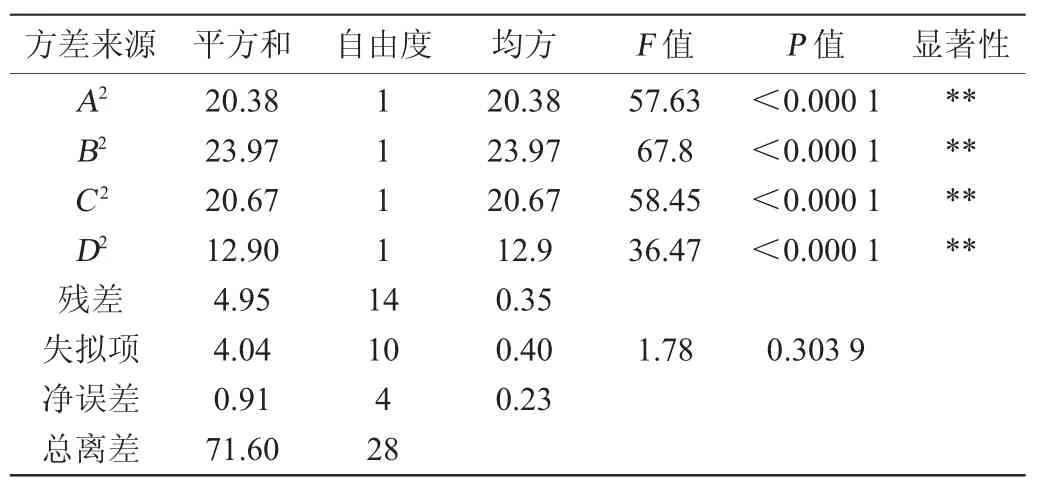
表4 回归模型方差分析Table 4 Variance analysis of regression model
续表
由表4可知,该模型极显著(P<0.01),决定系数R2为0.930 9,失拟项不显著(P>0.05),说明实验误差小且拟合度较高,可以应用于试验的分析预测。由方差分析的F值可以看出,各因素对茶树菇DF得率的影响大小依次为:料液比>蛋白酶用量>超声功率>α-淀粉酶用量;各因素中一次项因素A、交互项AD、二次项A2、B2、C2、D2对结果影响均达到极显著水平(P<0.01),交互项BC对结果影响达到显著水平(P<0.05)。
2.3.2 响应面及等高线分析
响应面及等高线图能够直观地反映出各因素的交互作用对响应值的影响程度,曲面越陡,等高线越密集,对相应值影响越显著[26]。在其他因素条件固定不变的情况下,考察交互项对茶树菇膳食纤维得率的影响。料液比、α-淀粉酶用量、蛋白酶用量和超声功率4个因素交互项的响应面及等高线见图7。
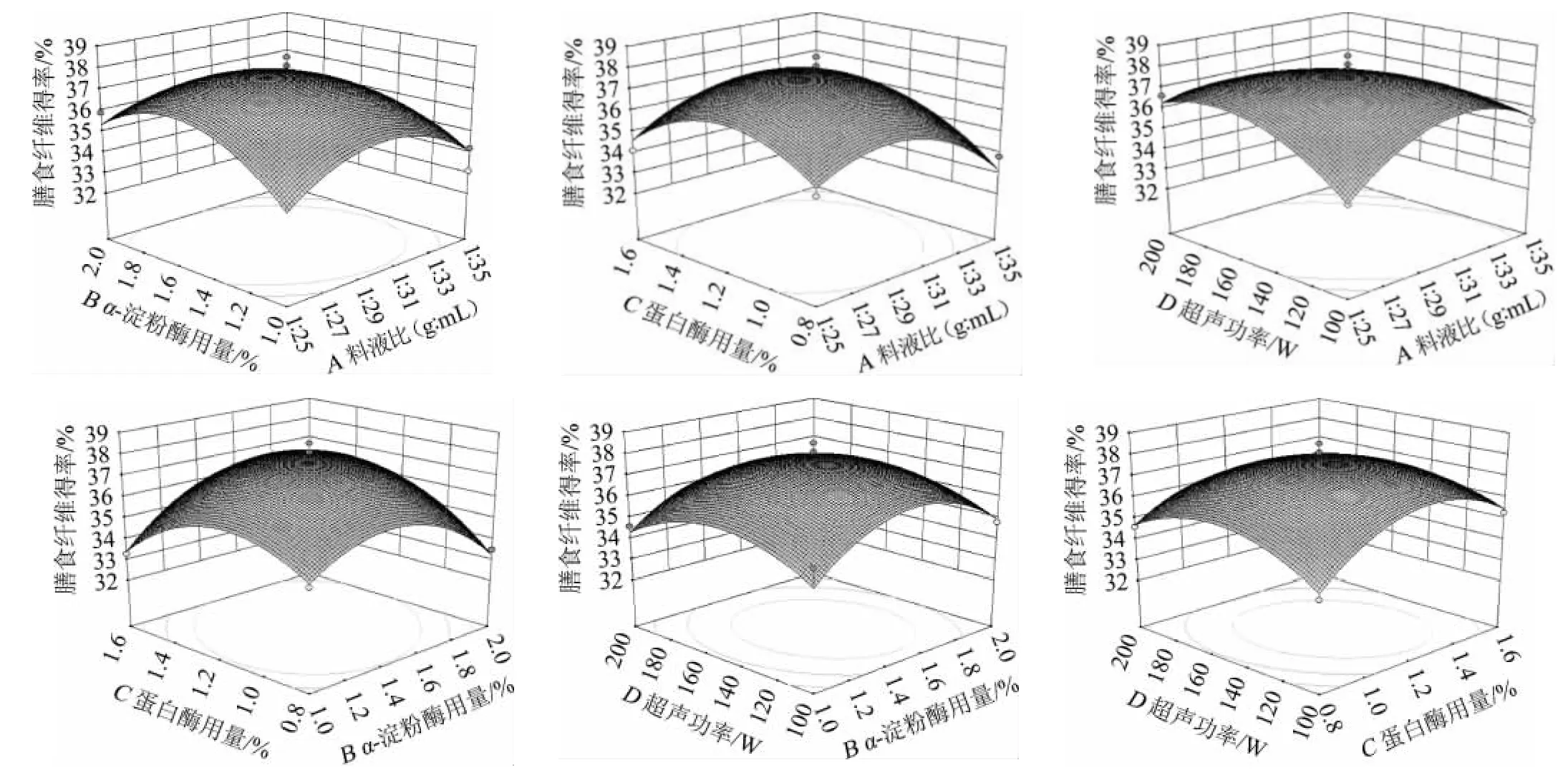
图7 料液比、α-淀粉酶用量、蛋白酶用量和超声功率交互作用对膳食纤维得率影响的响应面及等高线Fig.7 Response surface plots and contour lines of effects of interaction of material to liquid ratio,α-amylase addition,protease addition and ultrasonic power on dietary fiber yield
由图7可知,茶树菇膳食纤维得率随各因素水平的增大都呈现先增加后减少的变化,各因素交互作用等高线呈椭圆形,说明交互作用较为显著,其中料液比和超声功率的交互作用对膳食纤维得率影响最为显著,而α-淀粉酶用量和超声功率的交互作用对得率影响不显著,这与表4分析结果一致。
2.3.3 提取结果验证及对比试验
通过软件分析获得最佳工艺提取条件为料液比1∶29.20(g∶mL)、α-淀粉酶用量1.53%,蛋白酶用量1.22%超声功率149.86 W,在此优化条件下膳食纤维得率预测值为37.87%。为了便于试验操作,将最优条件修定为料液比1∶29(g∶mL)、α-淀粉酶用量1.5%,蛋白酶用量1.2%,超声功率150 W、超声时间30 min、超声温度60 ℃。在此优化条件下进行3次平行试验,测得茶树菇膳食纤维得率实际值为37.70%,与软件预测值接近,其中有1.2%为可溶性膳食纤维。之后以优化后相同的提取条件作为对比,采用超声波水提取茶树菇膳食纤维,提取条件为料液比1∶29(g∶mL)、超声功率150 W、超声时间30 min、超声温度60 ℃。在此优化条件下茶树菇膳食纤维得率达到32.3%,并测得其中只有0.6%为可溶性膳食纤维,膳食纤维总得率比超声辅助酶法低5.4%。因此选用超声辅助酶法提取茶树菇膳食纤维得率较高,且采用响应面优化方法得到的数据准确可靠。
2.3.4 茶树菇膳食纤维理化性质测定结果
持水力、膨胀性、持油力是膳食纤维理化性质重要的衡量标准,3种理化指数越大,说明膳食纤维的生理活性越好[27],茶树菇持水性最高达5.4 g/g,膨胀力高达2.1 mL/g,持油力高达2.7 g/g,高持水力和持油力的膳食纤维对糖尿病的预防和治疗起到非常重要的作用[28]。
3 结论
本研究采用超声辅助酶法提取茶树菇膳食纤维,通过单因素和响应面试验对提取工艺进行优化,得到最佳提取工艺提取条件:料液比1∶29(g∶mL),α-淀粉酶用量1.5%,蛋白酶用量1.2%,超声功率150 W。在此优化条件下,茶树菇膳食纤维得率为37.7%,并对其理化性质进行测定,测得持水力为5.4 g/g,膨胀力为2.1 mL/g,持油力为2.7 g/g。通过该方法制备的膳食纤维活性较高,可制作成功能性食品应用到饮料、面包、饼干等食品中,提高茶树菇产品的附加值,为茶树菇的功能性产品开发提供理论依据。
