马钱子对斑马鱼幼鱼肝脏毒性的初步研究
2020-06-08赵霞赵崇军魏紫樱韩志伟邹迪新林瑞超
赵霞 赵崇军 魏紫樱 韩志伟 邹迪新 林瑞超
马钱子在历代应用中发挥着重要的作用,有效亦有毒,马钱子中毒事件时有发生,严重限制了其临床应用[1-2]。马钱子归肝经,有文章报道长期服用可导致肝肾功能异常。因此本试验主要利用斑马鱼模型研究马钱子肝毒性机制[3-4]。在前期研究中,主要是利用斑马鱼的肝脏表型对由马钱子的肝脏毒性进行了定性评价[5],本研究的目的是利用斑马鱼肝脏形态、肝功能、生理参数及肝脏毒性相关基因的表达水平来定量评价马钱子对斑马鱼肝脏的影响。这是首次对斑马鱼中马钱子诱导的肝毒性进行初步、系统的研究,可为马钱子的肝毒性机制提供有价值的见解。
1 材料与方法
1.1 试剂和仪器
动物:AB系斑马鱼,购自中国斑马鱼资源中心(武汉),饲养于本实验室循环养殖系统。
仪器:蔡司体视荧光显微镜(Zeiss Axio Zoom V16),LRH-250Z型恒温生化培养箱(广州沪瑞明仪器有限公司),RJLDL-50G型离心机(无锡瑞江分析仪器有限公司),微型漩涡混悬(WH-90A,上海振荣科学仪器有限公司),灭菌锅(MLS-3751L,日本panasonic公司),Epoch 酶标仪(美国伯腾仪器有限公司),UV-2000紫外-可见分光光度计(尤尼柯上海仪器有限公司),HQ10-20H超纯水仪(长沙聚丰环保科技有限公司),真空旋转蒸发仪(北京东方科技发展有限公司),凝胶电泳(NanoDrop 2000),CFX96 Touch Systems (bio-rad, USA),TransStart Top Green qPCR Super Mix (TransGen Biotech)。
材料:马钱子(编号#160611)由安国圣山药业有限公司提供。油红O(s19039-100g),吖啶橙(s47568-5g),4%多聚甲醛(p1110)购置于北京拜尔迪生物技术有限公司。SOD试剂盒(A001-3)、CAT试剂盒(A007-1)、AST试剂盒(C010-2)、ALT试剂盒(C009-2)、MDA试剂盒(A003-4)均购置于南京建成生物工程研究所,Bradford蛋白定量试剂盒(W042)(北京拜尔迪生物技术有限公司)。PBS缓冲液(21-040-CVR)(Corning,美国)。M3-氨基苯甲酰胺麻醉(MESAB-22)购置于美国密苏里州圣路易斯西格玛奥德里奇公司。H2O2购于北京化工厂,甲酰胺,SSC缓冲液(pH=7.0)购于北京生物技术有限公司。1,2-丙二醇溶液(中国广东西龙科学有限公司)。RNA保护液、TaKaRa Mini BEST Universal RNA Extraction Kit试剂盒均购于日本Takara,(Takara,日本东京)。FastKing RT试剂盒(北京天根生化科技有限公司)。斑马鱼特异性PCR(北京博基因技术有限公司)。NaCl、KCl、CaCl2、Na2HPO4、K2HPO4、MgSO4、NaHCO3均为分析纯,购置于北京化工,移液器(德国Eppendorf公司),12孔板(Corning,美国)。
1.2 斑马鱼
本实验中进行的所有斑马鱼相关实验都是根据《中华人民共和国科技部动物管理办法》,并经北京中医药大学动物伦理委员会批准后所进行的。斑马鱼培养条件为:暗/光周期为10:14小时。水产养殖条件需要控制[温度(28.5±0.5)℃,pH值7.0~7.4,导电率480~510 μS/cm,硬度50~70 mg/L(CaCO3)]。斑马鱼胚胎是以1∶1的雌雄比(5~8月龄)自然配对交配产生,28.5℃下在胚胎培养水中进行孵育,并且实验开始前需在蔡司立体荧光显微镜下取出死亡和未受精的胚胎。
1.3 样本的制备
马钱子(50.0 g)粉碎后过40目筛,用10倍量蒸馏水加热回流提取2小时。过滤后,将残渣用蒸馏水重复上述操作提取2次,每次1小时。3次回流上清液混合,过滤、离心(3000g)30分钟,采用真空旋转蒸发仪对上清液进行减压浓缩。并在室温下真空干燥。获得的干燥提取物在干燥器中保存直到使用为止。使用时用胚胎培养水将提取物复溶,配置成实验所需母液(400 μg/mL),然后稀释至工作浓度。
1.4 斑马鱼暴露
选取健康正常的3天的斑马鱼幼鱼,置于12孔微板中,每孔20条。4天时,快速吸取胚胎培养水并加入4 mL不同浓度的暴露液。对照组均用等量的新鲜胚胎水平行处理。为了保证实验结果的稳定性和重复性,每个浓度设置2个重复孔,每个培养板由5个剂量组和1个对照组组成。如果对照组胚胎的死亡或畸形率>10%,则该实验认为无效而终止。实验暴露过程中的温度、湿度、光周期等外界条件与培养环境相同。
1.5 量毒曲线评价
为了建立致死曲线,在实验暴露终点,对不同处理组中存活的斑马鱼进行计数。实验重复了三次。得到死亡率曲线,并用Logistic回归分析计算LC10(SPSS统计为Windows,Version 17.0)。
1.6 肝脏形态和生理参数的评估
在亚致死浓度条件下(
参考已发表文章,以超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活性及丙二醛(malondialdehyde,MDA)等肝功能指标及相关生理指标确认马钱子对斑马鱼幼鱼的肝毒性[6-7]。在暴露终点,从不同处理组中随机抽取80条斑马鱼,用清水洗两次,转移到1.5 mL升离心管中;将斑马鱼置于冰水中进行安乐死,每个样品加10倍体积PBS冰浴匀浆,离心(3000g,10分钟)。收集上清液,根据相应检测试剂盒中提供的指示测定上清液中SOD、CAT、ALT、AST活性及MDA含量,整个实验至少重复三次。
1.7 油红O染色观察肝脏脂肪
在实验暴露终点,用胚胎水冲洗两次,固定在4%多聚甲醛中,4℃条件下过夜。随后PBS洗涤,用含6 mL无菌水、3.3 mL 30%的H2O2、0.5 mL甲酰胺和0.25 mL SSC缓冲液(pH=7.0)的溶液处理。随后,PBS中洗涤后,依次在85%和100%的1,2-丙二醇溶液中浸泡10分钟,然后在0.5%新配置的油红O中并在室温黑暗中过夜染色。随后,将斑马鱼分别用100%和85%的1,2-丙二醇洗30分钟左右,再用PBS洗两次。斑马鱼在80%的1,2-丙二醇中贮藏,显微镜明亮视野成像拍摄。油红O染色的所有步骤在室温下慢速摇床上进行。当肝脏与周围组织之间有明显的细线且肝脏内可见3个以上的脂滴时,认为该结果为脂肪变性阳性[8-9]。
1.8 吖啶橙染色观察凋亡细胞
吖啶橙染色法被广泛应用于细胞凋亡检测,可用于检测斑马鱼幼鱼中的凋亡细胞[10]。将暴露处理后的幼鱼用胚胎水冲洗三次,并暴露在含5 μg/mL吖啶橙的胚胎水中,避光处理20分钟。去除吖啶橙溶液后,用PBS溶液冲洗2次后,将斑马鱼样本置于荧光显微镜下进行观察。
1.9 RNA提取与实时定量PCR(Q-RT-PCR)检测
样品制备:每组随机抽取40条斑马鱼,用胚胎水冲洗2次,转移到含有1 mL RNA保护液的1.5 mL离心管中,储存在-20℃。用TaKaRa Mini BEST Universal RNA Extraction Kit试剂盒提取总RNA。通过凝胶电泳和紫外分光度计检测RNA的完整性。采用FastKing RT试剂盒将各组等量的总RNA样本逆转录至cDNA。采用CFX96 Touch Systems与TransStart Top Green qPCR Super Mix 进行实时定量PCR分析。所有步骤均按照制造商提供的不同试剂盒说明进行。用Primer Premier 5.0软件设计了斑马鱼特异性PCR引物。两步PCR扩增协议如下:95°C 3分钟,60°C循环40次,20秒,95°C 15秒,60°C 10秒,95℃ 15秒。见表1。
1.10 统计学处理

2 结果
2.1 急性毒性评价
在实验暴露终点,通过统计不同处理组中存活的斑马鱼数目来计算其死亡率,进而获得马钱子对斑马鱼幼鱼的量毒曲线。结果表明200 μg/mL或更高浓度马钱子处理24小时后,斑马鱼全部死亡。80 μg/mL以下暴露致斑马鱼的死亡率接近0%,对照组死亡率最低(死亡率<10%)。不同处理组中斑马鱼幼鱼的死亡率如图1显示。结果表明,随着暴露浓度的增加,斑马鱼幼鱼的死亡率呈浓度依赖性增加。由于剂量效应,根据死亡率曲线计算得到马钱子对斑马鱼幼鱼LC10为76.523 μg/mL。见图1。
2.2 马钱子对肝脏形态学的影响
通过三个特定的表型终点(肝脏变性,肝脏大小的变化和卵黄囊保留)来评估肝毒性[11]。对照组中可明显观察到斑马鱼肝脏与周围组织的边界清晰,肝脏灌注循环血细胞,见图2(d)。与对照组相比,马钱子诱导使肝脏变暗,肝组织轮廓模糊,表明肝脏变性和/或坏死[12]。见图2。

图1 不同浓度马钱子提取物处理24小时后斑马鱼幼鱼的量毒曲线
2.3 肝脏表型的定量分析
每个实验条件下用20条斑马鱼幼鱼评价肝脏面积和光密度,通过肝脏大小和光密度的变化来定量评价马钱子的肝脏毒性。空白对照组及不同浓度药液处理24小时后,在暴露终点,随着浓度的增加,处理组中肝脏面积和光密度呈浓度依赖性增加,并且与对照组相比具有显著差异(P<0.01)。见表2。

注:(a)马钱子暴露组斑马鱼幼鱼肝脏组织退化,卵黄囊保留;(b)马钱子暴露组斑马鱼幼鱼肝脏肿大;(c)马钱子暴露组斑马鱼幼鱼肝脏颜色较深;(d)空白对照组肝脏清晰、健康。L:肝脏;Y:卵黄囊图2 马钱子提取物处理斑马鱼幼鱼24小时后肝脏形态学变化(×50)

表2 马钱子处理24小时后斑马鱼幼鱼肝脏表型(肝脏面积和光密度)
注: 与空白对照组比较,表示aP<0.01。
2.4 酶活性测定
每个实验条件下用80条斑马鱼评价肝功能和生理参数,为进一步评估肝脏损害,在实验暴露终点,利用试剂盒对肝功能(ALT/GPT,AST/GOT),和一系列的生化指标(MDA,SOD,CAT)进行评价[15-16]。与对照组相比,中、高剂量组CAT活性下降,并具有极显著差异(P<0.01),低剂量组CAT酶活性有显著差异(P<0.05)。与对照组相比,马钱子暴露组中SOD活性低于对照组,并具有极显著差异(P<0.01)。与对照组相比,中、高剂量组MDA活性升高,并具有极显著差异(P<0.01),低剂量组MDA活性升高,有显著差异(P<0.05)。与对照组相比,中、高剂量组ALT/GPT活性升高,并具有极显著差异(P< 0.01)。低浓度处理对ALT/GPT 活性无明显影响。与对照组相比,马钱子暴露组AST/GOT活性高于对照组,并具有极显著差异(P<0.01)。见表3。
2.5 全脂油红O染色和吖啶橙染色
油红O能与斑马鱼幼鱼中性脂结合[13]。染色结果显示,处理组肝脏中的脂质含量与对照组相比有显着性差异,见图3(a),表明用马钱子处理的幼鱼发生了脂肪变性,见图3(b)黑色箭头。
吖啶橙作为一种异色染料,可与凋亡细胞中的DNA发生反应,发出绿色荧光,通过这种荧光可以有效快速地识别凋亡细胞的确切区域,因此被广泛用于检测包括斑马鱼模型在内的不同组织中的细胞凋亡[14]。如早期研究所述,低浓度的马钱子提取物可引起斑马鱼幼体细胞凋亡(
2.6 氧化应激与马钱子肝毒性的关系
越来越多的证据表明氧化应激损伤与中草药相关肝损伤(herb-induced liver injury,HILI)的发生密切相关。实时定量PCR(Q-RT-PCR)结果表明,和空白对照组相比,马钱子暴露处理能够显著引起超氧化物歧化酶1(superoxidedismutase1,sod1)、醌氧化还原酶1(nad(p)hquinoneoxidoreductase1,nqo1)、谷胱甘肽S-转移酶P 2(glutathiones-transferasep2,gstp2)、B细胞淋巴瘤2(b-celllymphoma-2,bcl-2)基因表达水平呈浓度依赖性降低,具有显著性(见表4),而谷胱甘肽S-转移酶P 2(glutathiones-transferasep2,gstp2)基因的表达水平仅以浓度方式降低,该结果与前期研究是极其相似的。然而,暴露对线粒体解偶联蛋白2基因(uncouplingprotein2,ucp2)的表达水平无显著影响。见表4。
2.7 细胞凋亡相关基因与马钱子致肝毒性的关系
细胞凋亡是各种急、慢性肝损伤发生后期的共同特征。研究表明,线粒体凋亡途径受BCL-2家族[17]的调控。bcl-2和骨髓细胞白血病-1B基因(myeloidcellleukemia-1b,mcl-1b)是抑制细胞凋亡和促进细胞存活的两个关键基因。BH3互动死亡激动剂基因(recombinantBH3interactingdomaindeathagonist,bid)和BCL 2关联X蛋白基因(Bcl 2associatedX,apoptosisregulator,bax-2)对细胞凋亡有促进作用。Q-RT-PCR结果表明,与空白对照组相比,马钱子处理可使bid表达增加4至6倍,mcl-1b则可增加1至2倍,引起bid和mcl-1b基因表达水平的提高,bax-2表达水平下降,bcl-2表达水平无明显变化(P>0.05)。见表5。

表3 马钱子处理24小时后对斑马鱼幼鱼肝脏功能和生理参数的影响
注: 与空白对照组比较,aP<0.01,bP<0.05。

注:(a)空白对照组油红O染色;(b)30 μg/mL马钱子提取物暴露组油红O染色。脂肪变性(黑色箭头,30×);(c)空白对照组吖啶橙染色;(d)30 μg/mL马钱子提取物暴露组吖啶橙染色。图3 油红O染色和吖啶橙染色(×50)
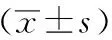
表4 空白对照组及不同浓度给药组处理24小时后斑马鱼幼鱼氧化应激相关基因表达的变化
注: 与空白对照组比较,aP<0.01。

表5 空白对照组及不同浓度给药组处理24小时后斑马鱼幼鱼细胞凋亡相关基因表达的变化
注:与空白对照组比较,aP<0.01,bP<0.05。

表6 空白对照组及不同浓度给药组处理24小时后斑马鱼幼鱼脂质代谢相关基因表达的变化
注:与空白对照组比较,aP<0.01,bP<0.05。
2.8 脂质代谢相关基因与马钱子致肝毒性的关系
为了从基因水平了解马钱子的肝脏毒性机制,应用Q-RT-PCR技术检测肝组织脂肪代谢和纤维化相关基因的表达水平,包括肝纤维化相关基因成纤维细胞活化蛋白α基因(fibroblastactivationproteinalpha,fabp)、瘦素受体基因(leptinreceptor,lepr)、视黄醇结合蛋白4基因(retinolbindingprotein4,rbp4)、转化生长因子基因(transforminggrowthfactorbeta1,tgf-β1)及其受体转化生长因子β受体2基因(transforminggrowthfactorbetareceptor2,tgf-βr2)的表达,结果见表6。研究结果表明,与空白对照组相比,随着马钱子浓度的增加,tgf-β1表达水平呈上升趋势,并且具有统计学差异(P<0.0 5)。与tgf-β1类似,低、中剂量组中rbp4表达水平显著升高(P<0.0 1)。 而马钱子暴露导致3-羟基-3-甲基戊二酰辅酶A还原酶基因(3-hydroxy-3-methylglutaryl-coareductase,hmgcra)表达水平呈浓度依赖性降低,并具极显著差异(P<0.0 1)。此外,高浓度处理可导致大多数基因表达水平下降。 结果提示肝脂肪变性和纤维化可能与调节tgf-β1、rbp4和hmgcra的表达有关。
3 结论
近年来,马钱子的生物活性作用及活性成分的研究较多,对马钱子毒性机制的研究较少。本研究首次报道了马钱子的体内肝脏毒性机制,结果表明,马钱子诱导可破坏斑马鱼的抗氧化防御系统,扰乱脂肪代谢平衡,引起细胞凋亡,最终导致肝脏损伤。本研究首次证实了斑马鱼肝脏毒性研究的有效性和可预测性,为马钱子的肝毒性研究提供了补充资料。然而,心脏等其他重要器官对马钱子肝脏毒性作用的影响,马钱子肝毒性机制在斑马鱼与哺乳动物之间的物种保守性还有待进一步研究。在未来,我们将采用一种基于组学和系统生物学的方法来研究马钱子的系统生物学特性、中草药化学特性与生物学特性的关系。
最近,越来越多的报道表明,HILI评价的最佳策略是建立一个完整的评估体系和一个合适的动物模型来预测药物潜在的肝毒性[18],斑马鱼幼鱼可为HILI[19-20]的筛选策略提供极大的附加值。总之,它可以作为体内模型和体外模型之间的桥梁,将完整的生物复杂性和高通量筛选能力结合起来[21]。
本研究首次利用斑马鱼评估了马钱子的急性毒性。在亚致死浓度(
最后,通过检测相关基因的转录水平对马钱子的肝毒性机制进行了初步研究。结果表明抗氧化和解毒酶基因[26],比如sod1、bcl-2、gstp2和nqo1基因的表达水平发生显著下调,进一步证实马钱子的肝毒性部分是由于抗氧化活性紊乱所致。此外,bid基因的表达水平发生显著上调。相反,mcl-1b基因的表达水平增加,这可能是自我保护表达的结果,但其表达增加水平远低于bid基因的表达量,说明斑马鱼的自我保护能力远不能阻止细胞的凋亡过程。此外,tgf-β1和rbp4基因的表达水平呈现出浓度依赖性增加的趋势,而hmgcra基因表达水平下降。此外,高浓度处理使大多数基因表达水平下降。提示肝组织脂肪变性和纤维化可能与上调肝组织tgf-β1基因的表达有关,因此,马钱子对斑马鱼幼鱼的肝毒性可能是通过脂肪变性、纤维化-凋亡途径介导的。
