灯盏花素对缺氧/复氧诱导的皮质神经元凋亡的影响
2020-06-08赵中华张桃桃
赵中华,张桃桃,王 慧
0 引言
大脑缺血时诱发氧化应激反应,释放脂质过氧化产物、谷氨酸、兴奋性氨基酸及炎性因子,加重脑组织损伤[1-2]。神经细胞损伤后不可逆,因此,尽快恢复脑组织血流、保证脑组织氧供对神经元突触的重塑及存活有着重要意义。灯盏花素(Scutellarin)是临床常用的脑保护剂,具有减轻组织水肿、改善微循环、抗氧化、扩张血管的作用[3-4]。
缺血性脑卒中是一个复杂的病理生理过程,涉及神经细胞凋亡、氧化应激、炎症反应等多个环节。Bcl-2蛋白属膜整合蛋白,能够阻止细胞色素C从线粒体释放到细胞质,从而抑制细胞凋亡。Bax是重要的促细胞凋亡基因之一,其过度表达可拮抗Bcl-2的保护效应而使细胞趋于死亡。本实验采用缺氧/复氧模式模拟在体脑缺血再灌注损伤,以原代培养的大鼠皮质神经元为研究对象,研究灯盏花素对神经元的保护作用及机制,为其临床应用提供科学的实验资料。
1 材料与方法
1.1 材料 灯盏花素(美国Sigma公司,纯度>99%),DMEM培养基(北京索莱宝科技有限公司),CCK-8试剂盒(武汉博士德生物工程有限公司),LDH、SOD、MDA试剂盒(南京建成生物试剂公司),2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodi hydrofluorescein diacetate,H2DCFDA)荧光探针(美国BD公司),FITC Annexin V凋亡检测试剂盒(美国BD公司),Bcl-2及Bax抗体(上海碧云天公司)。
1.2 方法
1.2.1 细胞培养 取出生24 h内SD大鼠,置于培养皿中,无菌条件下取大脑皮层,快速剪碎后置于含0.125%胰蛋白酶的PBS液中,37 ℃消化15 min,制备细胞悬液,1 000 r/min离心5 min,弃上清液后将细胞接种于塑料培养瓶中,37 ℃、5% CO2的培养箱中培养,3~5 d换液1次。
1.2.2 缺氧复氧模型的建立及细胞分组 共分4组,每组5个复孔。①对照组:常规培养。②模型组(神经元缺氧/复氧模型):细胞置37 ℃培养罐中,缓慢持续通入含有5% CO2+95% N2的混合气体30 min,至罐内氧气含量低于1%,造成神经元缺氧,密封培养罐4 h后,将原来的培养液吸除,重新更换培养液,立即将细胞移至37 ℃、5% CO2的培养箱中继续培养12 h,使细胞复氧。③灯盏花素低、高浓度组:进行缺氧/复氧操作前0.5 h,在培养基中加入溶于DMSO的灯盏花素(1、10 μmol/L),其余步骤同模型组。
1.2.3 CCK-8法测定神经元细胞增殖 神经元培养于96孔板内,每孔200 μl,细胞密度为1×105/ml,弃去原有培养液,将已配置含10% CCK-8的培养基以换液的形式加入,接种后的96孔板37 ℃培养箱中培养4 h,观察细胞已贴壁。用480 nm吸光度进行检测。
1.2.4 各组细胞上清液LDH及细胞内SOD、MDA检测 收集神经元细胞上清液,严格按照LDH试剂盒说明书检测各组细胞上清液LDH活性;另取各组细胞,裂解后按照SOD、MDA试剂盒的方法进行各样本吸光度值检测。
1.2.5 流式细胞技术检测神经元内活性氧表达 神经元细胞培养于6孔板中,每孔500 μl,细胞密度为1×105个/ml,磷酸缓冲液(Phosphate buffer solution,PBS)冲洗3遍,离心(1 000 r/min)后收集细胞,黑暗中在室温下加入5 μl H2DCFDA染料,15 min后流式细胞仪检测并分析细胞内活性氧表达量变化。
1.2.6 FITC Annexin V细胞凋亡检测 收集细胞后PBS制备细胞悬液,1 000 r/min离心并收集细胞,离心管内加入300 μl缓冲液,混匀后加入5 μl Annexin-V和10 μl PI,避光反应30 min后采用流式细胞仪检测细胞凋亡率。
1.2.7 Western blot检测Bcl-2及Bax的蛋白表达水平 收集细胞并提取总蛋白,10 000 r/min离心10 min后取上清,行10%SDS-聚丙烯酰胺凝胶电泳,转膜后5%的脱脂奶粉4 ℃封闭2 h,加一抗过夜,室温下孵育二抗1 h,ECL化学发光法自显影并采集图像。
2 结果
2.1 灯盏花素浓度对神经元细胞存活率的影响 模型组神经元细胞存活率为36.68%±4.79%,对照组为100.42%±4.55%,两组比较差异有统计学意义(P<0.05)。用1、10 μmol/L灯盏花素处理后,细胞存活率逐渐提高,分别为59.87%±4.53%和69.93%±5.27%,与对照组及模型组比较差异均有统计学意义(P<0.05)。见表1。

表1 灯盏花素对神经元细胞存活率的影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.2 灯盏花素对缺氧/复氧神经元细胞LDH外漏及SOD、MDA水平的影响 与对照组相比,模型组细胞外培养基中LDH的释放显著增加(P<0.05)。与模型组相比,灯盏花素能够显著降低缺氧/复氧神经元细胞外上清液中LDH水平(P<0.05),说明灯盏花素能缓解细胞损伤。与对照组比较,模型组神经元细胞内SOD水平降低,MDA水平升高(P<0.05);与模型组比较,灯盏花素组能显著升高SOD活力,降低MDA水平(P<0.05),且与浓度相关。其中,灯盏花素高浓度组中LDH及SOD水平与对照组比较,差异无统计学意义(P>0.05),说明灯盏花素可以部分恢复LDH及SOD水平。见表2。

表2 灯盏花素对缺氧/复氧皮质神经元损伤LDH、SOD和MDA的影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.3 灯盏花素对神经元细胞内ROS的影响 H2DCFDA荧光探针标记法是一种检测细胞内ROS生成量变化的检查方法,细胞氧化损伤程度越重,主峰越向右侧偏移。流式细胞技术结果显示,对照组细胞内ROS表达均较低,ROS主峰位于基线左侧,模型组DCF荧光信号明显增强,ROS主峰位于基线右侧,不同浓度灯盏花素干预后,荧光信号强度逐渐减弱,ROS主峰向基线左侧移位。见图1。
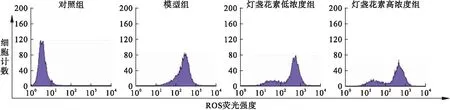
图1 流式细胞技术检测神经元细胞内ROS改变
2.4 灯盏花素对神经元细胞凋亡的影响 荧光显微镜下,对照组未见明显凋亡细胞,细胞核均为暗蓝色低荧光;模型组细胞核着色不均匀,凋亡细胞呈亮蓝色高荧光;1、10 μmol/L灯盏花素处理后凋亡细胞数量逐渐减少。见图2、表3。

图2 Hoechst染色观察神经元细胞凋亡
2.4 Bcl-2及Bax蛋白表达水平检测 Bcl-2蛋白在模型组中的表达明显降低,与对照组相比差异有统计学意义(P<0.05);低、高浓度灯盏花素组Bcl-2蛋白表达逐渐升高,与模型组比较差异均有统计学意义(P<0.05);Bax蛋白在模型组中的表达明显升高,与对照组相比差异有统计学意义(P<0.05);灯盏花素干预可降低Bax蛋白的表达,低、高剂量灯盏花素组Bax蛋白的相对表达量与模型组相比差异有统计学意义(P<0.05);其中,高剂量灯盏花素组Bcl-2蛋白的相对表达量与对照组相比差异无统计学意义(P>0.05),说明高剂量灯盏花素促进了神经元细胞内Bcl-2表达趋于正常化。见图3、表4。
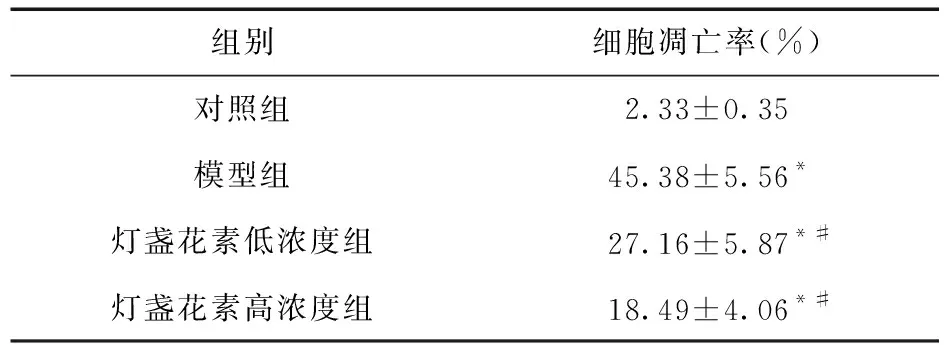
表3 灯盏花素对神经元细胞凋亡的影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05

图3 灯盏花素对神经元细胞内Bcl-2及Bax表达的影响
表4 各组Bcl-2及Bax蛋白相对表达比较

组别Bcl-2Bax对照组0.80±0.220.21±0.06模型组0.19±0.12*0.83±0.11*灯盏花素低浓度组0.29±0.16*#0.45±0.10*#灯盏花素高浓度组0.75±0.18#0.39±0.12*#
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
3 讨论
临床上,灯盏花素已经用于辅助治疗脑卒中[5-6]。研究表明,灯盏花素通过扩张脑血管改善微循环、恢复缺血病变区血流量等方式复原和改善神经功能;此外,灯盏花素还可减轻脑组织血管损伤和炎症反应,从而减少缺血缺氧对神经功能的损伤,对脑缺血疾病有较好的疗效[5,7]。基于灯盏花素较强的抗氧化损伤作用,可以有效清除自由基,对改善患者生活能力和认知功能有明确效果[6]。
关于灯盏花素对原代培养大鼠神经元缺氧/复氧损伤保护作用的研究不多,徐露等[8]观察灯盏花素联合冰片对缺氧/复氧下原代培养大鼠脑微血管内皮细胞影响,结果显示,两者联合应用可促进ZO-1和Claudin-5蛋白的表达,维持血脑屏障(BBB)紧密连接的完整性。
多种脑血管疾病的损伤机制与神经细胞的缺氧/复氧损伤密切相关[9]。原代培养的神经元缺氧后,谷氨酸递质及嘌呤类代谢产物增加,复氧后在黄嘌呤氧化酶的作用下大量活性氧族(ROS)堆积,ROS水平高低与脑损伤程度直接相关。当ROS水平较高时,神经细胞氧化应激反应增强,细胞损伤加重[10-11]。本研究结果显示,缺氧/复氧破坏了神经元正常生理功能,细胞存活率显著下降。
LDH存在于机体所有组织细胞的胞质内,其含量高低可反映细胞膜的完整性。SOD是细胞内具有抗氧化作用的酶,SOD水平高低反映了机体间接清除氧自由基的能力,两者活力和含量可反映细胞抗氧化的能力。MDA是膜质过氧化最重要的产物之一,它的产生能增加细胞膜损伤,因此,可通过MDA了解膜质过氧化的程度,以间接测定膜系统受损程度。本实验结果显示,灯盏花素预处理能显著降低缺氧/复氧神经元细胞外上清液中LDH漏出率,增加缺氧/复氧神经元细胞内SOD的表达,降低细胞内MDA含量。
H2DCFDA荧光探针是一种检测细胞氧化应激状态的染色方法。本研究采用流式细胞技术观察缺氧/复氧对神经元的氧化损伤程度,观察结果显示,模型组神经元氧化损伤明显,灯盏花素可以不同程度地抑制缺氧/复氧诱导的神经元氧化损伤。
Hoechst 33258染色剂能嵌入凋亡细胞的细胞核DNA,使细胞核浓染,呈致密颗粒和(或)块状蓝色高荧光。本实验中,模型组中亮蓝色荧光明显增多,证实缺氧/复氧可以诱发神经元细胞凋亡,灯盏花素低浓度组及灯盏花素高浓度组中凋亡细胞比例逐渐降低。
脑缺血/再灌注引起的细胞损伤可以通过细胞凋亡的方式导致神经元死亡[12]。Bcl-2在氧化应激介导的细胞凋亡反应中起重要作用,具有潜在的抗凋亡作用[13]。Bax表达水平的高低直接反映细胞凋亡程度,Western blot结果显示,模型组细胞中Bcl-2蛋白表达明显降低,Bax蛋白表达明显增加,提示缺氧/复氧诱导了神经元凋亡,灯盏花素通过改变Bcl-2、Bax蛋白的表达发挥抗细胞凋亡作用。
综上所述,灯盏花素能够有效抑制缺氧/复氧诱导的神经元凋亡,为预防和治疗缺血性脑卒中及退行性神经疾病提供了理论支持。
