AgNO3逆转的黄芩组培玻璃化苗的活性成分含量及其生物活性研究
2020-06-08王胜芳韩淑兰党士坤王慧梅
王胜芳 韩淑兰 党士坤 王慧梅
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
黄芩(ScutellariabaicalensisGeorgi.)为唇形科(Labiatae)多年生草本植物,是一种典型的药食同源药材,具有清热燥湿、解毒、止血和安胎的功效[1],对慢性疾病患者有良好的保健作用[2]。黄芩还是一种良好的天然抑菌剂,临床抗菌性能好且无耐药性[3~4],其提取物具有抗炎[5]、抗氧化[6]和抗肿瘤[7]的作用。因此,黄芩具有较高的研究价值,目前,国内外对黄芩中药材需求量也日益增加,但我国野生黄芩资源有限无法满足巨大的市场需求。植物组织培养离体繁殖技术能够在短时间内繁殖出生长速度快,次生代谢产物含量高的优良无性系,而且对外界环境的依赖性低,管理方便,可以实现工业化生产。因此黄芩的快速繁殖技术已成为解决该问题的重要手段之一。但在黄芩的组织培养过程中,组培苗玻璃化现象严重制约了这一技术的应用。
近年来,有不少的专家学者针对试管苗玻璃化的机制进行研究,并取得了一定的进展,其中被大众广泛认可的观点是AgNO3通过竞争乙烯的作用位点抑制乙烯的合成及信号的传导,进而抑制保卫细胞中H2O2的积累,导致气孔的密度及孔径增大,失水量增加,植物玻璃化程度减轻,进而发生逆转[8]。
本研究首先以组培黄芩玻璃化苗为材料,研究AgNO3对玻璃化苗的逆转作用,确定AgNO3的最适浓度;在此基础上,对恢复了1个月的黄芩玻璃化苗中活性成分的含量及其生物活性进行研究。为黄芩组织培养快速繁殖体系的建立提供理论依据和技术支持。
1 材料和方法
1.1 实验材料
将2个月的黄芩实生苗茎段于75%酒精溶液中杀菌30 s,然后用无菌水清洗3遍,再用4%的NaClO消毒2 min,无菌水清洗3~5遍,用无菌的干燥滤纸吸干其表面的水分,剪成1 cm左右的茎段,接种于MS+6-BA 1.5 mg·L-1+NAA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂7 g·L-1固体培养基中,25 d后,将愈伤组织转入分化培养基MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂7 g·L-1中,待再生芽长到1 cm左右时转到继代增殖培养基MS+6-BA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂7 g·L-1中进行继代增殖培养,1个月后将获得的玻璃化苗和正常的组培苗用于后续实验。
1.2 研究方法
1.2.1 AgNO3对黄芩玻璃化苗的逆转作用
将黄芩的玻璃化苗接种到MS+6-BA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂7 g·L-1+AgNO3(不同浓度)的培养基中,AgNO3的浓度为0,2,4,6,8,10 mg·L-1,每个浓度设6个平行,每瓶接种10棵,30 d后统计黄芩玻璃化苗的逆转率。
1.2.2 黄芩苷含量的测定
采用高效液相色谱(HPLC)法对黄芩苷的含量进行定量检测[9]。称取新鲜的植物样品0.2 g在液氮中研磨成粉。以60%的乙醇溶液(10 mL)为提取溶剂,采用超声处理法(30 min,60℃)提取黄芩苷。重复3次,合并滤液并离心(10 000 r·min-1,15 min),取上清液浓缩、过滤后,上机检测。
测定方法:使用的HPLC系统由Waters1525高效液相色谱仪、Waters2478检测器和Waters SunFire C18色谱柱(250 nm×4.6 mm,5 μm)组成。流动相为甲醇∶水(含0.2%的磷酸溶液)=35∶65(V∶V),流速为1 mL·min-1,柱温30℃,检测波长280 nm,进样量20 μL。测得黄芩苷的标准曲线方程为Y=2.134X+3.15(R2=0.990 7),借助标准曲线方程计算样品中黄芩苷的含量。
1.2.3 黄芩提取物的抗氧化活性检测
采用DPPH自由基清除法[10]检测黄芩提取物的抗氧化能力。10 mg DPPH溶解于100 mL甲醇中,得0.1 mg·mL-1的DPPH贮备液。向盛有1 mL样品提取液(制备方法同1.2.2)的各离心管中加入2 mL DPPH溶液,混匀后立即用比色皿在517 nm处测定吸光值Ai。室温避光保存30 min后再次测定吸光值,记为Aj。对照组吸光值记为Ac,每个实验组设3个平行。
DPPH自由基的清除率的公式:
清除率=[1-(Ai-Aj)/Ac]×100%
(1)
抗坏血酸标准品的配制:200 mg的抗坏血酸溶于20 mL甲醇,得10 mg·mL-1抗坏血酸溶液,再将其依次稀释为1.25,0.625,0.312 5,0.156 25,0.078 125 mg·mL-1,制备标准曲线。试验测得标准曲线方程为Y=40.414X+44.913(R2=0.995 4),借助标准曲线方程可计算IC50值。
1.2.4 黄芩提取物的体外抑菌试验
细菌的活化:挑取3~5株大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(B.subtilis)、鲍曼不动杆菌(A.Bauman)分别接种到含5 mL LB培养基的试管中,震荡培养24 h。将活化的菌液倒入盛有20 mL LB培养液的玻璃瓶中,再震荡培养4~7 h,将菌液浓度调整为1×106CFU·mL-1左右。
药品的制备:称取2 g干燥的植物样品研磨成粉,加入70%的乙醇溶液100 mL超声提取1 h,重复提取3次,离心后合并上清液,将上清液蒸干得到黄芩活性物质。称取黄芩活性物质20 mg,用1 mL的超纯水溶解完全,得到20 mg·mL-1的抑菌液,以2倍稀释法梯度稀释抑菌液至20,10,5,2.5,1.25,0.625,0.312 5 mg·mL-1,用0.45 μm的滤膜过滤后备用。
1.2.4.1 抑菌圈直径的测定
采用打孔法[11]检测黄芩提取物的抑菌直径。分别取100 μL浓度为1×106CFU·mL-1的菌液均匀涂布于含LB固体培养基的平板表面,用灭菌打孔器在平板上均匀打出4个孔。在每个孔注入500 μg·mL-1黄芩提取液各100 μL,每个样品设3个重复,37℃培养24 h。以生理盐水为对照,测量抑菌圈的直径。
1.2.4.2 最小抑菌浓度(MIC)
用96孔板做最小抑菌浓度试验[12~13],每孔加入浓度为1×106CFU·mL-1的活化菌液100 μL,再分别加入浓度为20,10,5,2.5,1.25,0.625,0.312 5 mg·mL-1的样品提取液各100 μL,只加菌液的孔为对照孔,每个浓度重复3次。37℃条件下培养24 h,在600 nm处检测菌液OD值找到最小的抑菌浓度。
1.2.4.3 最小杀菌浓度(MBC)
用接种环分别蘸取1.2.4.2试验所得的菌液划平板,培养48 h,看是否有菌落出现,若无菌落出现则该浓度就是最小杀菌浓度。
1.2.5 黄芩提取物抗肿瘤活性的检测
采用MTT法[14~15]检测黄芩提取物的抗肿瘤活性。将0.8×105细胞/mL的宫颈癌(Hela)和肺腺癌(A549)细胞接种于96孔板,每孔100 μL,置于培养箱中培养16~18 h,加入100 μL黄芩提取物(提取方法如1.2.4),每个样品设3个浓度50、25、12.5 mg·mL-1,每个浓度设5个复孔。继续培养24 h,然后加入20 μL 5 mg·mL-1的MTT溶液,继续培养4 h,用移液枪吸去所有的培养液,并向每孔中加入150 μL DMSO,振摇10 min,用酶标仪在OD=490 nm处测每孔的吸光值,记为A。调零孔与对照孔的吸光值,分别记为A0和A对照。收集数据并计算黄芩提取物对肿瘤细胞的清除率。
清除率=1-(A-A0)/A对照×100%
(2)
1.2.6 数据的分析
实验数据采用SPSS 22.0进行数据统计分析,多重比较采用Duncan法。
2 结果与分析
2.1 AgNO3对组培玻璃化黄芩苗的恢复作用
由图1可知,AgNO3的浓度为4 mg·L-1时,玻璃化苗的逆转率最高为88%,且恢复苗的生长状态良好。AgNO3的浓度低于4 mg·L-1时,玻璃化苗的逆转率较低,玻璃化苗依然存在着玻璃化现象。而当AgNO3的浓度高于4 mg·L-1时,玻璃化苗在恢复的过程中出现了不同程度的枯萎,导致玻璃化苗的死亡率不断地升高,且随着AgNO3浓度的升高,玻璃化苗的枯萎程度不断加重。
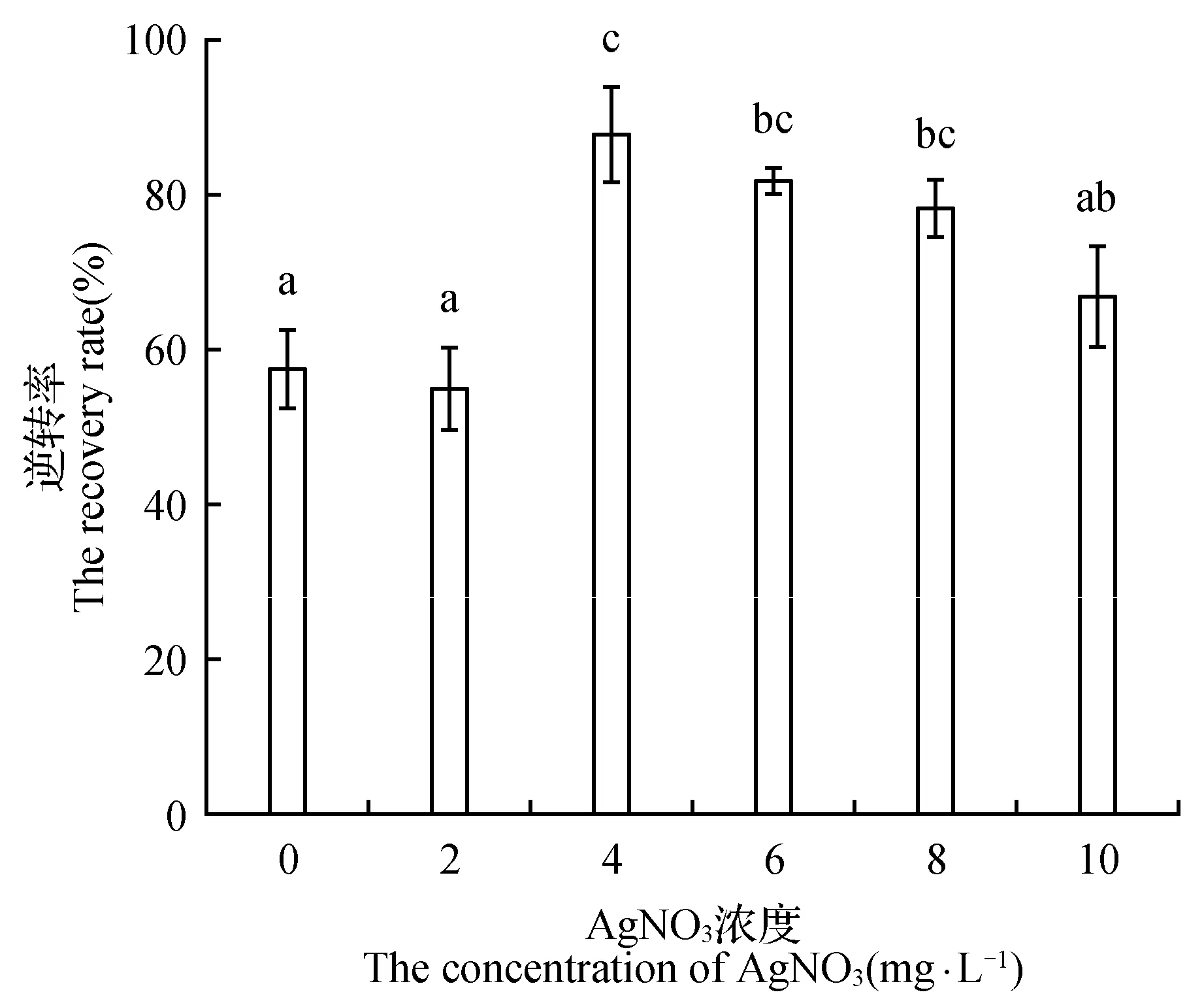
图1 AgNO3对黄芩玻璃化苗的逆转作用 图中相同小写字母表示在0.05水平上差异不显著,不同小写字母表示在0.05水平上差异显著,下同。Fig.1 The recovery efficiency of AgNO3 on S.baicalensis plantlets The same lowercase letter in the figure indicates that the difference is not significant at the 0.05 level,while different lowercase letters indicates that the difference is significant at the 0.05 level,the same as below.
2.2 黄芩苗体内黄芩苷含量的测定
黄芩苷是黄芩中最主要的次生代谢产物,其含量的高低直接决定黄芩的质量。根据黄芩苷的标准曲线方程计算可得(图2),玻璃化苗(HS)中黄芩苷的含量为38.32 mg·g-1,恢复苗(RS)中黄芩苷的含量为68.56 mg·g-1,正常组培苗(CS)中黄芩苷的含量为108.21 mg·g-1。恢复苗中黄芩苷的含量显著高于玻璃化苗,但却明显低于正常组培苗,仅为正常组培苗的60%多。

图2 黄芩苗中黄芩苷的含量Fig.2 The content of Baicalin in S.baicalensis plantlets
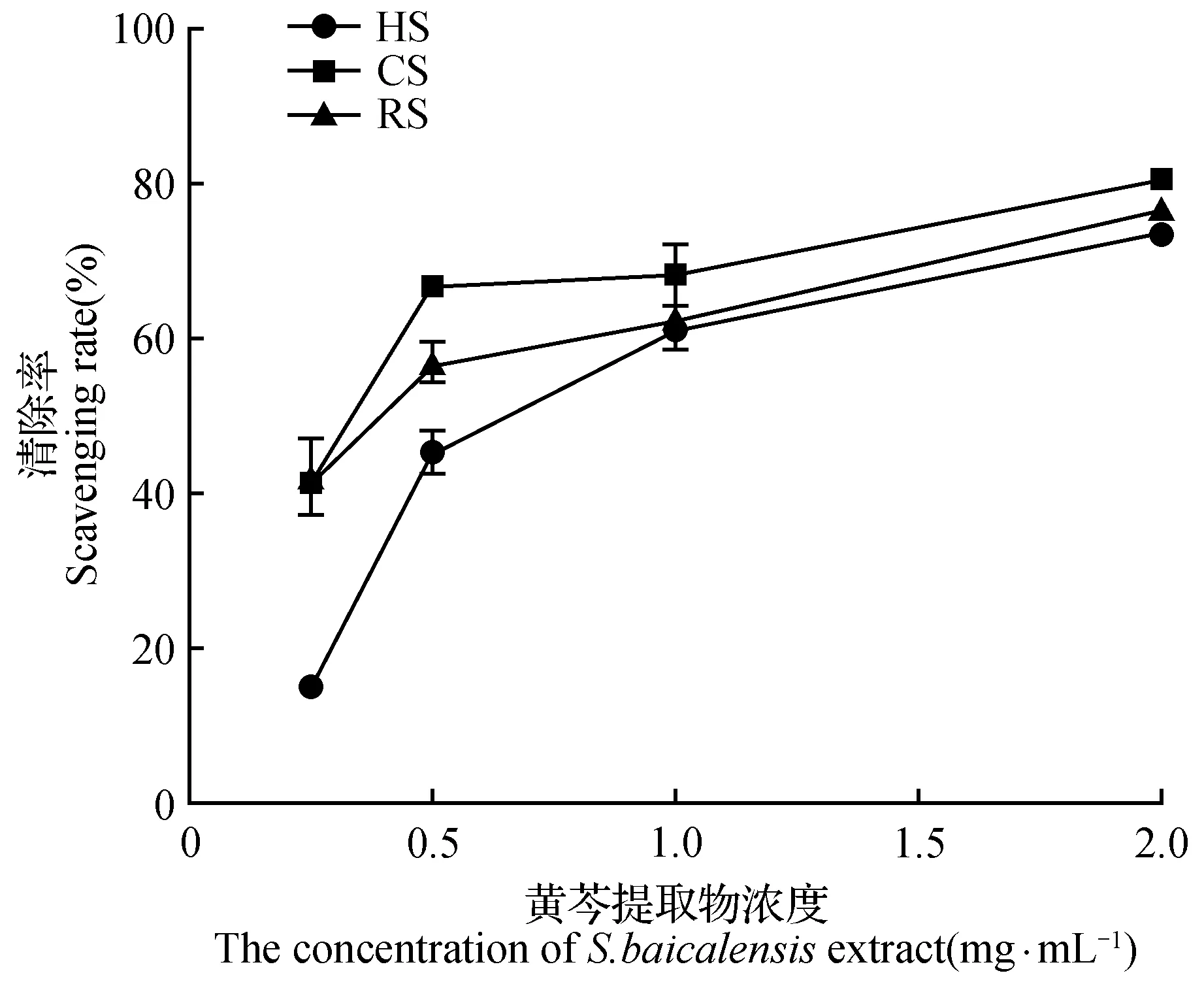
图3 黄芩提取物对DPPH自由基的清除率Fig.3 Scavenging rate of S.baicalensis extract on DPPH free radical
2.3 黄芩苗提取物的抗氧化活性评价
人体内自由基含量过高可引发多种疾病,如动脉粥样化、神经变性、慢性抑郁症、癌症和生理学衰老等。因此,研究黄芩体内活性成分对自由基的清除作用对于评价黄芩质量的好坏具有一定的指导意义。由图3可知随着样品浓度的增加,其对DPPH自由基的清除率也在逐渐增加。由图3可知恢复苗(RS)的IC50值为0.22 mg·mL-1,稍高于正常组培苗(CS)0.17 mg·mL-1,但显著低于玻璃化苗(HS)1.27 mg·mL-1,仅为玻璃化苗的1/6。
2.4 黄芩提取物的体外抑菌试验
由表1可知,黄芩提取物对金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)、鲍曼不动杆菌(A.Bauman)和枯草芽孢杆菌(B.subtilis)均具有良好的抑制效果。正常组培苗(CS)对各种细菌的抑制效果最佳,抑菌圈的直径最大,其次是恢复苗(RS),抑菌效果最差的是玻璃化苗(HS)。由表2可知,黄芩提取物对革兰式阳性菌(S.aureus和E.coli)的抑制效果优于革兰式阴性菌(A.Bauman和B.subtilis),尤其是对S.aureus的抑制效果最佳。黄芩提取物对革兰式阳性菌的MIC及MBC值较低,均小于10 mg·mL-1,而对革兰式阴性菌特别是A.Bauman的MBC值则高于20 mg·mL-1。
表1 黄芩提取物对细菌的抑制作用
Table 1 Inhibitory effect ofS.baicalensisextract on bacteria
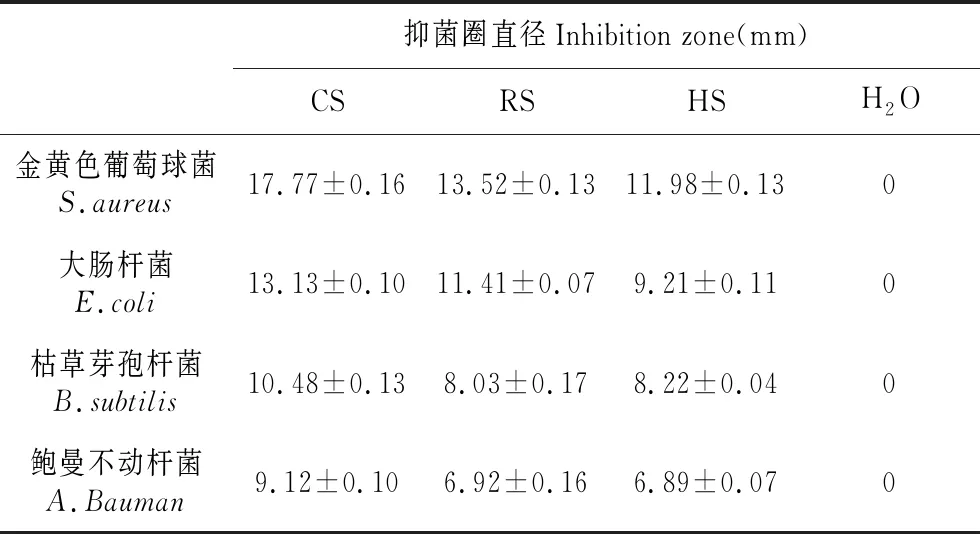
抑菌圈直径Inhibition zone(mm)CSRSHSH2O金黄色葡萄球菌S.aureus17.77±0.1613.52±0.1311.98±0.130大肠杆菌E.coli13.13±0.1011.41±0.079.21±0.110枯草芽孢杆菌B.subtilis10.48±0.138.03±0.178.22±0.040鲍曼不动杆菌A.Bauman9.12±0.106.92±0.166.89±0.070
表2 黄芩提取物的最小抑菌浓度(MIC)及最低杀菌浓度(MBC)
Table 2 Minimum inhibitory concentration(MIC) and minimum bactericidal concentration(MBC) ofS.baicalensisextract
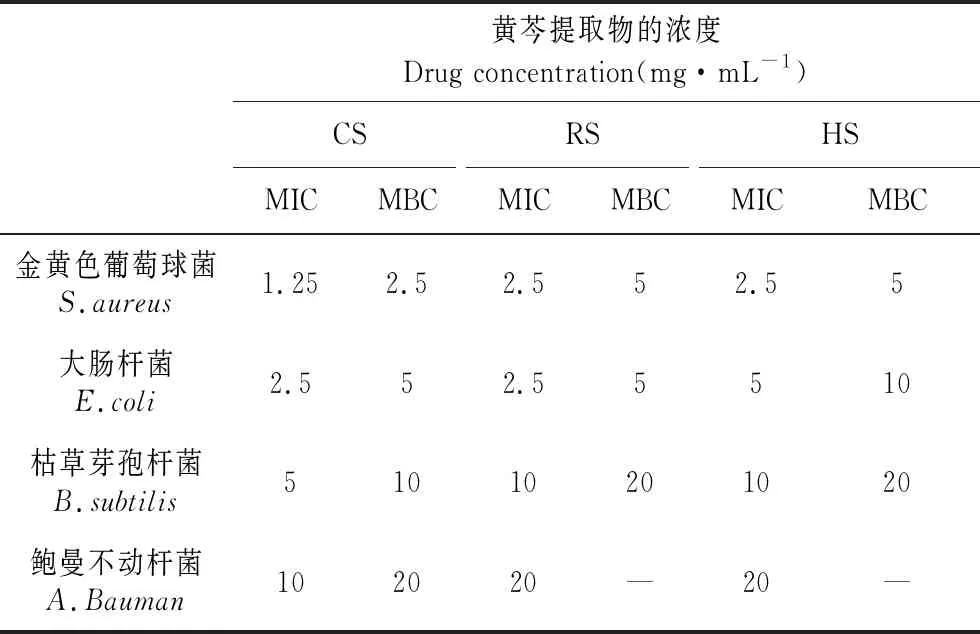
黄芩提取物的浓度Drug concentration(mg·mL-1)CSRSHSMICMBCMICMBCMICMBC金黄色葡萄球菌S.aureus1.252.52.552.55大肠杆菌E.coli2.552.55510枯草芽孢杆菌B.subtilis51010201020鲍曼不动杆菌A.Bauman102020—20—
2.5 黄芩提取物的抗肿瘤活性试验
由图4可知,黄芩提取物对A549肺癌细胞和Hela宫颈癌细胞具有良好的杀伤作用。相同浓度下正常组培苗(CS)提取液对两种肿瘤细胞的杀伤率最大,其次是恢复苗(RS),杀伤率最低的是玻璃化苗(HS)。且随着黄芩提取物浓度的增加,各样品对A549肺癌细胞和Hela宫颈癌细胞的杀伤率也显著升高。

图4 黄芩提取物对A549肺癌细胞和Hela宫颈癌细胞的杀伤作用Fig.4 The killing effect of S.baicalensis extract on A549 cells and Hela cells
3 讨论
研究表明,AgNO3能控制和逆转组培苗的玻璃化现象。Gao等[8]研究了AgNO3对玻璃化石竹的逆转作用及其逆转机制,其研究结果指出在培养基中添加浓度为5 mg·L-1的AgNO3对玻璃化石竹的逆转作用最强,而且提出AgNO3对玻璃化石竹的逆转机制是通过争夺乙烯的作用位点抑制乙烯的生成,使植物体内活性氧含量降低,从而减轻或逆转组培植物的玻璃化现象。本研究同样证明了AgNO3对玻璃化黄芩苗具有逆转作用,且其逆转作用受AgNO3浓度的影响,AgNO3浓度为4 mg·L-1时,玻璃化苗的逆转率最高为88%,且恢复苗的生长状态良好。AgNO3的浓度低于4 mg·L-1时,玻璃化苗的逆转率较低,玻璃化苗依然存在着玻璃化现象。而当AgNO3的浓度高于4 mg·L-1时,玻璃化苗在恢复的过程中出现了不同程度的枯萎,且随着AgNO3浓度的升高,玻璃化苗的枯萎程度不断加重。这可能是因为AgNO3浓度过高时,Ag+可竞争性地进入叶绿素分子内,改变其结构,使其功能丧失,蛋白质的合成受到抑制,从而对植物细胞的生长代谢产生胁迫或毒害作用[16~17]。
黄芩苷是黄芩中最主要的活性物质,其含量的高低直接决定黄芩的质量。本研究结果表明,恢复苗中黄芩苷的含量明显高于玻璃化苗,却明显低于正常苗。此外,黄芩提取物的抗氧化、抗菌、抗肿瘤实验结果也证明恢复苗的生物活性相比于玻璃化苗有了显著地提高,却仍低于正常苗。黄芩苗中黄芩苷的积累主要受光合作用和可溶性蛋白含量的影响[18~19]。一方面,玻璃化苗中叶绿素的含量较低,植株的光合作用较弱,黄芩苷的合成量较少。另一方面,玻璃化苗体内可溶性蛋白含量较低[20],也限制了黄芩苗中黄芩苷的积累。
综上所述,AgNO3对组培玻璃化黄芩苗具有良好的抑制及逆转作用,且恢复苗中活性物质及生物活性较玻璃苗有了显著地提升,但相比于正常组培苗还有一定的差距。由此我们推测恢复苗体内活性成分含量恢复到正常水平所用时间比其表观形态恢复所用时间更长。因此今后的研究我们要对AgNO3逆转的黄芩玻璃化苗体内生物活性成分含量和活性的恢复需要时间进行研究,为黄芩的组织培养快速繁殖技术提供基础数据和理论依据。
4 结论
AgNO3对黄芩组培苗的玻璃化现象具有良好的抑制和逆转作用,且最适浓度为4 mg·L-1。在组织培养基中添加AgNO3处理30 d后,恢复苗的表面形态恢复正常,其体内重要的次生代谢产物黄芩苷的积累量和提取物的生物活性和玻璃化苗相比均有显著的提升,但仍低于正常的组培苗。这说明经AgNO3逆转的黄芩玻璃化苗体内活性成分的含量和活性的恢复比形态的恢复需要更长的时间。
