转基因PnDof30拟南芥非生物胁迫下的抗性分析
2020-06-08张雨晴曲春浦刘关君杨天天杨成君
张雨晴 刘 野 曲春浦 刘关君 杨天天 杨成君*
(1.东北林业大学林学院,哈尔滨 150040; 2.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040; 3.东北林业大学野生动物与自然保护地学院,哈尔滨 150040)
在植物生长和发育的过程中,植物响应各种环境、组织和发育信号,这就需要精准调节的各种功能基因的表达。转录因子—反式作用因子是DNA结合蛋白。典型的转录因子由DNA结合区、转录调节区(包括激活区或抑制区)、寡聚化位点和核定位信号区组成。转录调控农业生产,植物转录因子的典型DNA结合区有bZIP结构域[1]、锌指结构域[2]、MADS结构域[3]、MYC结构域[4]、MYB结构域[5]、Homeo结构域以及AP2/EREBP结构域[6]等。
转录因子已被证明是响应胁迫应答基因表达的关键调节因子,如DREB、WRKY、NAC、bZIP和Dof。其中Dof蛋白是大型植物特异性转录因子家族[7]。目前已知Dof转录因子大多数是家族基因形式,例如拟南芥基因组中有37个Dof基因[8],水稻基因组中有30个[9],大麦中有26个[10],大豆中有28个[11],毛果杨中有44个[12]等。Dof转录因子家族成员的功能多样,Corrales等在拟南芥中鉴定出一组Dof基因CDFs,在非生物胁迫响应中具有重要作用[13]。并且当植物受到盐胁迫时,一些差异基因的表达会受到特定转录因子(如Dof)的调控,改变这些转录因子的表达可以增加植物耐盐性[14]。其中Dof1也参与多种生物过程,如叶片特异性基因表达[15]、丙酮酸激酶(PK)和磷酸烯醇丙酮酸羧化酶(PEPC)活性[16]、光敏色素和细胞色素信号传导[17]、激素反应[18]、种子成熟和萌发[19]、气孔二氧化碳(CO2)吸收[20]、光周期开花[21]、硫代葡萄糖苷的生物合成[22]和光合作用和铵同化的效率[23]。此外,Dof基因参与其他转录因子如bZIP、MYB和WRKY的相互作用,表明它们参与植物生理过程的调控。
在植物生长过程中,会受到各种非生物胁迫,包括高盐、干旱、低温等,他们自身的生长和活力将受到严重威胁。当植物受到这些条件胁迫时,将会激活调控途径以响应植物体内该胁迫,使植物能抵抗该胁迫从而生存下去。为了探究小黑杨中的Dof30基因在胁迫条件下是如何响应不同胁迫信号的。本研究以转基因PnDof30拟南芥和野生型WT拟南芥为材料,对其种子和幼苗进行了干旱,盐和渗透胁迫的处理,并将两种材料的生长生理指标的变化和胁迫后的拟南芥中PnDof30的相对表达量进行比较,研究表明Dof转录因子家族参与植物发育的多种生理途径,并为Dof在非生物胁迫耐受性方面提供重要理论依据。
1 材料与方法
1.1 试验材料
拟南芥生态型Col0来源于东北林业大学林学院森林植物资源学种质资源保存库。转基因PnDof30(MK789595)拟南芥表达株系L2由东北林业大学林木遗传育种国家重点实验室克隆小黑杨PnDof30基因并转化至拟南芥生态型Col0中所得[24]。
1.2 试验方法
1.2.1 非生物胁迫下转基因PnDof30拟南芥的萌发能力分析
用75%乙醇对转基因PnDof30拟南芥种子和野生型拟南芥种子进行表面消毒后,分别点在1/2MS和含有100、150 mmol·L-1NaCl和200、250 mmol·L-1Mannitol的1/2MS培养基平板上,在培养室中生长至第3天开始调查发芽势,14 d后观察长势并计算萌发率。
1.2.2 非生物胁迫下转基因PnDof30拟南芥幼苗期的抗逆能力分析
拟南芥种子消毒后点在1/2MS培养基平板上培养3 d后,将萌发的种子转移到1/2MS和含有100、150 mmol·L-1NaCl和200、250 mmol·L-1Mannitol的培养基平板上,在培养室中竖直培养10 d后,分别从每个处理中取长势一致的幼苗各5株,用分析天平(0.001 g)测得总重量后,再计算每株幼苗的平均重量,即鲜重;同时,用游标卡尺测出其根长后求取平均值。
1.2.3 转基因PnDof30拟南芥胁迫灌根处理
待拟南芥生长4周后分别进行干旱、盐(100、150 mmol·L-1NaCl)、渗透(150、200 mmol·L-1甘露醇)处理,处理6 d,未做胁迫处理的苗作为对照。其中对照不做处理,每2 d浇水1次,每次500 mL;干旱处理方法为自然干旱法且时间为6 d;盐处理方法则在每个大育苗盆里分别浇500 mL浓度为100、150 mmol·L-1NaCl,每隔1 d浇1次,处理6 d;渗透处理方法为在每个大育苗盆里分别浇500 mL浓度为150、200 mmol·L-1甘露醇,处理方法与时间同上;处理后调查表型,第7天上午用液氮收样,放入-80℃冰箱中,用于后续生理指标测定。
1.2.4 转基因PnDof30拟南芥胁迫处理后的生理表型和酶活测定
胁迫处理6 d后的拟南芥植株,观察其表型,测定叶绿素含量,并利用试剂盒测定MDA、SOD、POD、脯氨酸等生理生化指标[25]。
1.2.5 实时荧光定量分析胁迫后的转基因PnDof30拟南芥中PnDof30基因的表达量
利用总RNA提取试剂盒pBIOZOL提取总RNA,之后利用TaKaRa公司提供的cDNA反转录试剂盒和康为世纪生物技术有限公司提供的qRT-PCR试剂盒进行反转录和实时荧光定量PCR反应,其中PnDof30基因的上游引物5′-TACTTTCGCAACCACAGC-3′,下游引物5′-AAGTGCCACCTCTTGTCC-3′,内参基因Ubiquitin的上游引物5′-TCACTGGAAAGACCATTACTCTTGAA-3′,下游引物5′-AGCTGTTTTCCAGCGAAGATG-3′,反应体系均按照说明书提供加样。实时荧光定量为相对定量,其计算方法是根据每个反应得到的相应CT值,采用2-△△CT法进行数据分析。
2 结果与分析
2.1 非生物胁迫下转基因PnDof30拟南芥的萌发能力分析
用75%乙醇对转基因PnDof30拟南芥(L2)和野生型拟南芥(WT)种子进行表面消毒,分别点在1/2MS和含有100、150 mmol·L-1NaCl和200、250 mmol·L-1Mannitol的培养基平板上,在培养室中生长14 d后计算各株系在不同胁迫下的萌发率(如图1所示)。在正常条件下,WT和L2的种子萌发率接近100%,且无显著差异;胁迫条件下无论WT和L2的萌发率均有降低。其中100 mmol·L-1NaCl胁迫WT种子萌发率为83%、L2萌发率为95%,显著高于WT;150 mmol·L-1NaCl WT的种子萌发率为43%、L2为48%,无显著差异,且种子萌发时间较正常条件晚3~4 d。而200 mmol·L-1Mannitol胁迫的WT种子萌发率为82%、L2为94%,显著高于WT;250 mmol·L-1Mannitol WT的种子萌发率为93%、L2为98%,无显著差异,种子萌发时间较正常条件晚5 d左右。250 mmol·L-1Mannitol胁迫条件下L2的种子萌发率高于200 mmol·L-1Mannitol,并且与正常条件下培养的种子萌发率相差不大。

图1 非生物胁迫下转基因PnDof30拟南芥的萌发率Fig.1 Germination rate of transgenic PnDof30 Arabidopsis under abiotic stress
2.2 非生物胁迫下转基因PnDof30拟南芥幼苗期的抗逆能力分析
用75%乙醇对转基因PnDof30拟南芥(L2)和野生型拟南芥(WT)种子进行表面消毒,点在1/2MS的培养基平板上生长31d后,将萌发的幼苗转移至1/2MS和分别含有100、150 mmol·L-1NaCl和200、250 mmol·L-1Mannitol的培养基平板上,在培养室中竖直生长10 d后观察长势并统计根长(如图2所示)。结果表明:正常生长条件下的过表达株系L2的根长略长于WT,植株叶片为绿色;盐胁迫条件下,WT根长明显降低,L2根长虽较少但长于WT,尤其是150 mmol·L-1NaCl根长几乎不可见,且植株叶片发白矮小;渗透胁迫条件下,WT和L2的根长均有降低,但明显长于盐胁迫条件,且植株根系发达,侧根增多,叶片为绿色。
进一步对转基因株系在各胁迫条件下的根长和鲜重进行测量(如图3所示),在正常生长条件下,过表达株系L2的根长是WT的1.3倍;在非生物胁迫下WT和L2的根长均有降低。在盐胁迫条件下,100 mmol·L-1NaCl L2的根长是WT的1.3倍;150 mmol·L-1NaCl L2是WT的1.6倍。在渗透胁迫条件下,200 mmol·L-1Mannitol L2的根长是WT的1.3倍;250 mmol·L-1Mannitol L2是WT的1.2倍。如图4所示,正常生长条件下,过表达株系L2的鲜重是WT的1.3倍;在非生物胁迫下WT和L2的鲜重均有降低。在盐胁迫条件下,100 mmol·L-1NaCl L2的鲜重是WT的1.3倍;150 mmol·L-1NaCl L2是WT的1.1倍。在渗透胁迫条件下,200 mmol·L-1Mannitol L2的鲜重是WT的1.1倍;250 mmol·L-1Mannitol L2是WT的1.2倍。
2.3 非生物胁迫下转基因PnDof30拟南芥莲座期的表型
对生长1个月左右的转基因和野生型拟南芥分别进行干旱、盐(100、150 mmol·L-1NaCl)、渗透(150、 200 mmol·L-1甘露醇)3种胁迫处理,处理6 d,未做胁迫处理的苗(水)作为对照,观察植株变化(如图5所示)。结果表明:在正常生长条件下,过表达株系L2与WT的外部形态、莲座叶直径和叶片数基本一致;在干旱、盐、渗透胁迫条件下,过表达株系L2叶片有不同程度的卷曲,叶尖略有萎黄,而野生型拟南芥叶片有明显萎缩、叶片枯黄部分变白现象。L2的莲座叶直径和叶片数也显著高于野生型(如图6所示)。3种胁迫处理后,过表达株系L2形态都明显好于野生型,叶片更绿,生长状态更加良好。

图2 非生物胁迫下转基因PnDof30拟南芥幼苗的根长情况Fig.2 Root length of transgenic PnDof30 Arabidopsis seedlings under abiotic stress

图3 非生物胁迫下转基因PnDof30拟南芥幼苗的根长Fig.3 Root growth of transgenic PnDof30 Arabidopsis seedlings under abiotic stress
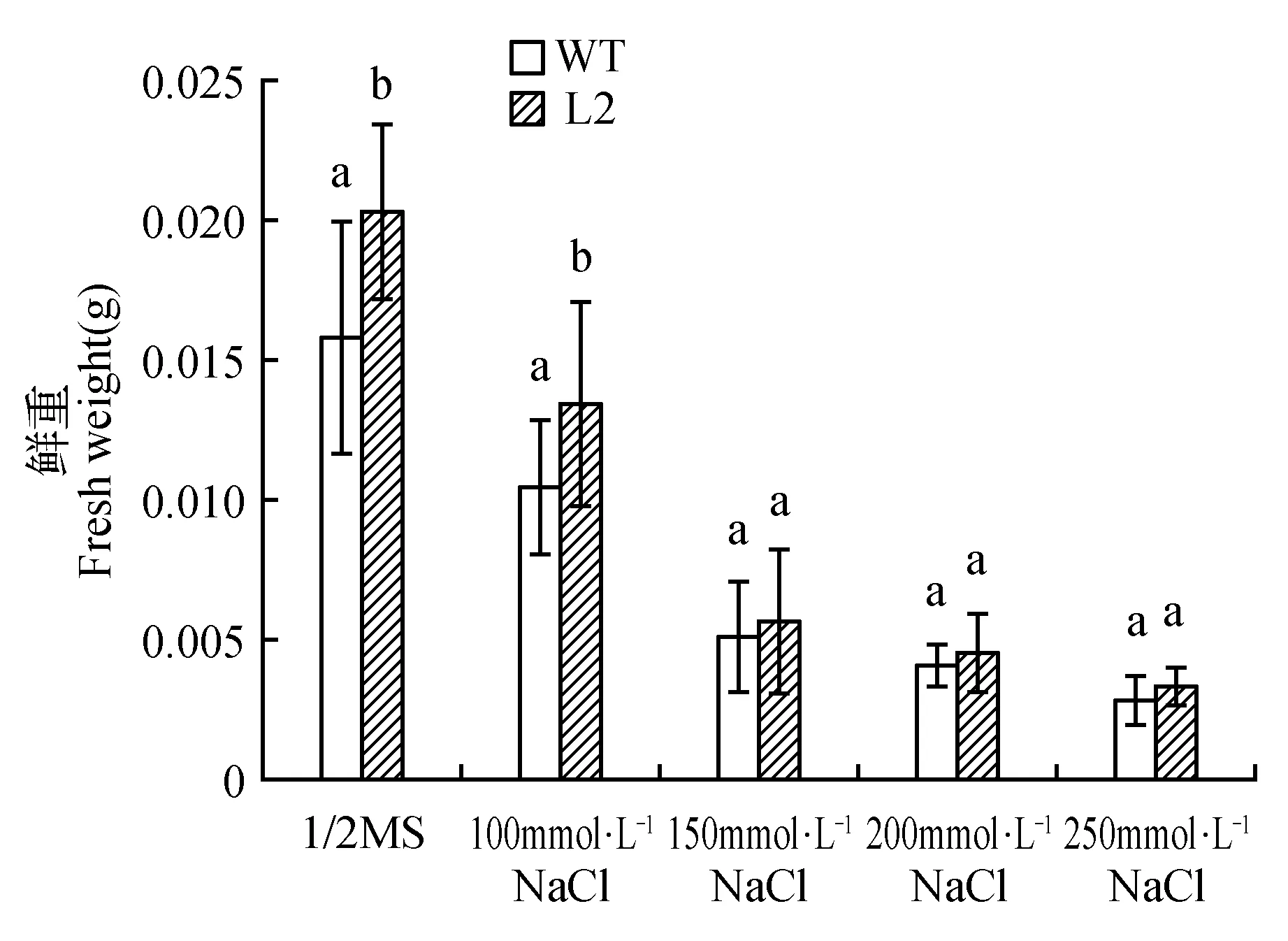
图4 非生物胁迫下转基因PnDof30拟南芥幼苗的鲜重Fig.4 Fresh weight of transgenic PnDof30 Arabidopsis seedlings under abiotic stress

图5 非生物胁迫6 d后的转基因PnDof30拟南芥 A.对照条件(水)表型;B.干旱表型;C~D.100、150 mmol·L-1 NaCl表型;E~F.200、250 mmol·L-1 Mannitol表型Fig.5 Transgenic PnDof30 Arabidopsis after 6 d of abiotic stress A. Control condition phenotype; B. drought phenotype; Cand D. 100,150 mmol·L-1 NaCl phenotype; E-F. 200,250 mmol·L-1 mannitol phenotype
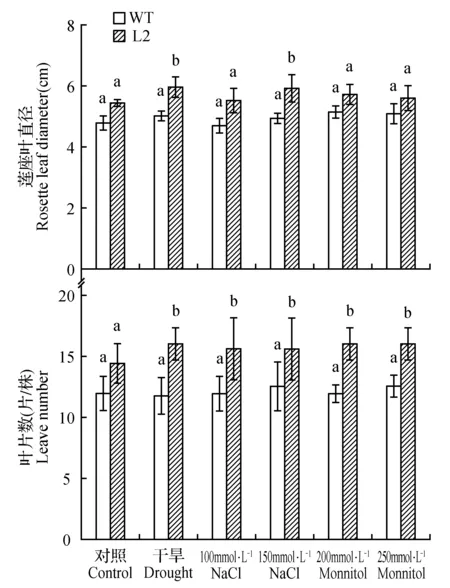
图6 非生物胁迫6天后转基因PnDof30拟南芥的莲座叶直径、叶片数Fig.6 Rosette leaf diameter and leave number of transgenic PnDof30 Arabidopsis after 6 d of abiotic stress
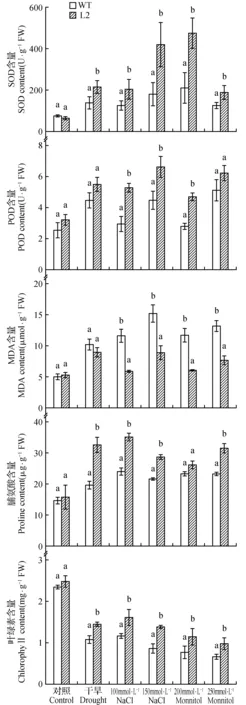
图7 非生物胁迫6天转基因PnDof30拟南芥的SOD、POD、MDA、脯氨酸、叶绿素Fig.7 SOD,POD,MDA,proline and chlorophyll of transgenic PnDof30 Arabidopsis after 6 d of abiotic stress

图8 不同胁迫处理后PnDof30基因的表达Fig.8 Expression of PnDof30 gene after different stress treatments
2.4 非生物胁迫下转基因PnDof30拟南芥成苗的生理生化指标分析
对处理6 d后的过表达和野生型拟南芥株系,取各株的叶片分别测定叶绿素、SOD、POD、MDA、脯氨酸等指标进行分析(每个处理每个株系3次生物学重复)(详见图7)。由图7可知:在正常生长条件下,WT与过表达株系L2的SOD活性基本相同;在干旱胁迫条件下,L2的SOD活性是WT的1.6倍;在盐胁迫条件下,100 mmol·L-1NaCl L2的SOD活性是WT的1.6倍,150 mmol·L-1NaCl L2是WT的2.4倍;在渗透胁迫条件下,200 mmol·L-1Mannitol L2的SOD活性是WT的2.3倍,250 mmol·L-1Mannitol L2是WT的1.5倍。转化株系在3种胁迫5个处理条件下SOD活性都有增加且显著高于WT,特别是在150 mmol·L-1NaCl和200 mmol·L-1Mannitol处理时。由POD的数据结果可知:正常生长条件下,WT与过表达株系L2的POD活性基本相同;在干旱胁迫条件下,L2的POD活性是WT的1.2倍;在盐胁迫条件下,100 mmol·L-1NaCl L2的POD活性是WT的1.8倍,150 mmol·L-1NaCl L2是WT的1.5倍;在渗透胁迫条件下,200 mmol·L-1Mannitol L2的POD活性是WT的1.7倍,250 mmol·L-1Mannitol L2是WT的1.2倍。转化株系在3种胁迫下POD活性都有增加且略高于WT。图中MDA结果表明正常生长条件下,WT与过表达株系L2的MDA含量基本相同;在干旱胁迫条件下,WT的MDA含量是L2的1.2倍;在盐胁迫条件下,100 mmol·L-1NaCl WT的MDA含量是L2的2倍,150 mmol·L-1NaCl WT是L2的1.7倍;在渗透胁迫条件下,200 mmol·L-1Mannitol WT的MDA含量是L2的1.9倍,250 mmol·L-1Mannitol WT是L2的1.7倍。脯氨酸结果由图7可知:正常生长条件下,WT与过表达株系L2的脯氨酸含量基本相同;在干旱胁迫条件下,L2的脯氨酸含量是WT的1.7倍;在盐胁迫条件下,100 mmol·L-1NaCl脯氨酸含量最高,150 mmol·L-1NaCl时脯氨酸含量下降;在渗透胁迫条件下,200 mmol·L-1Mannitol L2的脯氨酸含量是WT的1.1倍,250 mmol·L-1Mannitol L2是WT的1.3倍,转化株系在3种胁迫下脯氨酸活性都有增加且略高于WT。叶绿素的含量与植物的光合速率相关。由此可知:正常生长条件下,WT与过表达株系L2的叶绿素含量基本相同;在干旱、100 mmol·L-1NaCl、150 mmol·L-1NaCl、200 mmol·L-1Mannitol、250 mmol·L-1Mannitol胁迫条件下,WT和L2的叶绿素含量显著降低说明植株受到了伤害,但是L2的降低幅度明显小于WT并且叶绿素含量可达WT的1.6倍。
2.5 不同胁迫处理后转基因PnDof30拟南芥中PnDof30基因的相对表达分析
对生长4周的转基因拟南芥分别进行干旱、盐(100、150 mmol·L-1NaCl)、渗透(150、200 mmol·L-1甘露醇)3种胁迫处理,处理6 d后提取总RNA反转录成cDNA作为荧光定量PCR的模板。利用RT-PCR技术分析在各胁迫处理后PnDof30基因的表达量(如图8所示)。结果表明:和对照(水)相比,3种胁迫处理后PnDof30基因表达量均显著上调。其中,干旱胁迫下表达量是对照条件的4.6倍;盐胁迫下,100 mmol·L-1NaCl的表达量是8.2倍,150 mmol·L-1NaCl表达量最高是对照的13.2倍;渗透胁迫下,200 mmol·L-1Mannitol的表达量是6.2倍,250 mmol·L-1Mannitol可达7.8倍。此外,不同的胁迫处理后PnDof30基因表达量不同,盐胁迫较其他胁迫处理后的表达量更高,150 mmol·L-1NaCl时表达量最高,说明PnDof30基因在抗盐胁迫时能力更强。
3 讨论
不利于植物生长和发育的各种环境因素统称为逆境,逆境对作物生长有很大影响,是限制作物生产的重要因素。Dof转录因子是植物中独特的转录因子,在高等植物中,Dof家族转录因子也参与植物对胁迫的反应[26]。
为了探究PnDof30基因的抗逆功能,我们分别用NaCl、Mannitol对过表达株系L2和WT拟南芥幼苗;干旱、NaCl、Mannitol对拟南芥成苗进行胁迫处理,并统计种子萌发率、根长、鲜重及成苗生长状态和理化指标。结果显示:幼苗在正常生长时种子萌发率相差不大,L2的根长和鲜重显著高于WT;在胁迫处理后,WT和L2的萌发率、根长和鲜重都有下降,但是L2的下降幅度小于WT。观察胁迫处理后的成苗发现,L2的生长状态无明显变化,而WT叶片卷曲萎黄。这些现象说明转基因PnDof30拟南芥幼苗和成苗有一定的抗逆能力,从而说明PnDof30基因有一定的抗逆功能。
超氧化物歧化酶(SOD)通过催化超氧离子自由基的歧化反应清除自由基,抵御活性氧对细胞膜的损伤,从而提高植物的抗逆能力。转化株系在5种胁迫处理条件下SOD活性都有增加且显著高于WT,说明此时拟南芥株系受到胁迫的程度明显提高,各转化株系产生更多的SOD用以抵御胁迫保护细胞膜系统。由此说明,转基因株系可以通过在逆境中提高SOD活性来增强清除氧自由基的能力从而表现出抗逆能力。过氧化物酶(POD)是清除植物体内氧自由基伤害的重要酶。转化株系胁迫下POD活性都有增加且略高于WT,说明转基因株系可以通过增强POD活性来提高清除氧自由基的能力从而表现出抗逆能力。丙二醛(MDA)的含量可以反映植物在遇到逆境下的伤害程度。转化株系在胁迫下MDA含量都低于WT,说明其在逆境中受到的伤害小于WT。脯氨酸能防止质膜透性的变化,对质膜的完整性有保护作用。转化株系在胁迫下脯氨酸活性都有增加且略高于WT,说明转基因株系可以通过提高脯氨酸含量来保护植株质膜系统从而抵御胁迫伤害。在叶绿素含量的检测结果中,发现处理后L2的叶绿素含量有所降低,且降低趋势小于WT,说明转基因株系在逆境中受到的伤害小于WT,更能适应逆境环境。在3种胁迫处理后,PnDof30基因表达量相比于对照均有显著上调,说明PnDof30基因与抗逆胁迫应答相关。综上所述,转基因PnDof30拟南芥株系L2通过调节一些与植物抗逆相关的生理生化指标使植株具有抗逆功能,说明PnDof30基因具有抗干旱、盐和渗透等非生物胁迫的功能。
Dof转录因子家族是植物中特异发现的一大组因子[8]。以前的研究表明,Dof蛋白在发育和激素调节以及应激反应中都起着非常重要的作用[27]。在柽柳的研究结果中表明,Dof基因的转录受盐胁迫诱导,可能参与柽柳的耐盐应答[28]。Ma[27]等的试验中发现,大白菜中的Dof基因功能将有助于发展大白菜品种的特性,如耐盐和耐旱。在杨树的渗透胁迫中也有发现,PtrDof转录因子在植物中对渗透胁迫起着至关重要的作用[29]。当对苹果采取非生物胁迫处理后,MdDof基因表达立即增加,该结果也表明MdDof基因在植物适应非生物胁迫中的潜在积极作用,即参与着非生物胁迫的反应[30]。我们通过检测转基因拟南芥L2和WT在干旱、盐和渗透三种胁迫下的生理生化指标,探究PnDof30基因在抗逆方面的功能。实时荧光定量的结果显示,PnDof30基因对逆境有应答,逆境处理下的表达量都显著低于对照。过表达株系L2在幼苗期(2周左右)的种子萌发率、根长和鲜重均高于WT;在成苗期(1个月左右)的表型比WT更大更绿,SOD、POD和脯氨酸含量高于WT,MDA含量少于WT。因此,PnDof30基因在拟南芥对干旱、盐和渗透胁迫的抵御中可能起重要作用。
