ECR-1030M树脂固定化单宁酶
2020-06-06张帅程昊许子婷
张帅,程昊 *,许子婷
1. 肇庆学院食品与制药工程学院(肇庆 526061);2. 广西科技大学生物与化学工程学院(柳州 545006);3. 蔗糖产业省部共建协同创新中心(南宁 530004)
单宁酶(Tannase,EC 3.1.1.20)是一种主要由丝状真菌产生的诱导酶,可高效水解没食子酰单宁、鞣花单宁以及没食子酸烷基酯等化合物,因而在没食子酸生产、速溶茶除沉淀、果汁脱涩、单宁废水去污等方面有着广阔的应用前景[1-4]。然而,由于单宁酶生产成本较高,且使用率和稳定性较差,因而目前尚难以实现规模化应用[5-6]。采用有效的固定化技术制备固定化单宁酶,不仅可以将单宁酶多次循环使用从而降低单宁酶使用成本,而且还可以提高单宁酶的理化性质及生物稳定性[7-8],因而对于实现单宁酶的连续催化和工业应用具有重要意义。
目前,已报道的单宁酶固定化载体主要是壳聚糖和海藻酸钙/钠两种材料[7-14],另外如单宁微球[15]、微乳凝胶[16]、玉米芯[17]等仅有少量报道。这些固定化载体虽然有的具有较高的酶活回收率,但材料成本较高,难以实现规模化生产和工业化应用;有的材料虽然成本低廉,但固定化酶活力及使用效率较低,不具备产业化意义。树脂材料由于类型多、成本低且具有稳定的理化性质,已作为酶载体用于酶制剂的固定化研究[18],且很多已实现了商业化生产,如Novozym 435便是将南极假丝酵母B脂肪酶固定于大孔丙烯酸树脂上获得的固定化酶产品[19]。关于单宁酶的树脂固定化,目前仅王挥等[20]用一种LX-1000HA树脂对黑曲霉单宁酶进行了固定化研究,但其酶活回收率较低,仅为45.25%。
试验以价廉易得且宜用于酶固定化的树脂材料为载体,对米曲霉单宁酶进行固定化研究,筛选出适宜的固定化树脂并确定最优的固定化工艺条件,同时对树脂固定化单宁酶进行性能测定,旨在建立一条可望产业化的固定化单宁酶生产工艺,以期实现单宁酶的的工业化应用。
1 材料与方法
1.1 菌种与培养基
米曲霉(Aspergillus oryzae),肇庆学院食品微生物实验室4℃斜面保藏。
活化培养基:将PDA培养基粉末(广东环凯微生物科技有限公司)依说明书配好后分装试管,灭菌后做成PDA斜面若干,4℃冷藏备用。
发酵培养基:水50%,麸皮35%,蔗糖6%,单宁酸5.5%,硝酸铵3%,氯化锰0.3%,氯化钙0.2%,置于250 mL三角瓶,搅拌均匀。上述百分数均为质量百分比。
1.2 主要药品
单宁酸、戊二醛、没食子酸丙酯(PG)及其他常规药品均为国产分析纯;PG标准液配制:准确称取0.042 g PG,先以2滴无水乙醇溶解,再用100 mL水定容,现用现配;选用8种树脂(杭州创科生物科技有限公司)作为单宁酶固定化载体,各树脂特点见表1。
1.3 试验方法
1.3.1 菌种活化
无菌条件下,将米曲霉接种于PDA斜面培养基中,30℃培养72 h,即得活化菌种。

表1 树脂载体一览表
1.3.2 接种剂制备
配制0.85%生理盐水,分装若干25 mL含玻璃珠的三角瓶,10 mL/瓶。灭菌并冷却后,取一环活化菌种置于三角瓶中,封口,并以150 r/min振摇30 min,使菌体均匀分散在生理盐水中,即得接种剂。
1.3.3 单宁酶发酵
取1 mL接种剂,均匀喷洒于发酵培养基中,充分振荡三角瓶使菌体均匀散布于培养基中,30℃培养96 h,使米曲霉发酵产单宁酶。其间,分别于24和48 h时振荡培养基(翻曲)1 min。
1.3.4 单宁酶提取
发酵结束后,向三角瓶中加入100 mL蒸馏水,以150 r/min振荡30 min充分浸提单宁酶。然后将瓶中内容物倒入离心瓶中,以5 000 r/min离心15 min,取上清液,即为粗酶液。
1.3.5 粗酶液超滤浓缩
用切割分子量(MWCO)10 kDa的中空纤维膜对粗酶液进行超滤。超滤浓缩至粗酶液容积的1/4左右,可去除大部分没食子酸等小分子物质。
1.3.6 单宁酶活力测定
参考张帅等[21]的紫外分光光度法测定。对于固定化单宁酶活力的测定,用0.2 g固定化酶代替0.2 mL酶液,其他方法步骤不变。
1.3.7 固定化载体预处理
1) 阴离子交换型树脂(MI-BN4):①水振荡冲洗1 h;②2.5%盐酸溶液振荡冲洗2 h;③水洗至pH接近中性;④4% NaOH溶液振荡冲洗2 h;⑤水洗至pH接近中性;⑥用PBS缓冲液(0.1 mol/L,pH 7,下同)振荡平衡2 h;⑦过滤备用。
2) 阳离子交换型树脂(MI-150IDA):①水振荡冲洗1 h;②4% NaOH溶液振荡冲洗2 h;③水洗至pH接近中性;④5%盐酸溶液振荡冲洗2 h;⑤水洗至pH接近中性;⑥用PBS缓冲液振荡平衡2 h;⑦过滤备用。
3) 静电吸附和大孔吸附型树脂(MA-P9、MANP6、ECR-1030M、ECR-8806M):①乙醇振荡浸泡2 h;②过滤;③丙酮振荡浸泡2 h;④过滤;水振荡冲洗至无有机溶剂残留;⑥过滤备用。
4) 共价偶联型树脂(MC-150EP、ECR-4204M):①水振荡冲洗2 h;②用PBS缓冲液振荡平衡3次;③过滤备用。
1.3.8 单宁酶固定化方法
采用戊二醛交联法。将8种树脂浸于一定浓度的戊二醛水溶液中活化4 h,然后滤出树脂,与单宁酶按一定比例加入到PBS缓冲液中,室温下搅拌一定时间使单宁酶固定于树脂中。通过比较固定化单宁酶活力筛选出最佳固定化载体。
1.3.9 单宁酶固定化工艺优化
选取戊二醛浓度(X1)、固定化时间(X2)和料酶比(X3)三个因子进行混合水平均匀设计,因子水平如表2所示。
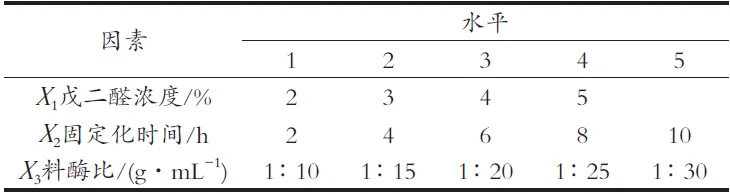
表2 均匀设计因子水平
1.3.10 酶活回收率的测定
在最优工艺条件下制备固定化单宁酶,然后参考韩春然等[15]的方法,按式(1)计算固定化单宁酶的酶活回收率。

式中:固定化酶总活力(U)=固定化酶活力(U/g)× 固定化酶质量(g);酶液总活力(U)=酶液活力(U/mL)×酶液体积(mL);残酶液活力(U)=滤出固定化酶后的酶液活力(U/mL)×残酶液体积(mL)。
1.3.11 固定化单宁酶的保藏稳定性
将固定化单宁酶在4℃下分别保藏0,5,10,15,20,25,30,35,40和45 d,然后进行酶活测定,考察固定化单宁酶活力随保藏时间的变化关系。
1.3.12 固定化单宁酶的循环使用次数
用0.2 g固定化单宁酶水解50 mL PG 标准液20 min,每次水解后将固定化单宁酶滤出、清洗并测定酶活力,然后再投入PG标准液中进行下一次水解,直至酶活力降至不低于初始酶活力的70%,以此考察固定化单宁酶的循环使用次数。
1.3.13 数据处理
各试验均平行3次,结果用“均值±标准偏差”表示。用SAS 9.4(SAS Institute Inc,Cary,NC,USA)软件进行数据拟合、模型构建以及回归分析。
2 结果与分析
2.1 最佳树脂载体的选择
由图1可看出,用ECR-1030M树脂制备的固定化单宁酶活力为1 465.8 U/g,明显高于用其他树脂材料制备的固定化单宁酶的活力,固定化效果非常理想。ECR-1030M树脂是二苯乙烯交联的甲基丙烯酸酯聚合物,为白色球状微粒,粒径为300~700 μm,孔径25 nm,比表面积>100 m2/g,理化性质稳定,机械稳定性良好,酶固载容量和固定化效率较高,适合固定米曲霉单宁酶。
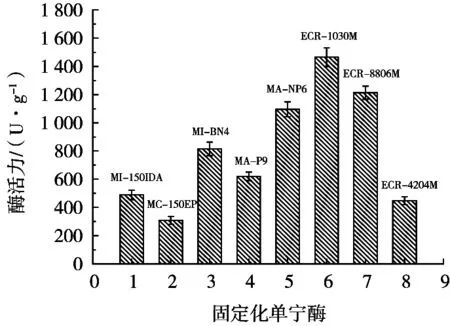
图1 不同树脂载体制备的固定化单宁酶活力
2.2 最优固定化工艺的确定
用DPS 9.0(浙江大学,杭州)构建最优U20(41×52)均匀设计表,试验次数20次,最大迭代次数1 000次,寻优时间5 min,运行时间18 s,中心化偏差CD= 0.124 7[22-23]。ECR-1030M树脂按此试验方案制备的固定化单宁酶的酶活力(Y)结果如表3所示。
由表3可看出,6号试验所得固定化单宁酶的活力最高,为1 470.5±26.3 U/g。为进一步寻优,用SAS 9.4对试验结果进行拟合[24],可得二阶回归模型:Y=961.958 46X1+226.304 96X2+66 733X3-103.140 00X12- 32.595 00X1X2-10.984 05X22-1 147.884 86X1X3+ 102.153 25X2X3-500 116X32-2 907.153 85。
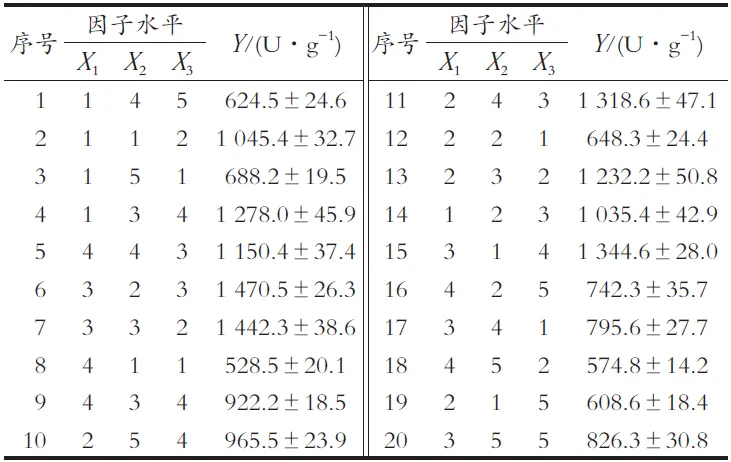
表3 均匀试验结果
参数估计及显著性分析如表4所示,模型方差分析如表5所示。
由表4可知,戊二醛浓度(X1)和料酶比(X3)分别对响应指标酶活力(Y)有显著(p<0.05)和极显著(p<0.01)影响,而固定化时间(X2)则对酶活力影响不显著(p>0.05)。由表5可知,二阶回归模型显著(p<0.05),说明该模型拟合良好,可以用该模型对ECR-1030M树脂固定单宁酶工艺进行分析和预测。
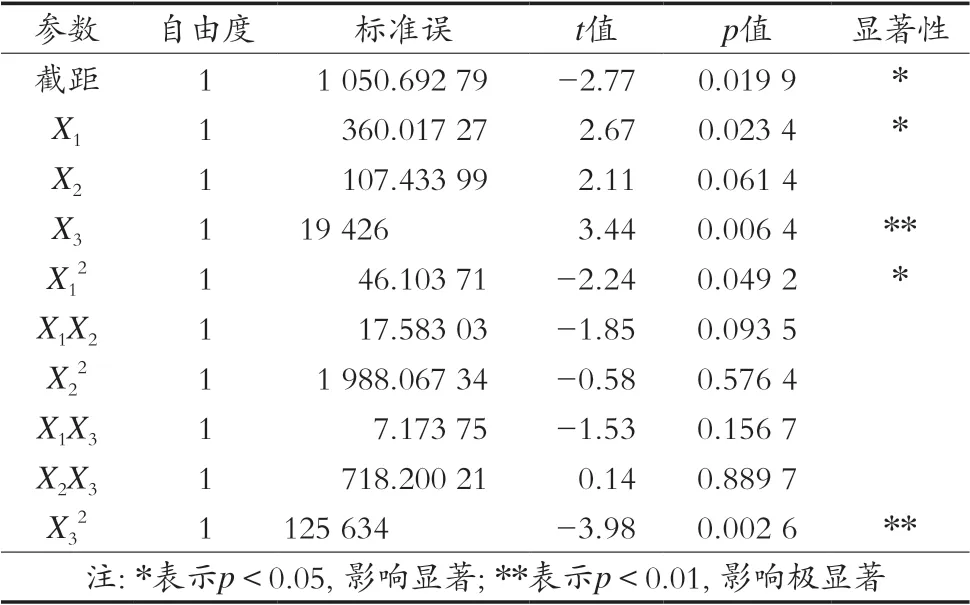
表4 参数估计及显著性检验
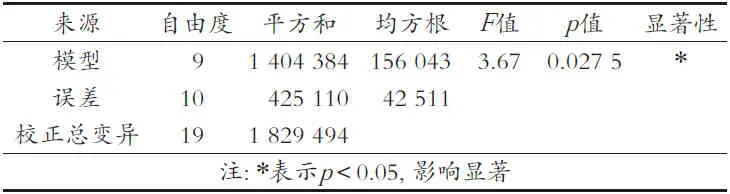
表5 方差分析
在输出的特征值结果中,显示稳定点为最大值(Stationary point is a maximum),且当X1=3.444 158,X2=5.485 748,X3=0.063 325时,稳定点预测值(Predicted value at stationary point)为1 483.054 648,略高于表3中6号试验结果1470.5。为便于实际操作,选择X1=3.5,即戊二醛浓度3.5%;X2=5.5,即固定化时间5.5 h;X3=0.063,取料酶比1∶16(g/mL),在此工艺条件下做3次平行试验,制备的固定化单宁酶活力为1 480.5±32.6 U/g,这与稳定点预测值基本一致,表明所构建的二阶回归模型合理、可靠,可以很好地预测实际生产中单宁酶的固定化。
另外,按照最优工艺,在16 mL单宁酶液中加入1 g ECR-1030M树脂,并以3.5%的戊二醛进行交联,固定5.5 h后获得的固定化单宁酶总活力为1 480.5 U/g,单宁酶液总活力为4 360 U/g,残酶液总活力为2 065.4 U/g,求得酶活回收率为64.5%。
2.3 固定化单宁酶的保藏稳定性
最优固定化条件下获得的ECR-1030M树脂固定化单宁酶,其酶活力随保藏时间的变化如图2所示。ECR-1030M树脂固定化单宁酶在4℃下保藏期间,随着时间的延长,酶活力不断下降。当保藏至20 d时,固定化单宁酶还有81.4%的酶活力;保藏至30 d时,固定化单宁酶仍保留了超过70%的酶活力。此后随着时间延长,酶活力下降速度增大,至45 d时,仅剩下初始酶活力的1/4。
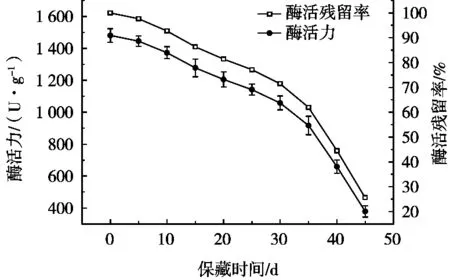
图2 固定化单宁酶的保藏稳定性
2.4 固定化单宁酶的循环使用次数
由图3可以看出,当固定化单宁酶循环使用6次后,仍具有80.3%的酶活力,而使用10次后还有超过1/2的酶活力。这表明该工艺制备的固定化单宁酶可以多次有效循环使用,表现出良好的酶活稳定性,因而有利于工业化应用。
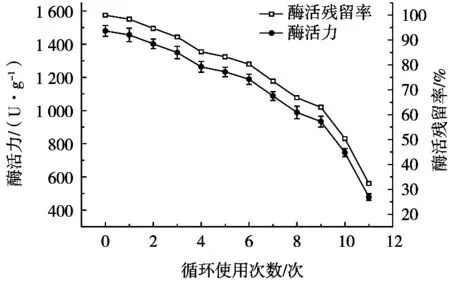
图3 固定化单宁酶的循环使用次数
3 结论与讨论
通过固态发酵米曲霉制备出单宁酶,然后进行超滤浓缩。采用戊二醛交联法,以不同类型的树脂材料为载体对超滤浓缩后的单宁酶进行固定化,通过对固定化酶活力的比较,确定二苯乙烯/丙烯酸酯基型大孔吸附树脂ECR-1030M为最佳固定化载体。然后设计均匀试验,分别考察戊二醛浓度、固定化时间及料酶比3个因素对酶活力的影响,并构建二阶回归模型Y=961.958 46X1+226.304 96X2+66 733X3-103.140 00X1
2-32.595 00X1X2-10.984 05X22-1 147.884 86X1X3+ 102.153 25X2X3-500 116X32-2 907.153 85。通过方差分析确定该模型显著,戊二醛浓度和料酶比2个因素对试验结果分别有显著和极显著影响。最后通过极值寻优,确定最优固定化单宁酶工艺条件:戊二醛浓度3.5%,固定化时间5.5 h,料酶比1∶16(g/mL)。在此条件下制备的固定化单宁酶活力最高,为1 480.5± 32.6 U/g。同时,在最优条件下制备固定化单宁酶,酶活回收率为64.5%。另外,还对固定化单宁酶的保藏稳定性和循环使用次数进行了测定。结果显示,固定化单宁酶在4℃下保藏至20 d和30 d时,仍分别具有超过80%和70%的酶活力。固定化单宁酶循环使用6次后,仍具有超过80%的酶活力。说明该工艺制备的固定化米曲霉单宁酶具有良好的保藏稳定性并可以高活力多次使用。
此工艺所选用的单宁酶固定化载体为价格低廉且性质稳定的树脂材料,投入生产中有利于降低产品成本。同时,制备的ECR-1030M树脂固定化米曲霉单宁酶活力高、保藏稳定性好、循环使用次数多,因而有望作为一种新型固定化酶制剂投入到工业应用。下一步将对该固定化酶产品在单宁水解、果汁脱涩及没食子酸制备等方面的实际应用展开研究。
猜你喜欢
——“单宁”
