法尼醇对白念珠菌生物膜死亡作用的研究初探
2020-06-06姜刘鎏孙凯瑞
周 鹏,章 萍,姜刘鎏,孙凯瑞,魏 昕
白念珠菌是最常见的条件致病性真菌[1],宿主免疫系统下降时可引起感染。白念珠菌在口腔、皮肤等部位主要以生物膜状态存在,与浮游状态白念珠菌比较,生物膜状态白念珠菌对抗真菌药物的耐受度明显增高[2]。
法尼醇是一种从真菌中检测出来的群体感应分子[3]。它可抑制白念珠菌细胞由酵母相向菌丝相的转换,从而抑制生物膜的形成及成熟[4]。先前研究表明法尼醇可以诱导白念珠菌浮游状态及生物膜状态细胞死亡[5-6],可促进耐药株白念珠菌浮游状态细胞坏死[6]。诱导白念珠菌细胞死亡可能对控制白念珠菌特别是耐药白念菌株的机会性感染有重要意义。法尼醇诱导白念珠菌生物膜的具体死亡机制尚不明确,未见法尼醇对白念珠菌耐药株生物膜坏死或凋亡作用的比较研究。
CDR1是编码氟康唑耐药相关的ABC转运蛋白基因[7]。文献发现,法尼醇导致浮游状态白念珠菌CDR1表达显著增加;在法尼醇作用下,浮游状态CDR1缺陷株白念珠菌细胞死亡率较低,过表达CDR1白念珠菌则死亡率升高[8],MCA1编码Caspase酶,Caspase酶与真核细胞凋亡密切相关[9]。基于上述研究发现,本研究对法尼醇诱导白念珠菌耐药株和标准株生物膜死亡的作用是坏死还是凋亡进行初步探讨。研究假设:法尼醇可诱导白念珠菌生物膜凋亡或坏死,其作用与生物膜时相及法尼醇作用浓度相关;CDR1和MCA1基因表达与法尼醇对白念珠菌生物膜细胞凋亡或坏死的调控作用相关。
1 材料与方法
1.1 菌株
白念珠菌标准株(SC5314)购自美国标准生物品收藏中心。白念株菌耐药株由SC5314通过氟康唑浓度梯度法诱导获得(已在过往研究中使用[10]),采用KONT真菌显色MIC药敏系统稳定性检测实验条鉴定,对抗真菌药物氟康唑(MIC ≥64 μg/mL)、5氟胞嘧啶(MIC ≥32 μg/mL)、两性霉素B(MIC ≥2 μg/mL)、伊曲康唑(MIC ≥1 μg/mL)耐药。
1.2 试剂与仪器
沙堡琼脂培养基(SDA,6.3 g/100mL),YPD培养液(2%葡萄糖2 g/100 mL,1%胰蛋白胨1 g/100 mL,1%酵母提取物1 g/100 mL),RPMI1640培养基(GIBCO公司,美国),PBS(pH=7.2,0.2 g/L KCL,0.2 g/L,8.0 g/L NaHCO3,2.16 g/L Na2HPO4·7H2O),E,E-法尼醇(100 μmol/L,Sigma公司,美国),PI试剂(YEASEN公司,中国),annexin V-FITC/PI(宝赛公司,中国),蜗牛酶(YEASEN公司,中国),DEPC水(Sigma公司,美国),iTaq-SYBR Green 预混酶(Roche公司,瑞士),玻璃底共聚焦培养皿(NEST公司,中国),激光共聚焦(Carl Zeiss公司,德国),超微量分光光度计(Nanoplus公司,德国),ABI 7300 FAST荧光定量PCR仪(ABI公司,美国),ABI Prism 7300SDS分析软件,流式细胞分析仪(BD公司,美国),YCP系列二氧化碳培养箱(易亮医疗器械有限公司,中国),低温高速离心机(EPPENDORF公司,德国)。
1.3 分组
白念珠菌标准株和耐药株生物膜法尼醇未处理对照组;白念珠菌标准株和耐药株生物膜法尼醇处理组(50、100、200、400、800 μmol/L)。
1.4 构建白念珠菌标准株及耐药株生物膜
将10 mL白念珠菌标准株和耐药株菌悬液(1×106个/mL)分别接种至10 cm玻璃底培养皿中。37 ℃,5% CO2孵育2 h。法尼醇未处理组每隔2 h换置新鲜的10 mL RPMI1640培养液。法尼醇处理组每隔2 h换置新鲜的10 mL相应梯度浓度法尼醇的RPMI1640培养液。分别培养6、12、24 h,获得不同浓度法尼醇处理下,不同时相的白念珠菌标准株和耐药株生物膜。
1.5 PI染色观察法尼醇对白念珠菌生物膜的坏死作用
取2 mL白念珠菌标准株及耐药株标准菌悬液分别接种至2 cm玻璃底共聚焦皿中,37 ℃,5% CO2恒温培养箱培养,获得各浓度法尼醇处理组和未处理对照组白念珠菌耐药株和标准株的6、12、24 h生物膜。4%多聚甲醛固定后,每皿加入50 μL PI(50 μg/mL),避光5 min,激光共聚焦显微镜下(× 400)观察法尼醇作用后耐药株和标准株坏死的形态学变化,激发光为535 nm。
1.6 Annexin-V-FITC/PI流式分析法尼醇对白念珠菌生物膜凋亡和坏死的作用
1.6.1 制备原生质体 按上述方法培养不同浓度法尼醇处理组和未处理对照组的白念珠菌耐药株和标准株6、12、24 h生物膜,收集后分别置于1.5 mL EP管中,12 000×g离心5 min。弃上清,加入1 mL脱壁促进剂(50 mmol/L二硫苏糖醇(DTT)+50 mmol/L 乙二胺四乙酸(EDTA)+50 mmol/L Tris(pH 8.0)),30 ℃,30 min后PBS洗涤2次,再加入1 mL 1%蜗牛酶,30 ℃,30 min,PBS洗涤2次,得到白念珠菌脱壁后原生质体的悬浮液。
1.6.2 流式细胞技术分析 收集白念珠菌生物膜原生质体,70%乙醇,4 ℃固定1 h。对标本进行标记后,使用膜联蛋白Annexin-V-FITC/PI凋亡检测试剂盒进行处理,加入FITC标记的Annexin V,室温避光30 min,加入PI,避光5 min,加入Buffer,之后在流式细胞仪上分析。分别计算正常、早期凋亡、晚期凋亡、坏死细胞的百分比。
1.7 q-PCR法分析法尼醇对白念珠菌生物膜CDR1及MCA1基因表达的改变
采用改良热酸酚法[11]提取总RNA,根据PrimeScript RT reagent Kit逆转成cDNA,超微量分光光度计测定RNA浓度,-20 ℃保存。
q-PCR使用iTaq-SYBR Green 预混酶进行反应,20 μL反应体系:10 μmol/L的上下游引物各0.6 μL,20倍稀释的cDNA模板0.2 μL,8.6 μL灭菌蒸馏水,再避光加入10 μL预混酶。将配制好的cDNA样本加入96孔培养板,ABI 7300 FAST荧光定量PCR仪进行q-PCR反应。循环条件:95 ℃,10 min,随后95 ℃变性15 s,55 ℃ 退火1 min,40个循环;70 ℃,20 s;最后4 ℃冷却。ACTIN为阴性对照基因。qRT-PCR 完成后,在 ABI 7300 System SDS Software 1.3.1.21软件上分析,查看每个基因的扩增情况,记录相应的Ct值。所有样本均重复3次。引物序列见表1。
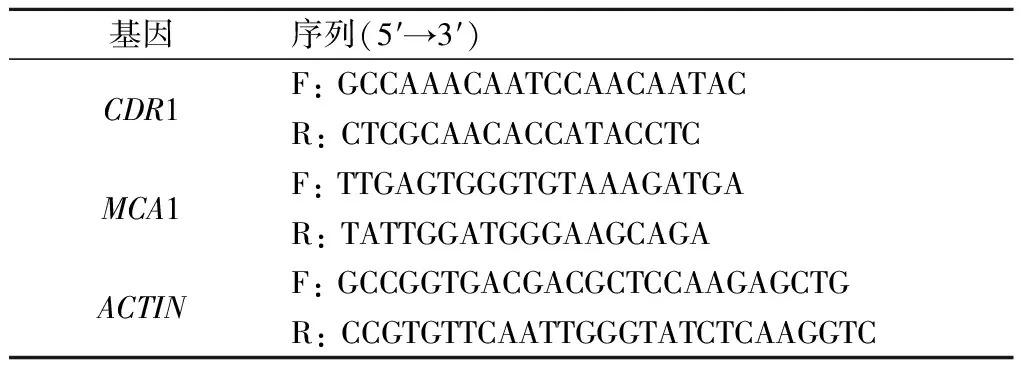
表1 引物序列Tab.1 Sequences of primers
1.8 统计方法
本研究使用SPSS 17.0软件进行统计学分析。对流式分析数据采用t检验分析,对q-PCR基因检测数据采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 激光共聚焦下观察法尼醇促进白念珠菌生物膜细胞的坏死
随着法尼醇处理浓度的升高,白念珠菌耐药株和标准株生物膜中细胞密度降低,菌丝长度变短,坏死细胞数目增加。标准株及耐药株各时相镜下表现具有一致性。结果参见图1。

白念珠菌标准株和耐药株生物膜细胞经法尼醇处理后,细胞膜完整性破坏。PI染色后,坏死细胞在荧光显微镜下观察为红色
2.2 流式分析观察法尼醇对白念珠菌生物膜凋亡和坏死的作用
在不同生物膜时相下,法尼醇对白念珠菌耐药株和标准株生物膜细胞凋亡与坏死的作用存在差异。结果见图2。
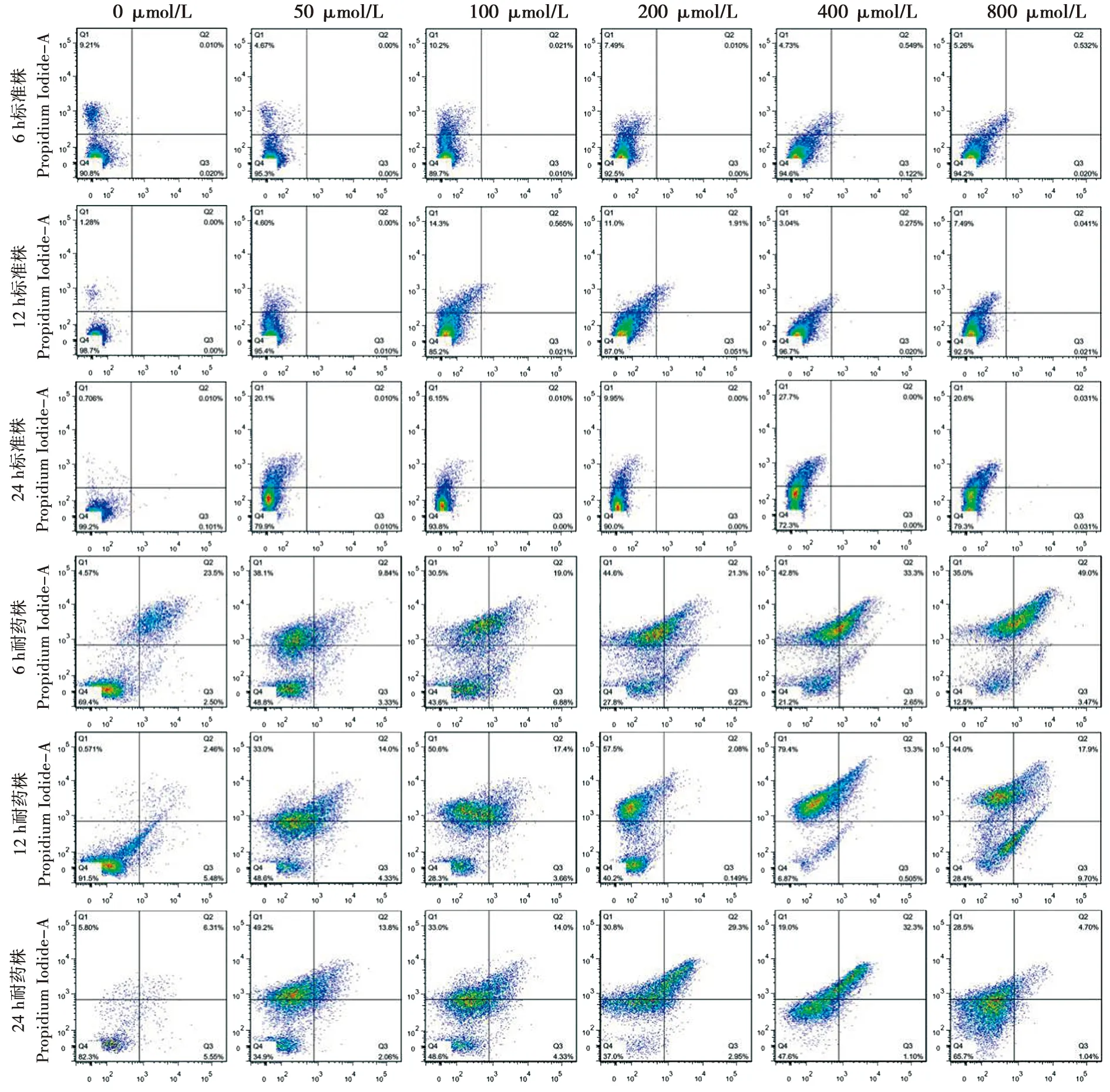
Q1、Q2、Q3和Q4分别表示:坏死细胞、早期凋亡细胞、晚期凋亡细胞和正常细胞
图2流式细胞法检测标准株及耐药株生物被膜细胞的凋亡和坏死
Fig.2Test of cell apoptosis and necrosis ofC.albicansbiofilms of resistant and standard strains stained by flow cytometry
2.2.1 法尼醇对白念珠菌耐药株和标准株生物膜凋亡作用的比较 法尼醇对白念珠菌耐药株和标准株生物膜凋亡作用的比较:50~800 μmol/L法尼醇处理组及未处理对照组中,白念珠菌耐药株凋亡率较标准株高(P<0.05),且在不同生物膜时相下具有一致性。结果见表2。
2.2.2 法尼醇对白念珠菌耐药株和标准株生物膜坏死作用的比较 法尼醇未处理对照组中,6 h和12 h生物膜时相下,白念珠菌耐药株坏死率较标准株低(P<0.05);24 h生物膜时相下,白念珠菌耐药株坏死率较标准株高(P=0.05)。在50~400 μmol/L法尼醇处理下,各时相下白念珠菌耐药株的坏死率均高于标准株(P<0.05)。在800 μmol/L法尼醇处理下,6 h生物膜时相,耐药株与标准株的坏死率无明显差异(P>0.05);12 h生物膜时相,耐药株坏死率较标准株低(P<0.001);24 h生物膜时相,耐药株坏死率较标准株高(P<0.001)。结果见表3。
表2 法尼醇对白念株菌标准株和耐药株生物膜凋亡作用的比较Tab.2 Comparison of the apoptosis effect of farnesol on C.albicans biofilms of resistant and standard strains

表3 法尼醇对白念珠菌标准株和耐药株生物膜坏死作用的比较 Tab.3 Comparison of the necrotic effect of farnesol on C.albicans biofilms of resistant and standard strains %
2.2.3 法尼醇对白念珠菌耐药株生物膜凋亡与坏死的作用 法尼醇对白念珠菌耐药株生物膜凋亡的作用:耐药株法尼醇处理组与其相应生物膜时相的未处理对照组的细胞凋亡率无显著性差异(P>0.05)。耐药株法尼醇处理组与未处理对照组的细胞凋亡率在各生物膜时相具有一致性,且各时相下耐药株生物膜凋亡率无显著性差异(P>0.05)。结果见图3。
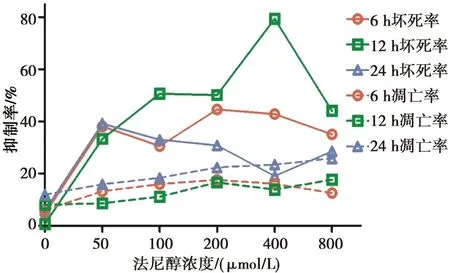
法尼醇对白念珠菌耐药株生物膜坏死的作用:各时相耐药株生物膜经法尼醇处理后的细胞坏死率显著高于其相应生物膜时相的未处理对照组(P<0.001);6 h生物膜时相,随着法尼醇处理浓度的增加,耐药株生物膜细胞坏死率先上升后下降、再上升后下降,且在200 μmol/L浓度的法尼醇处理下,耐药株生物膜细胞坏死率最高。12 h生物膜时相,随着法尼醇处理浓度的增加,耐药株生物膜细胞坏死率先上升后下降、再上升后下降,且在400 μmol/L浓度的法尼醇处理下,耐药株生物膜细胞坏死率最高。24 h生物膜时相,随着法尼醇处理浓度的增加,耐药株生物膜细胞坏死率先上升后下降、再上升,且在50 μmol/L浓度的法尼醇处理下,耐药株生物膜细胞坏死率最高。
在100 μmol/L、400~800 μmol/L浓度的法尼醇处理下,12 h耐药株生物膜细胞坏死率高于6 h生物膜(P<0.05);但在200~800 μmol/L浓度法尼醇处理下,24 h耐药株生物膜细胞坏死率低于6 h生物膜(P<0.05)。结果见图3。
各时相下法尼醇处理组白念珠菌耐药株生物膜细胞坏死率高于相应时相的未处理对照组(P<0.001),法尼醇对白念株菌耐药株生物膜的凋亡作用不明显(P>0.05)
图3法尼醇对白念珠菌耐药株生物膜细胞凋亡和坏死的作用
Fig.3The effect of farnesol on necrosis and apoptosis ofC.albicansbiofilms of resistant strains
2.2.4 法尼醇对白念珠菌标准株生物膜凋亡与坏死的作用 法尼醇对白念珠菌标准株生物膜凋亡的作用:标准株的法尼醇处理组与其相应生物膜时相的未处理对照组的细胞凋亡率无显著性差异(P>0.05)。标准株法尼醇处理组与未处理对照组的细胞凋亡率在各生物膜时相具有一致性,且各时相下标准株生物膜凋亡率无显著性差异(P>0.05)。
法尼醇对白念珠菌标准株生物膜坏死的作用:各个时相标准株生物膜经法尼醇处理后的细胞坏死率高于其相应生物膜时相的未处理对照组(P<0.029)。6 h和24 h生物膜时相,随着法尼醇处理浓度的增加,标准株生物膜细胞坏死率先上升后下降再上升,且在800 μmol/L浓度的法尼醇处理下,标准株生物膜细胞坏死率最高。12 h生物膜时相,标准株生物膜细胞坏死率与法尼醇处理浓度呈正相关,且在800 μmol/L浓度的法尼醇处理下,标准株生物膜细胞坏死率最高。
在400~800 μmol/L浓度的法尼醇处理下,12 h标准株生物膜细胞坏死率高于6 h生物膜(P<0.05);但在100~800 μmol/L浓度法尼醇处理下,24 h标准株生物膜细胞坏死率低于6 h生物膜(P<0.009)。见图4。
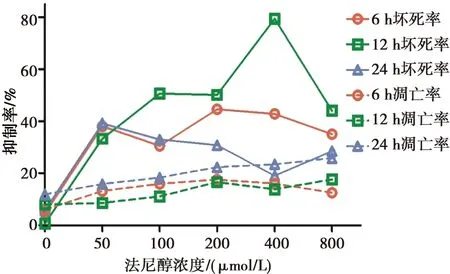
各时相下法尼醇处理组白念珠菌标准株生物膜细胞坏死率高于相应时相的未处理对照组(P<0.05),法尼醇对白念株菌标准株生物膜的凋亡作用不明显(P>0.05)
图4法尼醇对白念珠菌标准株生物膜细胞凋亡和坏死的作用
Fig.4The effect of farnesol on necrosis and apoptosis ofC.albicansbiofilms of standard strains
2.3 q-PCR分析法尼醇对白念珠菌生物膜CDR1和MCA1基因表达的改变
法尼醇对白念株菌标准株和耐药株生物膜CDR1基因表达的改变:标准株6 h生物膜法尼醇处理组CDR1表达高于未处理对照组(P<0.05),与法尼醇浓度呈正相关。在50~800 μmol/L浓度法尼醇处理下的耐药株6 h生物膜,其CDR1表达高于未处理对照组(P<0.05),且在200 μmol/L浓度的法尼醇处理下,CDR1表达最高。在50~800 μmol/L浓度法尼醇处理下的耐药株12 h生物膜,其CDR1表达高于未处理对照组(P<0.05),且在400 μmol/L浓度的法尼醇处理下,CDR1表达最高。在200~400 μmol/L法尼醇处理下的耐药株24 h生物膜,其CDR1表达高于未处理对照组(P<0.05),且在400 μmol/L浓度的法尼醇处理下,CDR1表达最高。标准株12 h和24 h生物膜法尼醇处理组与其相应生物膜时相的未处理对照组CDR1表达无明显差异(P>0.05)。见图5。
法尼醇对白念株菌标准株和耐药株生物膜MCA1基因表达的改变:在100 μmol/L、400~800 μmol/L浓度法尼醇处理下的标准株6 h生物膜,其MCA1表达高于未处理对照组(P<0.05),且在800 μmol/L浓度的法尼醇处理下,MCA1表达最高。在400 μmol/L浓度法尼醇处理下的标准株12 h生物膜,其MCA1表达高于未处理对照组(P=0.023)。在50~800 μmol/L浓度法尼醇处理下的耐药株6 h生物膜,其MCA1表达高于未处理对照组(P<0.05),且在200 μmol/L浓度的法尼醇处理下,MCA1表达最高。标准株24 h生物膜、耐药株12 h和24 h生物膜法尼醇处理组与其相应生物膜时相的未处理对照组MCA1表达无明显差异(P>0.05)。见图5。
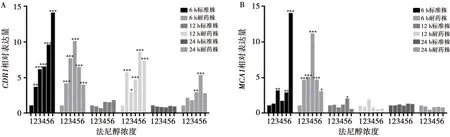
1、2、3、4、5、6分别是:0 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L、800 μmol/L
图5法尼醇对白念珠菌生物被膜CDR1基因(A)和MCA1基因(B)表达的影响
Fig.5Comparison of the effect of farnesol on the expression ofCDR1gene (A) andMCA1gene (B) ofC.albicansbiofilms
3 讨论
细胞死亡根据形态学特征和机制的不同,分为细胞凋亡和细胞坏死。细胞凋亡是由基因控制的有秩序、有控制、有预定程序的死亡过程,它涉及部分基因的激活、表达和调控。细胞坏死是一种由化学、物理或生物等因素造成的伤害所引起的细胞死亡情况。近年来,研究发现坏死亦可被调节,通常在凋亡被抑制的情况下发生,且同细胞凋亡一样受细胞内信号因子的调节[12]。法尼醇作为一种密度感应分子,对微生物的繁殖生长有调控作用[13-14]。多个研究发现法尼醇可以导致白念珠菌细胞死亡[5,8],但缺乏法尼醇对白念珠菌生物膜死亡作用机制的相关研究。本实验对不同浓度法尼醇诱导不同时相耐药株和标准株生物膜死亡的作用在凋亡和坏死方面进行初步探讨。
Hwang等[15]证实法尼醇可以在浮游状态白念珠菌细胞膜上累积,破坏细胞膜的完整性。本实验通过对白念珠菌生物膜PI染色观察其作用。PI是一种核酸染料,无法透过正常的细胞膜。正常细胞及凋亡细胞因细胞膜完整性未被破坏,细胞核无法被着色,而坏死细胞的细胞膜破裂,染料透过细胞膜对细胞内核酸进行染色,荧光显微镜下观察坏死细胞为红色。Maurya等[16]使用PI试剂对白念珠菌细胞进行形态学研究时,坏死细胞荧光显微镜下呈现红色荧光。本实验观察到生物膜中PI染色后红色荧光标记的白念珠菌细胞,提示法尼醇作用下白念珠菌细胞膜完整性受到破坏。进而通过形态学研究及流式分析,发现法尼醇作用于白念珠菌生物膜后,凋亡细胞少,坏死细胞表现显著,且与法尼醇未处理对照组相比,细胞凋亡无明显变化,细胞坏死明显增加。提示法尼醇促进白念珠菌生物膜细胞死亡的作用主要为促进坏死的作用。有研究也发现高浓度法尼醇可导致白念珠菌生物膜坏死[5],与本研究一致。
同时,本研究发现同一生物膜时相、在同一浓度法尼醇处理下,耐药株生物膜细胞的坏死率高于标准株,提示法尼醇对白念珠菌耐药株生物膜具有明显的促进坏死的作用,提示法尼醇可用于对抗耐药株的耐药性。康健等也报道法尼醇促进浮游状态白念珠菌耐药株坏死[6],与本研究对生物膜白念珠菌研究结果一致。
研究发现法尼醇对白念珠菌生物膜的抑制作用与法尼醇浓度有关[17]。本组实验形态学研究发现随着法尼醇处理浓度的升高,白念珠菌生物膜中细胞密度降低,菌丝长度减少,坏死细胞数目增加。流式分析显示耐药株和标准株细胞坏死率与法尼醇浓度相关。此外,耐药株和标准株生物膜在不同时相下虽然存在不同的最佳抑菌浓度,但各浓度法尼醇处理组的坏死率均高于相应时相的未处理对照组,提示法尼醇对生物膜的抑制作用可能与其诱导坏死作用相关。
法尼醇对白念珠菌生物膜的抑制作用与生物膜的时相有关[18]。本研究选取三个时间位点进行研究,分别为6 h(生物膜早期)、12 h(生物膜中期)和24 h(生物膜成熟期)。不同生物膜时相,白念珠菌的菌丝相和酵母相所占比例不同。随着生物膜的成熟,白念珠菌菌丝相增多,而酵母相减少。在6 h早期生物膜,白念珠以酵母相为主,但代谢较低。在12 h中期生物膜,白念珠菌从酵母相向菌丝相转化,代谢增高。在24 h生物膜,白念珠菌以维持菌丝相为主,代谢随之降低。Nagy等的菌丝生长动力学实验分析显示,法尼醇既抑制菌丝生长率,又延长菌丝长出的时间[19]。法尼醇能通过抑制Cup9的降解控制白念珠菌菌丝形成的启动[20]。对不同时相生物膜死亡情况进行比较,发现相同浓度法尼醇作用于耐药株及标准株生物膜,法尼醇对12 h生物膜的促进坏死作用最强,这可能与12 h生物膜代谢增高以及酵母相细胞所占总细胞的比率大,导致其对法尼醇的抑制作用最敏感相关。法尼醇促进24 h生物膜的坏死作用最弱,推测与生物膜进入成熟阶段后代谢降低、酵母细胞较少、菌丝多且长、细胞外基质较多、基质包裹酵母细胞和菌丝形成复杂的三维结构等因素相关。这些研究结果说明生物膜时相影响法尼醇促进耐药株及标准株生物膜细胞坏死的作用。
CDR1基因编码的ABC转运蛋白可将小分子物质进行跨膜转运,导致细胞体内药物浓度降低,造成细胞耐药[7]。研究发现法尼醇对浮游状态白念珠菌CDR1高表达菌株具有较高的杀灭作用,推测CDR1通过外排法尼醇-谷胱甘肽复合物,消耗白念珠菌内源性谷胱甘肽,使其抗氧化能力降低最终导致死亡[5]。本研究中在法尼醇作用下,早期白念珠菌标准株生物膜CDR1基因表达增加,耐药株生物膜3个时相的CDR1基因表达均上升。提示法尼醇处理下,白念珠菌生物膜细胞的CDR1基因表达增高,说明法尼醇对耐药株生物膜及标准株早期生物膜细胞坏死作用与其对高表达CDR1基因细胞坏死的促进作用一致。
MCA1编码的Caspase酶,参与细胞的生长、分化与凋亡调节,其过度表达会导致细胞体内过氧化物集聚,杀伤细胞[9]。本研究中,法尼醇促进早期白念珠菌标准株和耐药株生物膜MCA1基因的表达,MCA1基因的表达在中期和晚期生物膜中无显著性改变。研究提示,法尼醇促进白念珠菌耐药株及标准株晚期生物膜死亡的作用可能与MCA1基因无明显相关性。推测法尼醇对白念珠菌中期及晚期生物膜的作用是一种Caspase酶非依赖性的过程,可能不会促进生物膜的凋亡,其具体作用机制有待进一步探讨。
以往对法尼醇抑制白念生物膜的研究主要为研究法尼醇影响细胞形态转变、抑制菌丝的生长及成熟。对于耐药白念珠菌的研究集中在通过药物抑制耐药基因及蛋白的表达,减少治疗药物的外排从而达到治疗感染的作用。未见不同浓度法尼醇对不同时相白念珠菌耐药株及标准株生物膜死亡的作用及其比较研究。本实验对不同浓度法尼醇诱导耐药株和标准株生物膜死亡的作用在凋亡和坏死方面进行初步探讨,初步证实法尼醇对白念生物膜有促进坏死的作用。本研究为如何利用法尼醇促进白念珠菌生物膜坏死的作用,以治疗白念珠菌生物膜感染,特别是耐药生物膜的感染提供理论思路。
4 结 论
法尼醇对白念珠菌生物膜的作用以促进坏死为主,且对耐药株作用较对标准株显著。法尼醇的这种作用与生物膜时相相关,CDR1和MCA1与耐药株生物膜坏死相关。
