慢性肾脏病继发小鼠颌骨异常的形态学研究
2020-06-06张耀元陈宏裕
张耀元,陈宏裕,王 华,王 林
慢性肾脏病(chronic kidney disease,CKD)的晚期,机体内矿物质代谢紊乱,继发性甲状旁腺功能亢进,伴随骨代谢异常,肾性骨病在颅颌面部的主要表现为颌骨纤维化畸形的颜面部外观改变和牙周组织改变引起的咬合关系紊乱。颅颌面部较为严重的骨质改变并发其他部位骨代谢异常,称之为Sagliker综合征[1]。近年来,该疾病发病年龄呈现年轻化,并集中于女性,咬合关系紊乱引起咀嚼功能下降,严重颌面部畸形会影响其生活质量,慢性肾脏病患者的口腔治疗管理逐渐引起了口腔医生的关注[2-3]。因此,探究慢性肾脏病继发颌骨异常的形态学和细胞学研究对口腔治疗有着重要意义。本研究建立腺嘌呤饮食诱导CKD小鼠模型,研究CKD小鼠的下颌骨微结构变化,并从细胞学水平上探究正常对照组小鼠和CKD组小鼠的颌骨MSCs和股骨BMMs的生物学差异,为研究肾性骨病的机制奠定基础。
1 材料与方法
1.1 实验动物
健康的雄性SPF级C57BL/6小鼠20只,7周龄,体质量(21±1)g,由南京医科大学实验动物基地(SCXK(苏)2016-0002)提供。在南京医科大学五台SPF级动物房饲养,环境温度(23±2) °C,相对湿度60%,昼夜明暗交替(12 h),本实验经过南京医科大学伦理委员会批准。
1.2 药物与试剂
实验小鼠的纯化加工饲料由江苏协同医药生物工程有限公司生产(苏饲证(2014)01008),在AIN-93饲料的基础上调整比例,正常对照组饲料(1%钙,0.6%磷),CKD组饲料添加0.2%腺嘌呤(上海江莱生物),均经过Co60辐照灭菌[4]。小鼠全段甲状旁腺激素(parathyroid hormone, PTH)ELISA试剂盒(武汉优生尔商贸)、HE染色试剂盒(南京建成)、-MEM培养基、胎牛血清、青-链霉素溶液、胰酶(均购自Gibco)、C57BL/6 MSCs成骨诱导培养基(Cyagen)、Cell Counting Kit-8 (CCK-8, Dojindo)、碱性磷酸酶显色试剂盒(上海碧云天)、茜素红(Cyagen)、小鼠重组巨噬细胞集落刺激因子(macrophage colony-stimulating factor, M-CSF) (PeproTech)、小鼠重组核因子kB受体活化因子配体(receptor activator of nuclear factor kappa B ligand, RANKL) (PeproTech)、抗酒石酸酸性磷酸酶染色试剂盒(Sigma)。
1.3 主要仪器
生化分析仪(7100,日本日立),酶标分析仪(Molecular Devices,德国),小动物高分辨率Micro-CT扫描仪(vivaCT 80,瑞士),Skyscan分析软件,模块化组织包埋系统(HistoCore Arcadia),全自动半薄轮切片机(RM2265)、倒置荧光显微镜(DMI3000B),正置荧光显微镜(DM4000B,均购自德国徕卡)。
1.4 实验方法
1.4.1 腺嘌呤饮食诱导慢性肾脏病小鼠模型 20只七周龄C57BL/6小鼠适应性饲养1周后,随机分为2组,每组10只。①正常对照组用正常饲料喂养12周;②CKD组用0.2%腺嘌呤饲料喂养8周,第9~12周喂养不含腺嘌呤正常饲料[5]。每隔4周行血清生化指标检测,通过眼眶内眦静脉丛取血,静置离心,分离血清,取上清液,-80 ℃保存待测。采用全自动生化分析仪检测BUN、CREA、Ca、P水平[6]。第12周末,给予过量4%水合氯醛腹腔注射。小鼠处死后取其左侧肾脏,纵向剖开,将其固定在4%的多聚甲醛24 h,行脱水、包埋。5 μm厚度的肾脏组织切片HE染色观察其基本病理变化[7]。
1.4.2 下颌牙槽骨Micro-CT扫描成像和HE染色分析 取小鼠单侧下颌骨固定在4%多聚甲醛,24 h后Micro-CT对小鼠下颌骨进行扫描。扫描参数设定为:电压55 kV,电流145 μA,分辨率15.6 μm。牙槽骨微结构分析选取矢状方向下颌骨第一磨牙根分叉区域为感兴趣区域(region of interest,ROI)[8]。选取下颌骨冠状方向测量下颌骨皮质骨厚度[9]。使用Skyscan分析软件对选定区域的三维结构参数进行分析,主要测量指标有骨体积分数(bone volume fraction, BV/TV, BVF)、骨小梁厚度(trabecular thickness, Tb.Th)、骨小梁数目(trabecular number, Tb.N)、骨小梁分离度(trabecular separation, Tb.Sp)、骨矿化密度(bone mineral density,BMD)和骨皮质厚度 (cortical thickness)[10]。扫描后将小鼠右侧下颌骨脱钙,行脱水、包埋。5 μm厚度的骨组织切片行HE染色分析。
1.4.3 小鼠血清骨代谢指标检测 第12周末按ELISA试剂盒的步骤检测血清PTH水平。
1.4.4 两组小鼠颌骨MSCs的增殖和成骨能力比较 将小鼠4只/组麻药过量致死,75%的乙醇浸泡15 min,在超净工作台内无菌条件下将左侧下颌骨分离,去净软组织和牙齿,PBS反复冲洗,并用眼科剪刀剪碎后,将骨片种在含有10%血清的-培养基25 cm2的培养瓶中,72 h后换液,以后每隔2~3 d换液,约15 d细胞可传代培养[11]。CCK-8法检测两组小鼠颌骨MSCs的增殖能力,取两组生长状态良好的P3代颌骨MSCs,以2×103个/孔密度接种于96孔板,每板每组10个孔。分别在1 d、3 d、5 d、7 d同一时间取出一板,加入10 μL CCK-8 和100 μL新鲜培养液,闭光孵育2 h后,酶标仪450 nm读取吸光度值(OD值),绘制生长曲线。两组小鼠颌骨MSCs的成骨分化能力比较,取两组小鼠生长状态良好的P3代颌骨MSCs,以1×104个/孔密度接种于24孔板,待细胞融合至80%左右时,更换成骨诱导完全培养基,3 d换液1次。诱导7 d后行碱性磷酸酶(ALP)染色。诱导21 d后,PBS轻轻漂洗后,4%多聚甲醛固定10 min,加入茜素红染液染色3~5 min,倒置显微镜下进行拍照和观察,并对染色结果进行半定量分析[12]。
1.4.5 两组小鼠股骨骨髓BMMs破骨分化能力比较 无菌条件下取小鼠股骨的BMMs以5×104个/孔的密度接种在96孔板中,在含有25 ng/mL的M-CSF和50 ng/mL的RANKL的破骨培养液中诱导7 d,行抗酒石酸酸性磷酸酶(TRAP)染色[13]。
1.5 统计学分析

2 结 果
2.1 小鼠慢性肾脏病模型的建立
正常对照组小鼠活动状态正常,毛致密且有光泽;CKD组小鼠的体重下降,精神萎靡,毛量减少,脱毛,缺乏光泽,尿量增多。选取不同时间点行血清生化检测,以判断小鼠肾功能状态。随疾病进程发展,与正常对照组对比,CKD组的血清BUN、CREA和P水平均升高,Ca水平轻度升高。第12周末时血BUN明显升高,为(48.2±5.15)mmol/L,血清CREA升高为(64.5±8.49)μmol/L,血清Ca升高为(2.26±0.07)mmol/L、血清P升高为(3.55±0.88)mmol/L,图1A。 肾脏组织病理结果显示,光镜下观察CKD组肾小球系膜细胞轻度增生,肾小球的数目减少,囊腔萎缩;肾小管上皮细胞空泡变性,管腔见蛋白管型,肾间质大量炎细胞浸润,间质轻度纤维化,图1B。由此可以判断小鼠慢性肾脏病模型已经成功建立。
2.2 小鼠下颌骨的形态学分析
Micro-CT三维重建后图像显示,造模12周末,正常对照组下颌骨未发生骨质破坏;而CKD组下颌骨发生明显骨质破坏,下颌骨的髁突颈部、下颌角区域可见明显的骨质吸收,图2A;小鼠下颌骨第一磨牙根分叉区域Micro-CT分析的感兴趣区域,图2B;CKD组的骨密度明显降低,骨量减少,骨小梁厚度降低,骨小梁数量未发生明显改变,骨小梁分离度明显升高,骨指标变化如表1;CKD组下颌骨的骨皮质厚度降低,图2C。小鼠下颌骨 HE染色结果显示:与正常对照组相比,CKD组的第一磨牙根分叉区域的牙槽骨的骨量下降,板层状骨减少,形成不规则的小梁骨,骨髓腔有较多的类骨质形成,呈现骨质纤维化的特征,图2D。
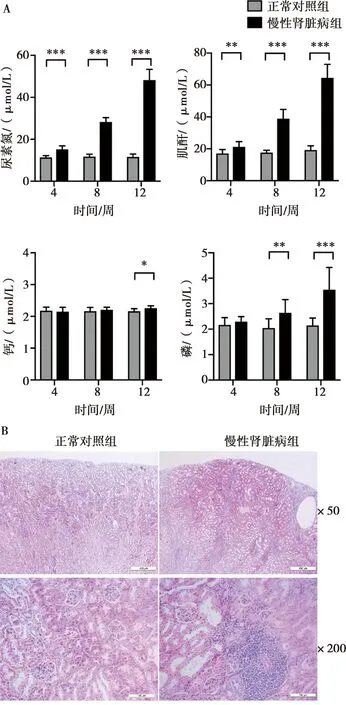
A:血清指标变化*:P<0.05,**:P<0.01,***:P<0.001,n=10);B:肾脏组织的HE染色
图1腺嘌呤饮食诱导慢性肾脏病小鼠模型的建立
Fig.1Establishment of a mouse model of adenine-induced CKD
2.3 小鼠骨代谢指标血清PTH检测结果
造模12周末,CKD组小鼠血清骨代谢指标PTH水平显著高于正常对照组,如图3。

A:下颌骨外观; B:第一磨牙区根分叉区域定量分析感兴趣区域(红色); C:骨皮质Micro-CT的定量分析; D:下颌骨HE染色
图2两组小鼠造模12周下颌骨Micro-CT分析和HE染色观察
Fig.2Micro-CT analysis and HE staining observationof mandible in two groups at the end of the12th week
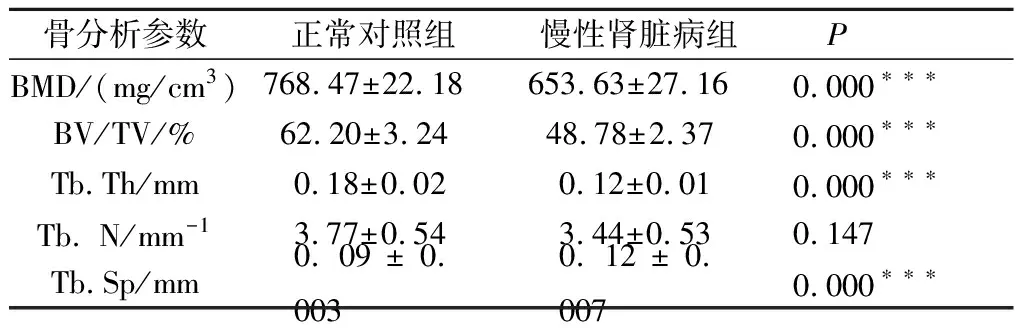
表1 两组小鼠造模12周下颌骨第一磨牙区根分叉区的Micro-CT定量分析Tab.1 Comparison of microstructural parameters of alveolar bone in mandible of mice in two groups at the end of the 12th week n=10

***:P<0.001,n=10
图3两组小鼠血清PTH水平
Fig.3The levels of serum PTH in two groups
2.4 小鼠颌骨MSCs的增殖与成骨分化能力比较
CCK8检测结果表明,CKD组小鼠颌骨MSCs增殖能力较正常对照组增强,3~7 d有统计学意义, 图4。对MSCs进行成骨诱导7 d后,CKD组的ALP阳性区域高于正常对照组,半定量分析差异具有统计学意义, 如图5A;成骨诱导21 d后,CKD组的茜素红染色的矿化结节数目略低于正常对照组,半定量分析差异具有统计学意义,图5B。
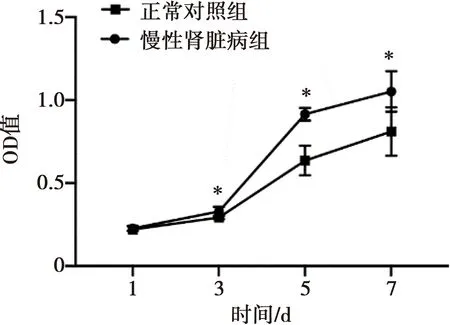
*:P<0.05,n=10
图4两组小鼠颌骨的MSCs增殖曲线
Fig.4The growth curves of murine mandible-derivedMSCs in two groups
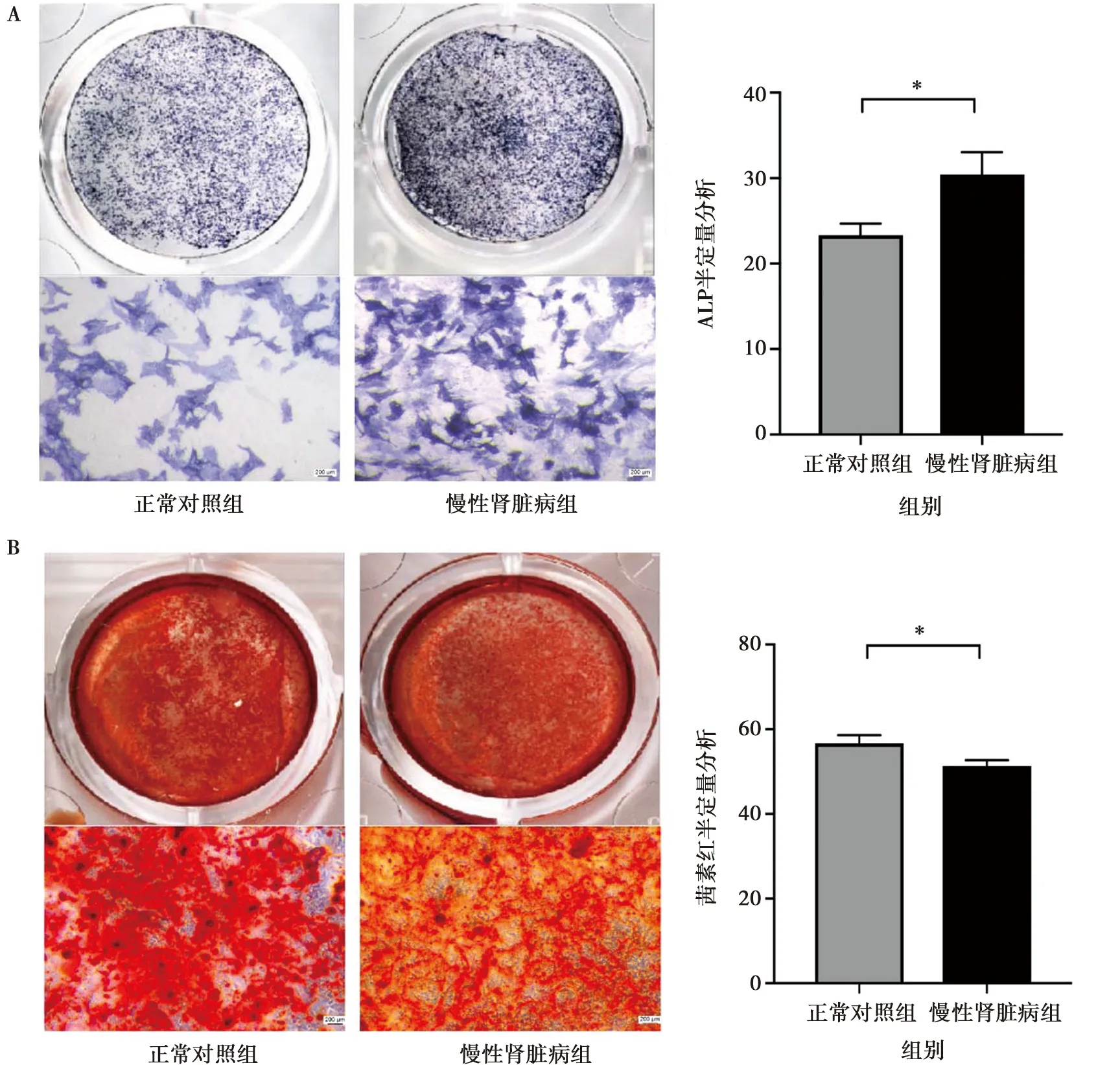
A: ALP染色及半定量分析( ×100); B: 茜素红染色及半定量分析( ×100);*:P<0.05,n=3
图5两组小鼠颌骨的MSCs的成骨分化能力比较
Fig.5Comparison of osteogenic differentiation capacity of murine mandible-derived MSCs in two groups
2.5 小鼠股骨BMMs破骨分化能力比较
股骨的骨髓BMMs经过破骨诱导后,CKD组小鼠的多核破骨细胞显著高于正常对照组,统计每组10个孔破骨细胞(细胞核>3)的数目平均值,差异具有统计学意义,图6。
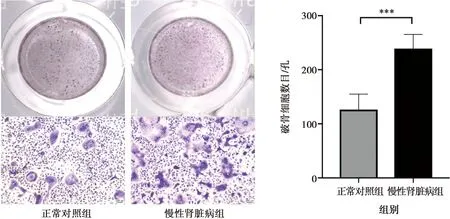
***:P<0.001,n=10
图6两组小鼠股骨破骨细胞TRAP染色及半定量分析(×100)
Fig.6The TRAP staining and semi-quantitative analysis of osteoclast in two groups (×100)
3 讨 论
本实验采用腺嘌呤饮食诱导小鼠CKD模型分析慢性肾脏病对颌骨微结构的影响。腺嘌呤诱导CKD的原理是黄嘌呤脱氢酶作用于腺嘌呤将其氧化成2,8-二羟基腺嘌呤。2,8-二羟基腺嘌呤溶解度非常低,在肾小管中沉积为结石,导致广泛的肾小管扩张、坏死和纤维化,伴有肾功能障碍。与传统的5/6肾切除手术相比,该造模方法的动物生存率较高,并且传统手术仅仅造成肾表面损伤,而对肾实质功能影响有待考量,还有研究表明采用转基因小鼠构造肾衰模型,由于其费用较高,实验动物获取上存在一定难度[5]。本实验采用含0.2%的腺嘌呤饲料饲养8周,每隔4周行血清生化监测,研究发现随着疾病的进展,CKD组小鼠的血清生化指标如血清BUN、CREA、P显著上升, 血清Ca轻度升高,反映小鼠肾功能逐渐下降,与既往研究结果一致。本研究在造模的第8周末更换成不含腺嘌呤饲料继续饲养至第12周,有助于延长小鼠寿命,可以更好地模拟慢性肾脏病并发骨病的长期过程。
慢性肾脏病晚期继发性甲状旁腺功能亢进,本实验中我们观察到CKD组小鼠的血清PTH水平显著增高。既往研究表明,PTH对骨代谢具有双重影响,PTH可以导致成骨、破骨活动增加,骨转换率提高。高水平的PTH,以破骨细胞的骨吸收活动为主,骨溶解后释放钙入血从而使钙水平升高,同时导致骨质破坏[14],而且有研究表明PTH是下颌骨纤维化骨病的一个主要的驱动因素[15]。本实验中发现CKD组小鼠下颌骨的骨密度降低,骨量减少,骨小梁厚度减少,骨皮质厚度降低,这在一定程度上反映骨吸收活动占主导,与既往临床报道的证据[16-17]相一致。有临床报道和研究观察到CKD小鼠的下颌骨骨小梁数目增多,但是本实验中CKD组与正常对照组并无明显差异,这种差异可能归结于CKD疾病的阶段,当血清PTH水平升高初期,以成骨活动为主导时,生成不规则不成熟骨小梁和类骨质,从而导致骨小梁的短暂增加[18]。本实验 HE染色进一步观察到CKD组小鼠下颌骨骨髓腔内类骨质增加,板层状骨减少的特点。既往研究通过设置不同时间点观察长骨骨量的持续变化,发现皮质骨的持续丢失,并在某个时间段骨皮质分解迅速加快,同时PTH水平显著升高,并推断PTH的累积是皮质骨分解代谢加速的原因之一[19]。
我们从细胞学水平对两组小鼠的颌骨MSCs的生物学差异进行探究。江建青等[20]从长骨中提取的MSCs表现出高增殖和高成骨分化能力,本研究从CKD组小鼠的下颌骨提取的MSCs,其增殖能力增强,显著高于正常对照组,7 d时ALP染色证明了早期成骨分化能力略强于正常对照组,但是茜素红染色结果显示,两组MSCs诱导21 d后,CKD组形成矿化结节的能力略低于正常对照组。有研究表明,从临床高转化骨病患者骨片中诱导的成骨细胞表现出高增殖能力和较低的矿化能力,但早期成骨标志物的表达有所增加[21-22]。因此,我们推测在CKD组小鼠机体调节中,存在某些致病机制使成骨细胞后期表现一定程度的矿化异常。我们进一步提取股骨BMMs,观察其破骨分化能力。破骨细胞来源于骨髓单核巨噬细胞系的一种终末细胞[23],相较于其他细胞而言,破骨细胞数量较少,从股骨骨髓干细胞中获取BMMs诱导破骨细胞探究骨质疏松的机制研究较多[24],细胞获取方法较为成熟[25],从小鼠颌骨提取破骨前体细胞的报道较少[26],操作难度大,并基于既往报道长骨的骨量丢失和本实验中颌骨的骨量丢失一致的表型,我们从股骨骨髓干细胞中获取BMMs诱导破骨分化,证明了其破骨能力也显著高于正常对照组。因此,基于本实验推断CKD组小鼠颌骨内高增殖的MSCs分化为成骨细胞,成骨细胞分泌大量因子,为破骨细胞的分化提供一定的基础[27]。进一步推断这种高转化机制可能致使骨量下降,骨密度降低,骨微结构改变。
深入了解慢性肾脏病对颌骨代谢的影响及致病机制,对口腔医生的临床工作有着一定的指导意义。国内临床报道13岁女患儿上下颌骨隆起,下颌骨较为明显的“河马征”[28],接诊这类异常的颌骨畸形,需要仔细询问病史,警惕Sagliker综合征。颌骨的骨量和骨密度,以及良好的牙槽骨对正畸牙齿移动和正颌手术有着重要意义。伴有慢性肾脏病的患者,常规的外科拔牙术中,由于其骨质密度的降低,及易发生颌骨的脆性骨折,影响创口愈合,所以在后期种植修复中,我们应充分评估骨量和骨质,在接诊此类患者术中我们更应做好保护工作。
综上所述,慢性肾脏病继发甲状旁腺功能亢进,PTH水平升高,机体内矿物质代谢紊乱,下颌骨的微结构改变,骨量丢失,我们并对其从细胞学角度进行初步探究。但本研究样本量较小,将MSCs提取至体外,脱离了体内复杂的调节机制,其表型会发生一定程度改变,我们会进一步增加不同时间节点的动物进行其成骨及破骨细胞的生物学研究,并继续挖掘提取颌骨来源的破骨前体细胞最适宜的方法。CKD对颌骨代谢的影响需要大量深入研究,0.2%的腺嘌呤饮食可以成功诱导肾性骨病小鼠模型,为深入探究肾性骨病发生机制提供了较为理想的动物模型。
