含1,2,3-三氮唑基团的新型四氧杂杯[2]芳烃[2]嘧啶衍生物的合成与抗肿瘤活性研究
2020-06-05余永波黄统辉
吴 鑫, 余永波, 安 琳, 黄统辉
(徐州医科大学 江苏省新药研究与临床药学重点实验室,江苏 徐州 221000)
癌症是全球死亡率较高的疾病,随着人口老龄化加剧,发病率持续升高[1-2]。近年来,尽管大量新型抗癌药物应用于临床治,但由于癌症多样性及耐药性的出现,死亡率仍然很高。因此,开发安全有效的新型抗癌药物仍然是目前医学领域研究的热点问题。
Scheme 1
杯芳烃是一类具有独特空腔结构的环状低聚物[3],广泛应用于分子识别[4]、药物载体[5]、抗菌[6]、抗肿瘤[7-8]等领域。其中,杂环杯芳烃由于杂原子及杂芳环的引入,可以更有效地调节空腔大小及电子密度[9-10],一系列具有较好抗肿瘤活性的杂环杯芳烃被报道[11-12]。嘧啶氧基苯基与1,2,3-三氮唑是重要的杂环结构片段,两者的衍生物均具有良好的理化性质及抗炎[13-14]、抗菌[15-16]、抗肿瘤[17-18]等生物活性。鉴于此,本课题组根据药效团和骨架跃迁原理,将具有潜在抗肿瘤活性的嘧啶氧基苯基片段引入杯芳烃骨架中,并利用点击化学反应在于侧链引入活性基团1,2,3-三氮唑,设计、合成了一系列结构新颖的、包含多潜在抗肿瘤活性官能团的含1,2,3-三氮唑基团的四氧杂杯[2]芳烃[2]嘧啶衍生物。
本文以4-氯-2-甲硫基-6-丙炔氧基嘧啶为原料,依次经Williamson醚合成、氧化和聚合反应制得新型四氧杂杯[2]芳烃[2]嘧啶母体(4),并通过点击化学反应合成了4个结构新颖的含1,2,3-三氮唑基团的四氧杂杯[2]芳烃[2]嘧啶衍生物(5a~5d, Scheme 1),其结构经1H MNR,13C MNR和HR-MS(ESI)表征并用MTT法验证了5a~5d对人宫颈癌细胞(Hela),人乳腺癌细胞(MCF-7),人肝癌细胞(HepG2)和人肺癌细胞(A549)的体外抗肿瘤活性。
1 实验部分
1.1 仪器与试剂
YRT-3型熔点仪;ZF-20D型暗箱式紫外分析仪;JNM-ECZR 400 MHz型核磁共振仪(DMSO-d6或CDCl3为溶剂,TMS为内标);Bruker maXis 4G UHR-TOF型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1) 中间体2的合成
在500 mL的茄形瓶中加入间苯二酚3.30 g(30.0 mmol), 3,5-二羟基苯甲酸甲酯5.04 g(30.0 mmol),碳酸铯14.43 g(44.4 mmol)和乙腈300 mL,室温搅拌30 min,随后加入112.96 g(60.0 mmol),移至75 ℃油浴中反应48 h(TLC跟踪反应至结束)。冷却,抽滤,干燥脱溶,粗产物经硅胶柱层析(洗脱剂:A=石油醚/乙酸乙酯5/1,V/V)纯化得白色固体2,收率43%, m.p.122.5~128.2 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.76(d,J=2.2 Hz, 2H), 7.23~7.19(m, 1H), 6.44(s, 2H), 5.10(d,J=2.3 Hz, 4H), 3.91(d,J=3.6 Hz, 3H), 3.18(s, 6H), 2.56(t,J=2.4 Hz, 2H);13C NMR(CDCl3, 100 MHz)δ: 171.5, 170.6, 164.9, 164.8, 152.8, 133.3, 120.4, 119.5, 95.0, 76.9, 76.4, 56.0, 52.9, 38.9; HR-MS(ESI)m/z: Calcd for C24H21N4O6S2{[M+H]+}525.1, found 525.1。
(2) 中间体3的合成
将中间体22.33 g(5.0 mmol)溶于80 mL二氯甲烷中,分批次加入m-CPBA 2.85 g(15 mmol),氩气保护下常温反应5 h(TLC跟踪反应至结束)。抽滤,脱溶,粗产物经硅胶柱层析(洗脱剂:A=2/1)纯化得中间体白色固体3,收率85%, m.p.116.5~118.7 ℃;1H NMR(DMSO, 400 MHz)δ: 7.83~7.71(m, 3H), 6.84(d,J=2.5 Hz, 2H), 5.14~5.11(m, 4H), 3.83(d,J=2.2 Hz, 3H), 3.72~3.64(m, 2H), 3.25(d,J=2.3 Hz, 6H);13C NMR(DMSO, 100 MHz)δ: 171.5, 170.6, 164.9, 164.8, 152.8, 133.3, 120.4, 119.5, 95.0, 76.9, 76.4, 56.0, 52.9, 38.9; HR-MS(ESI)m/z: Calcd for C24H20N4O10S2{[M+Na]+}611.0531, found 611.0448。
(3) 中间体4的合成
在500 mL的茄形瓶中加入间苯二酚1.32 g(12.0 mmol), 3,5-二羟基苯甲酸甲酯2.17 g(12.0 mmol),碳酸铯7.8 g(24 mmol),乙腈300 mL。室温搅拌30 min后,加入中间体36.36 g(12.0 mmol),移至75 ℃油浴中反应3 h(TLC跟踪反应至结束)。冷却,抽滤,脱溶,粗产物经硅胶柱层析(洗脱剂:A=1/1)纯化得白色固体4,收率37%, m.p.85.4~87.6 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.47(d,J=2.1 Hz, 2H), 7.41(d,J=2.1 Hz, 2H), 6.89~6.86(m, 1H), 6.78~6.75(m, 1H), 6.13(s, 1H), 5.07(d,J=2.4 Hz, 4H), 3.87(d,J=0.8 Hz, 6H), 2.58(t,J=2.3 Hz, 2H);13C NMR(CDCl3, 100 MHz)δ: 172.5, 171.7, 165.4, 164.1, 152.9, 132.3, 121.6, 120.8, 86.7, 77.7, 75.7, 54.9, 52.5; HR-MS(ESI)m/z: Calcd for C30H21N4O10{[M+H]+}597.1, found 597.1。
(4) 化合物5a~5d的合成(以5a为例)
将4-(3-叠氮丙氧基)吡啶0.125 g(0.55 mmol)和中间体40.149 g(0.25 mmol)溶于10 mL DMF,加入催化剂CuSO4·5H2O 0.030 g(0.10 mmol)和抗坏血酸钠0.050 g(0.25 mmol),90 ℃下反应2 h(TLC跟踪反应至结束)。冷却,加水析出固体,抽滤,粗产物经硅胶柱层析(洗脱剂:A=2/1)纯化得目标化合物5a。
5a: 黄色固体,收率21%, m.p.125.4~127.1 ℃;1H NMR(DMSO, 400 MHz)δ: 8.27(s, 2H), 7.65(d,J=7.6 Hz, 4H), 7.37(d,J=2.2 Hz, 2H), 7.32(d,J=2.2 Hz, 2H), 7.26(t,J=2.2 Hz, 1H), 7.17(t,J=2.2 Hz, 1H), 6.36(s, 2H), 6.08(d,J=7.6 Hz, 4H), 5.47(s, 4H), 4.38(t,J=7.0 Hz, 4H), 3.89(t,J=7.0 Hz, 4H), 3.76(d,J=5.0 Hz, 6H), 2.34~2.20(m, 4H);13C NMR(DMSO, 100 MHz)δ: 177.5, 173.3, 171.6, 165.1, 165.0, 164.0, 153.6, 153.4, 142.3, 141.5, 125.7, 120.1, 118.0, 87.1, 60.7, 53.3, 53.0, 47.1, 31.2; HR-MS(ESI)m/z: Calcd for C46H40N12O12{[M+H]+}953.2961, found 953.2966。
5b: 白色固体,收率10%, m.p.133.0~135.4 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.96(s, 2H), 7.60(d,J=9.5 Hz, 2H), 7.43(d,J=1.8 Hz, 2H), 7.37(d,J=1.9 Hz, 2H), 7.34(d,J=8.4 Hz, 2H), 6.86~6.69(m, 6H), 6.26(d,J=9.5 Hz, 2H), 6.06(s, 2H), 5.59(s, 4H), 4.84(t,J=4.5 Hz, 4H), 4.46(t,J=4.6 Hz, 4H), 3.86(d,J=2.8 Hz, 6H);13C NMR(CDCl3, 100 MHz)δ: 173.1, 171.6, 165.3, 164.1, 161.0, 160.8, 155.8, 153.0, 152.9, 143.3, 143.1, 129.2, 125.3, 121.6, 120.7, 113.9, 113.4, 112.6, 101.7, 86.7, 66.8, 60.3, 52.5, 49.6; HR-MS(ESI)m/z: Calcd for C52H38N10O16{[M+H]+}1059.254 0, found 1059.252 5。
5c: 白色固体,收率17.6%, m.p.116.3~118.7 ℃;1H NMR(CDCl3, 400 MHz)δ: 8.78(s, 2H), 8.04(t,J=8.2 Hz, 4H), 7.98(s, 2H), 7.46~7.43(m, 2H), 7.41~7.33(m, 6H), 7.04(s, 2H), 6.83(dd,J=3.5 Hz,J=2.0 Hz, 1H), 6.74(dd,J=3.6 Hz,J=2.0 Hz, 1H), 6.04(d,J=1.5 Hz, 2H), 5.58(s, 4H), 4.87(t,J=4.7 Hz, 4H), 4.52(t,J=4.7 Hz, 4H), 3.85(s, 6H);13C NMR(CDCl3, 100 MHz)δ: 173.1, 171.6, 165.3, 164.1, 156.0, 153.0, 152.9, 148.2, 144.2, 143.1, 135.4, 131.0, 129.2, 125.3, 122.2, 121.7, 121.6, 120.7, 106.6, 86.7, 66.7, 60.3, 52.5, 49.8; HR-MS(ESI)m/z: Calcd for C52H40N12O12{[M+H]+}1025.2961, found 1025.2972。
5d: 黄色固体,收率11.2%, m.p.142.6~145.1 ℃;1H NMR(CDCl3, 400 MHz)δ: 8.07(d,J=7.0 Hz, 2H), 8.00(d,J=8.1 Hz, 2H), 7.74~7.65(m, 2H), 7.54(s, 2H), 7.49(d,J=8.5 Hz, 2H), 7.40(d,J=2.1 Hz, 4H), 7.37~7.29(m, 2H), 6.76~6.68(m, 2H), 6.48(d,J=7.1 Hz, 2H), 5.95(s, 2H), 5.41(s, 4H), 4.79(t,J=5.8 Hz, 4H), 4.44(t,J=5.8 Hz, 4H), 3.88(d,J=2.7 Hz, 6H);13C NMR(CDCl3, 100 MHz)δ: 172.9, 171.5, 168.2, 165.3, 164.0, 152.9, 143.0, 138.5, 132.3, 131.4, 129.2, 128.9, 128.6, 125.8, 125.2, 125.0, 124.7, 120.8, 120.7, 104.7, 86.6, 60.1, 52.5, 49.2, 42.1, 41.0; HR-MS(ESI)m/z: Calcd for C56H40N12O12{[M+H]+}1073.2961, found 1073.2980。
1.2 性能或活性测试
采用MTT法研究化合物5a~5d对MCF-7、 HepG2、 A549、 HeLa的体外抗增殖活性。以5-氟尿嘧啶为阳性对照,测试目标化合物的单浓度抑制率。设定给药浓度为50 μM,作用时间为72 h,每组设6个复孔[19-20]。
2 结果与讨论
2.1 合成
合成3的过程中发现,间氯过氧苯甲酸需分批次加入,否则反应过于剧烈,影响收率。在以中间体4合成目标化合物5a~5d的过程中,探索了不同的催化剂、溶剂、反应温度、反应时间对收率的影响。结果表明,单独使用CuI或抗坏血酸钠作为催化剂时,收率显著低于使用CuSO4·5H2O与抗坏血酸钠的收率;在DMF、 PEG-600、 DMSO、 THF等多种溶剂中,以DMF作为溶剂时收率最高;反应最佳温度为90 ℃,反应温度降低时,收率随之降低;反应温度升高时,TLC检测反应杂质增多,收率亦降低;反应2 h原料基本反应完全,延长反应时间至4 h,反应杂质增多,收率降低。
2.2 抗肿瘤活性
表1为化合物5a~5d对Hela、 MCF-7、 HegG2和A549的体外抗肿瘤活性及其油水分配系数LogP值。由表1可见,化合物5a~5d对肿瘤细胞显示出不同程度的抗增殖作用。其中,化合物5a对肿瘤细胞有明显的抑制作用,其在50 μM浓度下对MCF-7的抑制率可达82%,是阳性对照药5-氟尿嘧啶的2.6倍;对A549的抑制率为53.9%,略低于5-氟尿嘧啶(5-FU);对Hela和HegG2的细胞毒性较差,显示出一定的选择性。化合物5b~5d的抗肿瘤活性相对较弱,其中化合物5d表现出最弱的抗增殖活性,可能与其较高的亲脂性有关(LogP=9.58)。基于此,推测此类化合物的抗肿瘤活性可能与亲脂性有关,当引入基团亲脂性过高时,化合物溶解性差,抗肿瘤活性降低。因此,后续的优化将集中在引入水溶性基团以改善其油水分配系数,提升抗肿瘤活性方面。
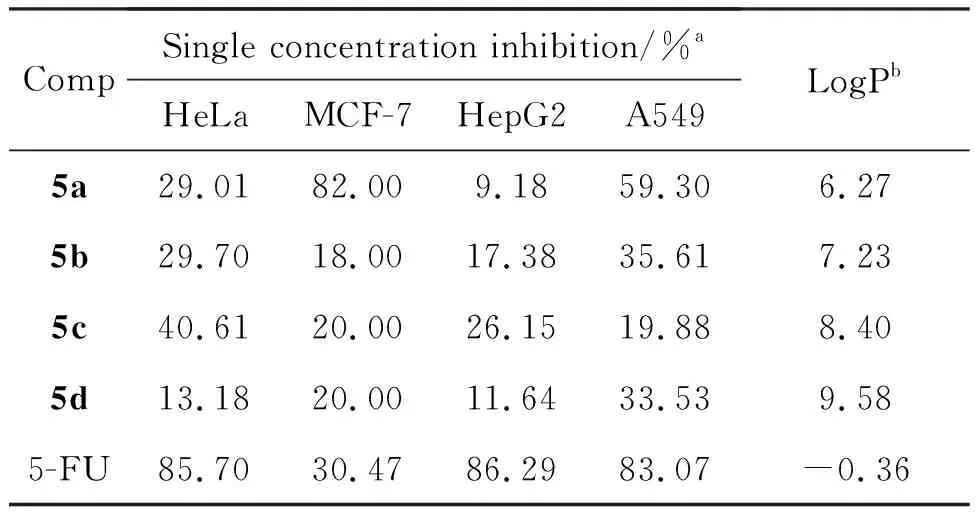
表1 5a~5d的构效关系
a5a~5d的浓度为50 μM;bLogP值由Molsoft软件计算。
以4-氯-2-甲硫基-6-丙炔氧基嘧啶为原料,设计并合成了4个结构新颖的含1,2,3-三氮唑基团的四氧杂杯[2]芳烃[2]嘧啶衍生物(5a~5d),并采用MTT法初步评价了其体外抗肿瘤活性。结果表明,化合物5a对MCF-7具有明显的抑制活性,在50 μM浓度下抑制率可达82%,优于阳性对照药5-氟尿嘧啶,具有潜在的临床价值。进一步的结构优化与生物活性研究正在进行中。
