含三氟甲基手性毗邻双螺环氧化吲哚的合成
2020-06-04崔宝东陈永正
张 超, 魏 新, 卫 钢, 崔宝东*, 陈永正
(1. 遵义医科大学 药学院, 贵州 遵义 563000; 2. 澳大利亚联邦科学与工业研究组织(CSIRO)制造业,新南威尔士 2070)
手性螺环氧化吲哚存在于多种药物和天然产物中[1-5],是构成许多药物活性分子的基本结构单元。尤其是含毗邻手性季碳中心的双螺环氧化吲哚类化合物,其独特的三维空间结构往往与良好的生物活性有关[6-7]。由于空间位阻较大,目前的方法主要集中于含毗邻螺环季碳中心的双螺环氧化吲哚类化合物消旋体的合成,不对称合成的报道还较少,已有方法主要包括有机催化的不对称[3+2]环加成反应以及其他环化串联反应[8-14]。
目前,含三氟甲基的手性螺环氧化吲哚类化合物的合成受到了较多关注。此类化合物的合成主要有两种途径:(1)三氟甲基叶立德氧化吲哚作为电子给体参与的不对称环加成反应[15-17];(2)三氟甲基取代的氧化吲哚底物作为电子受体参与的不对称环化串联反应[18-20]。3-(2,2,2-三氟次乙基)氧化吲哚是一类较好的电子受体,在合成含三氟甲基手性螺环氧化吲哚类化合物中能够表现出较好的反应活性。

Scheme 1
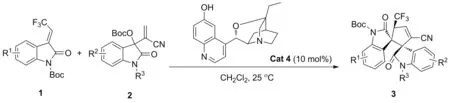
Scheme 2
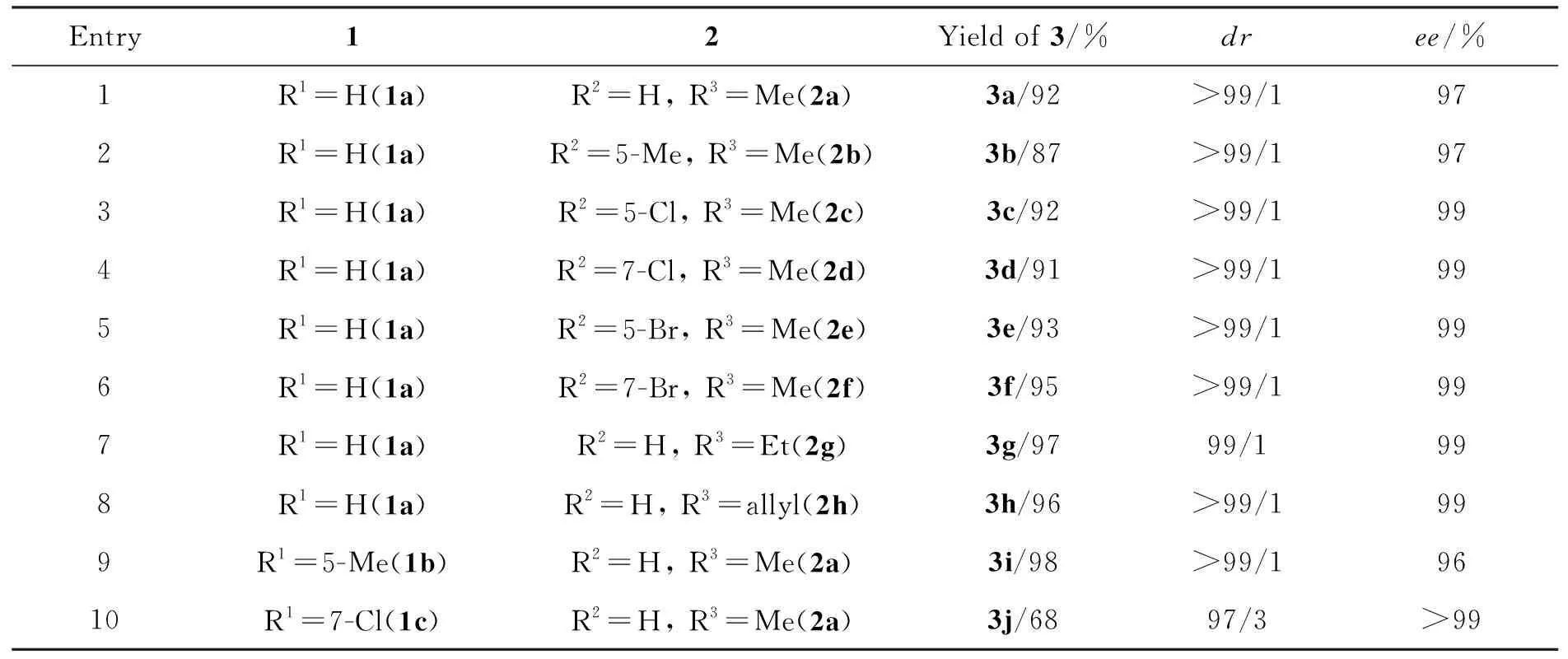
表1 底物拓展
基于以上研究背景,我们设想在手性胺的催化下,靛红衍生的MBH碳酸酯首先与手性胺作用形成1,3-偶极子,接着该偶极子再与3-(2,2,2-三氟次乙基)氧化吲哚进行α-区域选择性的不对称[3+2]环加成反应,用于构建含三氟甲基砌块和毗邻螺环季碳中心的手性双螺环氧化吲哚(Scheme 1)。
本文以10 mol%β-ICD作催化剂,靛红衍生的MBH-碳酸酯与3-(2,2,2-三氟次乙基)氧化吲哚为原料,经不对称[3+2]环加成反应,合成了10个含三氟甲基的手性毗邻双螺环氧化吲哚类化合物(3a~3j, Scheme 2),收率68%~98%,dr值97/3~>99/1,ee值96%~>99%,其结构经1H NMR,13C NMR表征。
1 实验部分
1.1 仪器与试剂
Rudolph API/1W型旋光仪;Agilent-400 MHz型核磁共振仪(CDCl3溶剂,TMS为内标);Shimadazu LC-20A型高效液相色谱仪;Supernova型X-射线单晶衍射仪。
所用试剂均为分析纯。
1.2 化合物3a~3j的合成(以3a为例)
称取3-(2,2,2-三氟次乙基)氧化吲哚(1a)37.7 mg(0.12 mmol)、靛红衍生的MBH-碳酸酯(2a)31.3 mg(0.1 mmol)和10 mol%β-ICD(4)3.1 mg,加入4 mL硬质反应管中,加入CH2Cl21.0 mL,搅拌下反应5 min(TLC监测)。经硅胶柱层析[洗脱剂:V(乙酸乙酯)/V(石油醚)=1/5~1/3]纯化得3a46.8 mg。
用类似的方法合成3b~3j。
化合物3a: 白色固体,收率92%, >99/1dr, 97%ee;1H NMR(400 MHz, CDCl3)δ: 1.52(s, 9H), 2.81(s, 3H), 4.24(q,J=9.5 Hz, 1H), 6.56(d,J=7.7 Hz, 1H), 7.00(t,J=7.5 Hz, 1H), 7.09(t,J=7.5 Hz, 1H), 7.18(s, 1H), 7.25(t,J=7.4 Hz, 2H), 7.31(d,J=7.5 Hz, 1H), 7.58(t,J=8.1 Hz, 2H);13C NMR(100 MHz, CDCl3)δ: 26.4, 28.0, 57.1(q,J=30.7 Hz, 1C), 60.0, 69.6, 85.0, 108.5, 112.6, 114.5, 119.4, 120.3, 121.2, 123.2, 123.7(d,J=278.2 Hz, 1C), 124.4, 126.6, 127.5(d,J=3.8 Hz, 1C), 130.4, 131.1, 139.8, 144.4, 146.2, 147.9, 171.6, 174.6。
化合物3b: 白色固体,收率87%, >99/1dr, 97%ee;1H NMR(400 MHz, CDCl3)δ: 1.52(s, 9H), 2.28(s, 3H), 2.79(s, 3H), 4.22(q,J=9.7 Hz, 1H), 6.44(d,J=7.6 Hz, 1H), 7.02~7.12(m, 3H), 7.16(s, 1H), 7.24(t,J=7.6 Hz, 1H), 7.58(d,J=7.6 Hz, 2H);13C NMR(100 MHz, CDCl3):δ21.3, 26.5, 28.0, 57.3(q,J=30.9 Hz, 1C), 59.9, 69.6, 85.0, 108.2, 112.7, 114.6, 119.6, 120.4, 121.1, 123.7(d,J=278.8 Hz, 1C), 124.4, 127.3, 127.6(d,J=3.5 Hz, 1C), 130.3, 131.3, 132.7, 139.8, 141.9, 146.0, 148.0, 171.5, 174.7。
化合物3c: 白色固体,收率92%, >99/1dr, 99%ee;1H NMR(400 MHz, CDCl3)δ: 1.58(s, 9H), 2.83(s, 3H), 4.23(dd,J=19.0 Hz, 9.4 Hz, 1H), 6.51(d,J=8.3 Hz, 1H), 7.10(t,J=7.6 Hz, 1H), 7.20(s, 1H), 7.24~7.30(m, 2H), 7.33(s, 1H), 7.56(d,J=7.6 Hz, 1H), 7.70(d,J=8.0 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 26.6, 27.9, 57.4(q,J=30.6 Hz, 1C), 59.8, 69.4, 85.6, 109.5, 112.4, 114.7, 118.9, 120.0, 122.9, 123.6(d,J=279.0 Hz, 1C), 124.5, 127.0, 127.5, 128.5, 130.6, 131.2, 140.0, 143.0, 146.6, 148.1, 171.2, 174.3。
化合物3d: 淡黄色固体,收率91%, >99/1dr, 99%ee;1H NMR(400 MHz, CDCl3)δ: 1.54(s, 9H), 3.19(s, 3H), 4.26(q,J=9.5 Hz, 1H), 6.93(t,J=7.6 Hz, 1H), 7.14(t,J=7.4 Hz, 1H), 7.19~7.22(m, 3H), 7.32(t,J=7.6 Hz, 1H), 7.54(d,J=7.6 Hz, 1H), 7.66(d,J=8.4 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 28.0, 30.0, 57.0(q,J=30.9 Hz, 1C), 60.4, 69.2, 85.2, 112.4, 114.6, 115.8, 118.8, 120.0, 123.7(d,J=278.8 Hz, 1C), 123.8, 124.0, 124.5, 125.2, 127.5(d,J=3.4 Hz, 1C), 130.7, 133.4, 139.7, 140.3, 146.5, 147.8, 171.9, 174.2。
化合物3e: 白色固体,收率93%, >99/1dr, 99%ee;1H NMR(400 MHz, CDCl3)δ: 1.60(s, 9H), 2.83(s, 3H), 4.22(d,J=9.6 Hz, 1H), 6.47(d,J=8.4 Hz, 1H), 7.11(t,J=7.4 Hz, 1H), 7.20(s, 1H), 7.28(t,J=7.6 Hz, 1H), 7.41(d,J=8.0 Hz, 1H), 7.46(s, 1H), 7.56(d,J=7.6 Hz, 1H), 7.71(d,J=8.0 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 26.6, 28.0, 57.5(q,J=30.8 Hz, 1C), 59.9, 69.3, 85.6, 110.0, 112.4, 114.8, 115.8, 119.0, 120.0, 123.3, 123.6(d,J=278.7 Hz, 1C), 124.5, 127.5(d,J=3.5 Hz, 1C), 129.7, 130.6, 134.1, 139.9, 143.5, 146.6, 148.1, 171.1, 174.3。
化合物3f: 淡黄色固体,收率95%, >99/1dr, 99%ee;1H NMR(400 MHz, CDCl3)δ: 1.54(s, 9H), 3.20(s, 3H), 4.26(q,J=9.6 Hz, 1H), 6.86(t,J=7.8 Hz, 1H), 7.14(t,J=7.4 Hz, 1H), 7.21(s, 1H), 7.25(d,J=7.6 Hz, 1H), 7.33(t,J=7.8 Hz, 1H), 7.38(d,J=8.4 Hz, 1H), 7.53(d,J=7.6 Hz, 1H), 7.66(d,J=8.4 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 27.0, 28.0, 57.0(q,J=30.9 Hz, 1C), 60.5, 69.2, 85.2, 102.5, 112.4, 114.6, 118.8, 120.0, 123.7(d,J=278.9 Hz, 1C), 124.0, 124.3, 124.4, 125.7, 127.5(d,J=3.5 Hz, 1C), 130.7, 136.7, 139.7, 141.7, 146.6, 147.8, 172.1, 174.2。
化合物3g: 白色固体,收率97%, 99/1dr, 99%ee;1H NMR(400 MHz, CDCl3)δ: 0.78(t,J=7.0 Hz, 3H), 1.52(s, 9H), 3.16~3.24(m, 1H), 3.60~3.68(m, 1H), 4.25(q,J=9.6 Hz,1H), 6.59(d,J=8.0 Hz, 1H), 6.99(t,J=7.4 Hz, 1H), 7.10(t,J=7.6 Hz, 1H), 7.17(s, 1H), 7.25(t,J=7.6 Hz, 2H), 7.32(d,J=7.6 Hz, 1H), 7.61(d,J=7.6 Hz, 2H);13C NMR(100 MHz, CDCl3)δ: 12.1, 28.0, 35.1, 57.2(q,J=30.8 Hz, 1C), 59.9, 69.3, 85.0, 108.6, 112.6, 114.4, 119.6, 120.3, 121.5, 123.0, 123.8(d,J=278.7 Hz, 1C), 124.5, 126.9, 127.9(d,J=3.7 Hz, 1C), 130.3, 131.0, 140.0, 143.6, 146.0, 147.9, 171.0, 174.6。
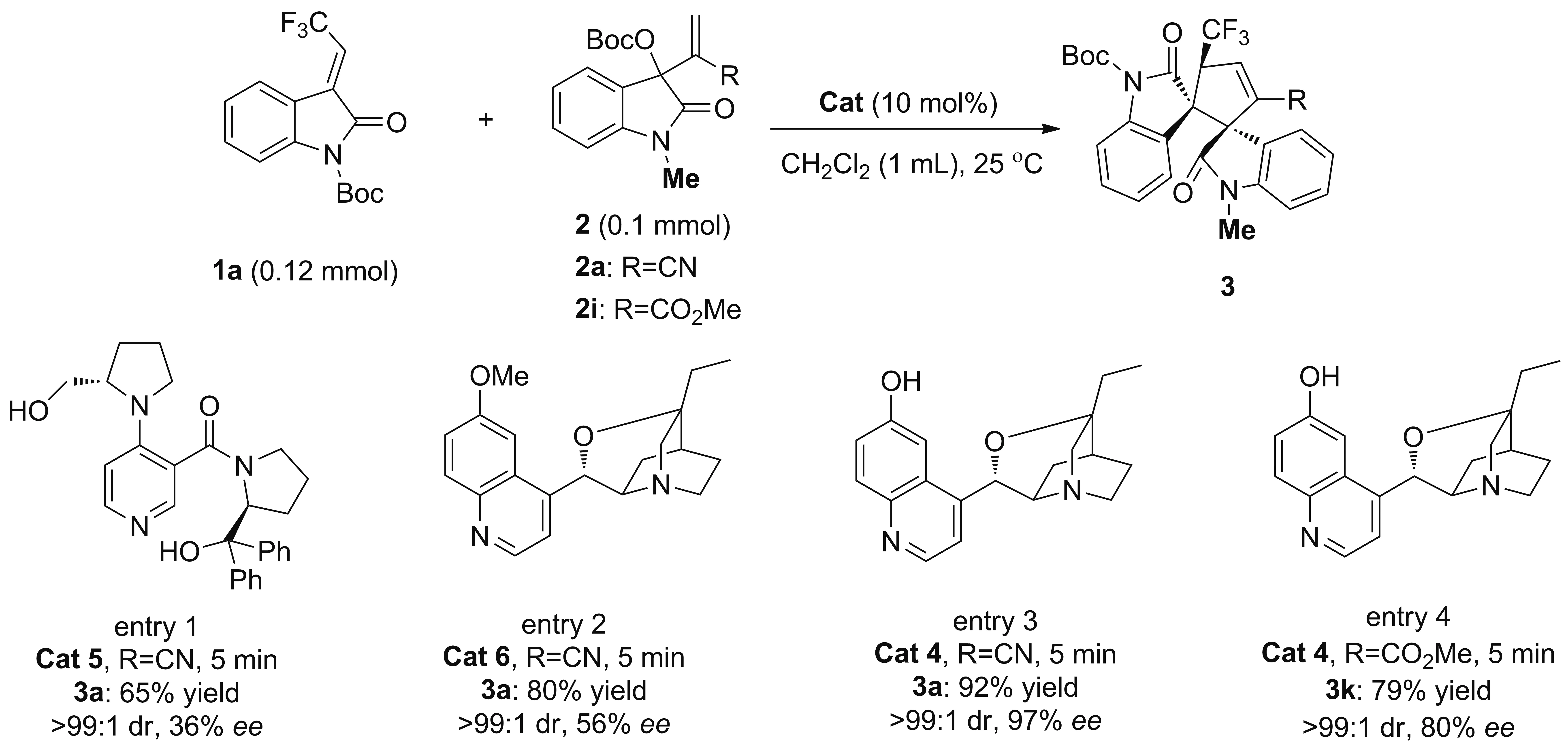
Scheme 3
化合物3h: 白色固体,收率96%, >99/1dr, 99%ee;1H NMR(400 MHz, CDCl3)δ: 1.53(s, 9H), 3.76(dd,J=16.2 Hz, 4.4 Hz, 1H), 4.23~4.31(m, 2H), 4.57(d,J=17.2 Hz, 1H), 4.92(d,J=10.0 Hz, 1H), 5.24~5.31(m, 1H), 6.57(d,J=7.6 Hz, 1H), 7.00(t,J=7.4 Hz, 1H), 7.08(t,J=7.4 Hz, 1H), 7.18(s, 1H), 7.23~7.28(m, 2H), 7.34(d,J=7.6 Hz, 1H), 7.59(d,J=8.0 Hz, 1H), 7.64(d,J=8.4 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 28.0, 42.7, 57.3(q,J=31.0 Hz, 1C), 59.8, 69.4, 85.0, 109.6, 112.5, 114.5, 117.7, 119.7, 120.4, 121.2, 123.2, 123.8(d,J=279.9 Hz, 1C), 124.7, 126.8, 128.0(d,J=3.6 Hz, 1C), 130.0, 130.3, 131.0, 139.9, 143.8, 146.0, 148.0, 171.2, 174.6。
化合物3i: 白色固体,收率98%, >99/1dr, 96%ee;1H NMR(400 MHz, CDCl3)δ: 1.52(s, 9H), 2.30(s, 3H), 2.82(s, 3H), 4.22(d,J=9.6 Hz, 1H), 6.55(d,J=7.6 Hz, 1H), 6.98(t,J=7.6 Hz, 1H), 7.05(d,J=8.4 Hz, 1H), 7.18(s, 1H), 7.24(t,J=8.0 Hz, 1H), 7.31(d,J=7.6 Hz, 1H), 7.37(s, 1H), 7.46(d,J=8.0 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 21.2, 26.3, 28.0, 57.1(q,J=30.9 Hz, 1C), 60.0, 69.6, 84.8, 108.4, 112.7, 114.2, 119.3, 120.2, 121.2, 123.1, 123.7(d,J=278.8 Hz, 1C), 126.6, 127.8(d,J=3.4 Hz, 1C), 130.8, 131.0, 134.1, 137.4, 144.4, 146.3, 148.0, 171.6, 174.7。
化合物3j: 白色固体,收率68%, 97/3dr, >99%ee;1H NMR(400 MHz, CDCl3)δ: 1.51(s, 9H), 2.89(s, 3H), 4.27(q,J=9.6 Hz, 1H), 6.64(d,J=7.6 Hz, 1H), 7.03(q,J=8.4 Hz, 2H), 7.17(s, 1H), 7.24~7.32(m, 3H), 7.52(d,J=7.6 Hz, 1H);13C NMR(100 MHz, CDCl3)δ: 26.6, 27.6, 57.3(q,J=30.9 Hz, 1C), 60.4, 69.0, 86.3, 108.8, 112.4, 118.0, 119.9, 121.2, 123.6(d,J=279.8 Hz, 1C), 123.7, 123.8, 124.8, 126.4(d,J=3.3 Hz, 1C), 126.8, 131.2, 132.0, 137.2, 144.2, 145.4, 146.6, 171.5, 174.1。
2 结果与讨论
2.1 反应条件的筛选与优化
以2a与1a的反应为模板反应,考察了脯氨酸衍生物(5)与金鸡纳碱衍生物(4和6)的催化效果(Scheme 3)。结果表明,金鸡纳碱类手性胺的催化效果较脯氨酸类好,而且金鸡纳碱喹啉环上的酚羟基为自由状态时,催化效果更好,说明自由羟基可能通过氢键作用在底物活化和手性控制中起着关键作用(Entry 2, 3)。此外,将MBH-碳酸酯中的CN换成CO2Me时,反应的活性和对映选择性明显降低(Entry 4)。
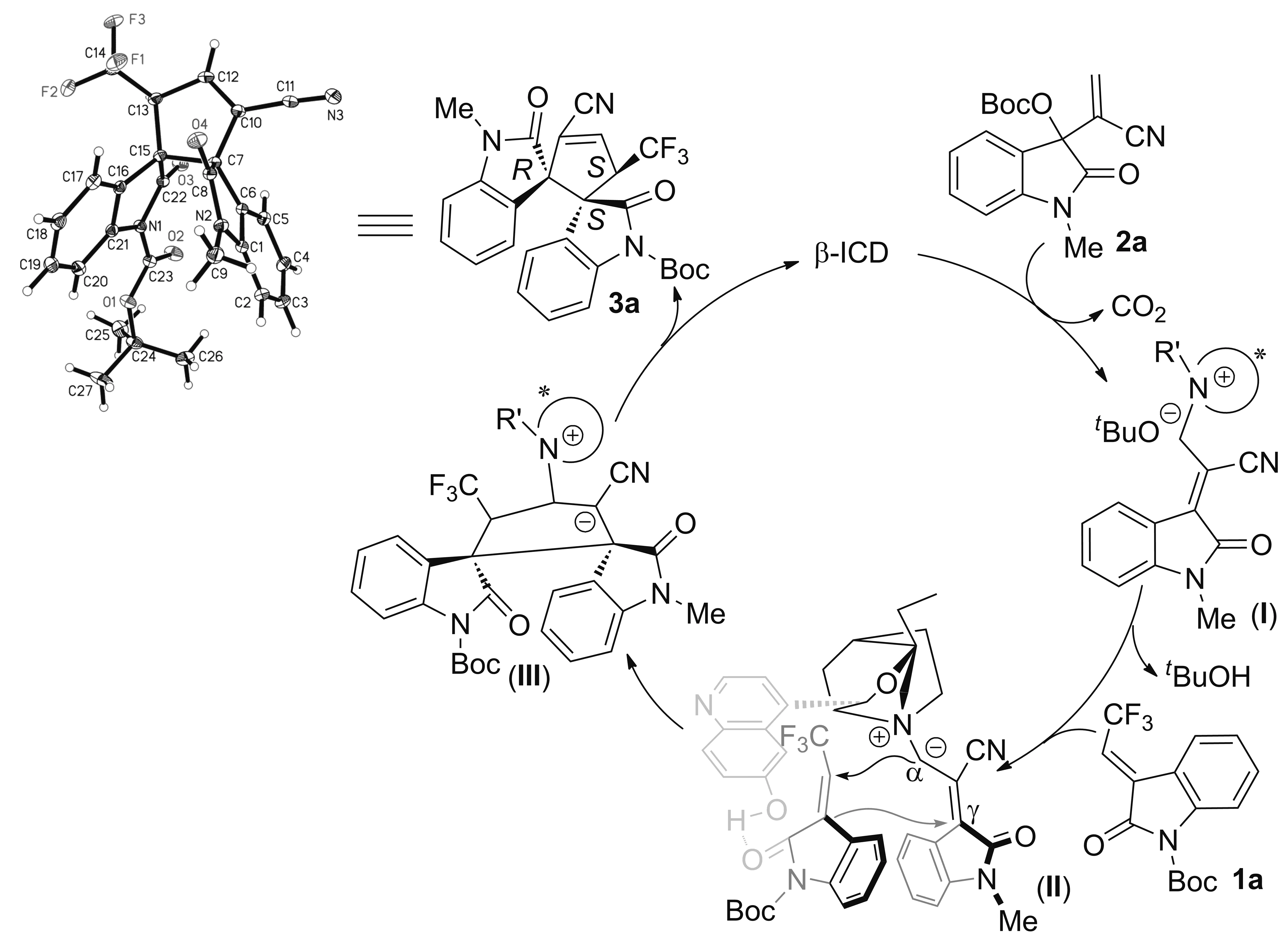
Scheme 4
2.2 底物的适应性
表1为底物的适应性。由表1可知,无论靛红衍生的MBH-碳酸酯的苯环上连有给电子基还是吸电子基以及取代基的位置不同,底物的适应性均较好(Entry 2~6)。此外,对MBH-碳酸酯N1-位取代基的考察表明,将甲基换成其他烷基取代基(包括Et, allyl)时,产物的分离收率和立体选择稍有提升(Entry 7, 8)。通过对3-(2,2,2-三氟次乙基)氧化吲哚底物的普适性探索发现,当氧化吲哚苯环上引入给电子基或吸电子基时,也能以较好的产率和立体选择性获得目标产物(Entry 9, 10)。
2.3 反应机理
通过对化合物3a进行单晶培养,用单晶X-射线衍射确定了产物的绝对构型为(C7R, C13S, C15S)。在此基础上,以模板反应为例,提出了β-ICD催化靛红衍生的MBH-碳酸酯与3-(2,2,2-三氟次乙基)氧化吲哚的不对称[3+2]环加成反应的可能机理(Scheme 4)[21]。首先,手性胺作为亲核试剂与2a发生共轭加成反应,此过程通过消除CO2生成叔胺正离子(I);在碱的作用下,叔胺正离子(I)的α-位去质子化生成亚胺叶立德中间体(II);手性催化剂中游离的羟基通过与3-(2,2,2-三氟次乙基)氧化吲哚1a中的羰基形成氢键用于活化底物1a和形成特定的手性环境,接着,中间体(II)的α-位(碳负离子)对受体1a的缺电子的不饱和碳(CF3取代的双键碳原子)进行不对称共轭加成和环化串联作用产生中间体(III),中间体(III)最后经消除作用产生催化剂4和产物3a,完成整个催化循环。
3 结论
通过手性胺(β-ICD)催化靛红衍生的MBH-碳酸酯与3-(2,2,2-三氟次乙基)氧化吲哚的不对称[3+2]环加成反应,实现了系列含三氟甲基的手性毗邻双螺环氧化吲哚类化合物的不对称合成,产物的分离收率高达98%,非对映选择性和对映选择性分别高达>99/1和>99%。本研究丰富了螺环氧化吲哚类化合物种类,为后续开展生物活性研究奠定了基础。
