新型非对称二苯并[b,f][1,5]二氮杂环辛四烯的合成
2020-06-04李正义李如洲孙小强
李正义, 李如洲, 殷 乐, 孙小强
(常州大学 石油化工学院 江苏省绿色催化材料与技术重点实验室,江苏 常州 213164)
二苯并[b,f][1,5]二氮杂环辛四烯化合物是八元环结构中的一类典型代表[1]。自十九世纪被发现以来,受到了研究人员的广泛关注[2]。该类化合物具有促雌激素分泌功能[3],其衍生物还可用于人造肌肉的构筑[4-5]、不对称催化[6]、电化学[7-11]等领域,因此二苯并[b,f][1,5]二氮杂环辛四烯及其衍生物已成为医药[12-14]、材料[15-16]、催化[17-18]等领域研究的热点。1896年Sondheimer首次以邻氨基二苯甲酮合成了二苯并[b,f][1,5]二氮杂环辛四烯,但由于当时条件的局限性,限制了这类化合物的发展[2];1955年发现了一种新的合成方法:以邻氨基苯甲酸甲酯为原料自身缩合得到环状二苯甲酰胺,再经过PCl5氯化制得6,12-二氯二苯并[b,f][1,5]二氮杂环辛四烯[19-20],此反应存在反应步骤多,反应时间长,后处理繁琐等缺陷;Chanda等[21]使用邻氨基二苯甲酮与苯乙炔在P2O5条件下反应生成二氮杂环辛四烯,此方法反应收率很低。但上述合成方法均只能得到对称结构产物。目前,非对称二苯并[b,f][1,5]二氮杂芳辛四烯衍生物的合成方法鲜有报道。1986年,Acharya等[22]使用异氰酸酯苯甲酰氯和苯通过Friedel-Crafts反应生成苯并恶嗪酮-三氯化铝配合物中间体,然后与邻氨基二苯甲酮开环聚合得到非对称二苯并[b,f][1,5]二氮杂芳辛四烯衍生物,但此反应原料制备困难且步骤较长;Bovenkerk等[13]使用溴代邻氨基二苯甲酮,先合成对称的二溴代二苯并[b,f][1,5]二氮杂环辛四烯,然后在n-BuLi作用下选择性脱单溴,最后与乙烯基硼酸酯经Suzuki-Miyaura反应合成非对称的单乙烯基取代二苯并[b,f][1,5]二氮杂芳辛四烯衍生物,该方法反应条件苛刻、步骤长、成本高。因此开发一种简便、高效的非对称二苯并[b,f][1,5]二氮杂芳辛四烯衍生物的合成方法具有重要意义和挑战性。最近,本课题组分别以邻氨基二苯甲酮、邻苯二甲酸酐和溴苯、邻氨基苯甲酸甲酯为原料,系统研究了3种合成二苯并[b,f][1,5]二氮杂芳辛四烯衍生物的方法[23]。

Scheme 1
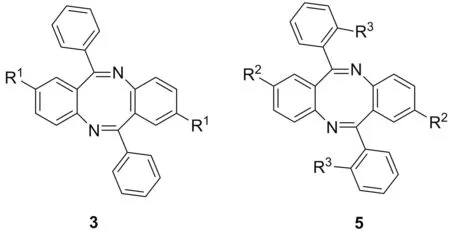
Chart 1
本文以两种不同取代2-氨基-二苯甲酮1和2为原料,通过分子间脱水一步环化缩合制得非对称二苯并[b,f][1,5]二氮杂环辛四烯(4, Scheme 1)。利用HPLC监控反应过程,优化反应条件,提升原料转化率的同时抑制对称产物3和5(Chart 1)的生成,得到了一种非对称二苯并[b,f][1,5]二氮杂环辛四烯4的最佳合成工艺。
1 实验部分
1.1 仪器与试剂
SGW X-4型显微熔点仪;AVANCE 300 MHz型核磁共振仪(DMSO为溶剂,TMS为内标);Agilent 1260型高效液相色谱仪;Agilent 6540型质谱仪。
所用试剂均为分析纯。
1.2 4的合成通法
在单口瓶中依次加入110 mmol,210 mmol, BF3-Et2O 1.41 g(10 mmol)和氯苯50 mL,回流反应12 h。冷却至室温,减压蒸除溶剂,残余物经硅胶柱层析[洗脱剂:A=V(石油醚)/V(乙酸乙酯)=100/1]纯化得化合物4。
2,8-二氯-6-(2-氟苯基)-12-苯基二苯并[b,f][1,5]二氮杂环辛四烯(4a): 淡黄色固体1.80 g, 收率39%, m.p.181~182 ℃;1H NMR(300 MHz, DMSO)δ: 7.83(td,J=7.8 Hz, 1.8 Hz, 1H, ArH), 7.70~7.67(m, 2H, ArH), 7.61~7.41(m, 6H, ArH), 7.36~7.31(m, 1H, ArH), 7.26~7.20(m, 2H, ArH), 7.12~7.04(m, 3H, ArH);13C NMR(75 MHz, DMSO)δ: 168.0, 165.8, 161.0(d,J=252.0 Hz), 149.6, 149.3, 136.8, 134.3(d,J=8.3 Hz), 132.4, 131.7, 130.7, 130.6, 129.7, 129.3, 129.2, 128.9, 128.6, 128.2, 127.2, 126.1, 126.0, 125.2(d,J=3.0 Hz), 123.02, 123.00, 117.2(d,J=21.0 Hz); HR-MS(ESI)m/z: Calcd for C26H15N2FCl2{[M+H]+}445.0596, found 445.0599。
2-氯-6-(2-氟苯基)-12-苯基二苯并[b,f][1,5]二氮杂环辛四烯(4b): 淡黄色固体2.64 g, 收率61%, m.p.162~163 ℃;1H NMR(300 MHz, DMSO)δ: 7.85(td,J=7.5 Hz, 1.2 Hz, 1H, ArH), 7.70~7.68(m, 2H, ArH), 7.61~7.52(m, 2H, ArH), 7.48~7.31(m, 5H, ArH), 7.26~7.13(m, 2H, ArH) 7.10~7.02(m, 4H, ArH);13C NMR(75 MHz, DMSO)δ: 168.9, 164.6, 160.5(d,J=251.6 Hz), 150.0, 149.5, 136.9, 133.6(d,J=8.8 Hz), 131.8, 131.23, 131.21, 130.2, 130.0, 129.6, 129.0, 128.7, 127.9, 127.3, 125.9, 125.8, 125.7, 125.6, 124.7(d,J=3.2 Hz), 124.3, 122.6, 120.6, 116.7(d,J=21.4 Hz); HR-MS(ESI)m/z: Calcd for C26H16N2FCl{[M+H]+}411.0534, found 411.0538。
2-氯-6,12-二苯基二苯并[b,f][1,5]二氮杂环辛四烯(4c): 淡黄色固体1.57 g, 收率39%, m.p.96~98 ℃;1H NMR(300 MHz, DMSO)δ: 7.67~7.63(m, 4H, ArH), 7.56~7.50(m, 2H, ArH), 7.48~7.40(m, 6H, ArH), 7.15(d,J=2.1 Hz, 1H, ArH), 7.11(dd,J=7.5 Hz, 0.9 Hz, 1H, ArH), 7.07~7.03(m, 3H, ArH);13C NMR(75 MHz, DMSO)δ: 169.4, 167.2, 151.0, 150.3, 136.9, 136.6, 131.7, 130.1, 130.0, 128.9, 128.8, 128.7, 128.6, 128.0, 127.9, 127.3, 126.7, 125.8, 123.9, 122.5, 120.5; HR-MS(ESI)m/z: Calcd for C26H17N2Cl {[M+H]+}392.1106, found 392.1101。
1.3 HPLC分析方法
Agilent ZORBAX Eclipse XDB C18型反相柱(250 mm×4.6 mm, 5 μm),流动相为[V(甲醇)/V(乙腈)/V(水)=1/7/2],流速为0.3 mL·min-1,柱温为35 ℃,进样量为10 μL,检测波长为254 nm。
2 结果与讨论
2.1 反应条件优化
以1a和2a的反应为模型反应,分别考察溶剂、原料配比、脱水剂种类和用量对反应选择性和活性的影响。由于化合物3a~5a结构相似,一般的薄层色谱(TLC)难以监控原料的转化及产物分布情况,本文利用HPLC监控反应过程,使用面积归一法确定反应体系中各主要组分1a~5a的相对含量,用以表征目标产物4a的选择性和原料的转化情况。
(1) 溶剂
1a10 mmol,2a10 mmol, BF3-Et2O为脱水剂,回流反应12 h,其余反应条件同1.2,考察溶剂对4a选择性和反应活性的影响,结果见表1。当甲苯作溶剂,非对称产物4a相对含量偏低,且原料转化率较低,可能是由于甲苯沸点相对较低,不利于分子间的脱水;用二甲苯和溴苯作溶剂时,温度升高,选择性有所提升,但原料残留仍较多;氯苯作溶剂时,非对称产物4a的选择性(46.94%)和原料的转化率均最佳。
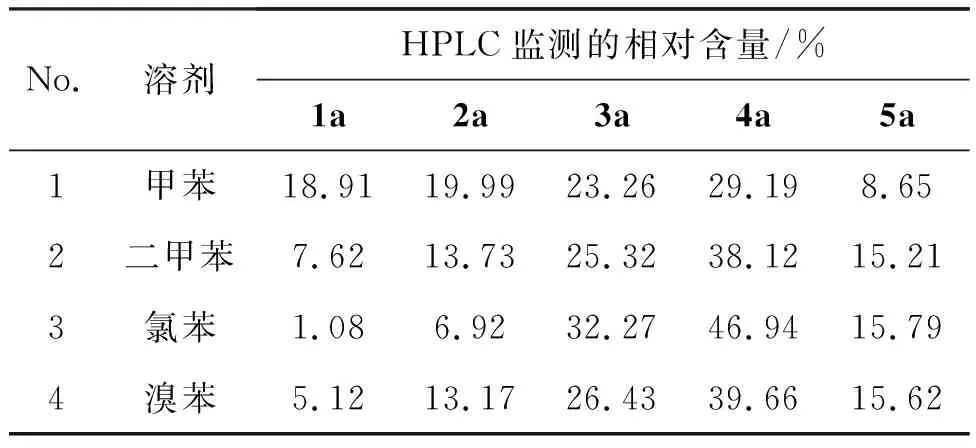
表1 溶剂对4a选择性和反应活性的影响
(2) 原料配比
以氯苯为溶剂,其余反应条件同1.2,考察两种原料配比对4a选择性和反应活性的影响,结果见表2。无论1a或2a过量时,均会导致相应的自身环化缩合对称产物3a或5a增多,因此较适宜的原料配比为[n(1a)/n(2a)=1/1]。
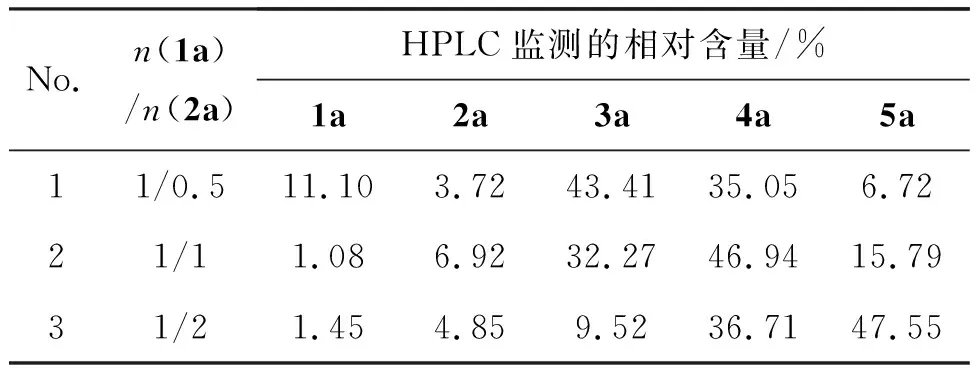
表2 原料配比对4a选择性和反应活性的影响
(3) 脱水剂
以氯苯为溶剂,原料配比为[n(1a)/n(2a)=1/1,其余反应条件同1.2,考察脱水剂对4a选择性和反应活性的影响,结果见表3。无水Na2SO4、浓H2SO4和4Å分子筛的脱水效果较差,原料残留较多;BF3-Et2O和P2O5脱水效果相对较好,BF3-Et2O更佳且对4a选择性最好,可能是因为BF3-Et2O在缩合反应中既充当脱水剂又充当催化剂的原因[24]。
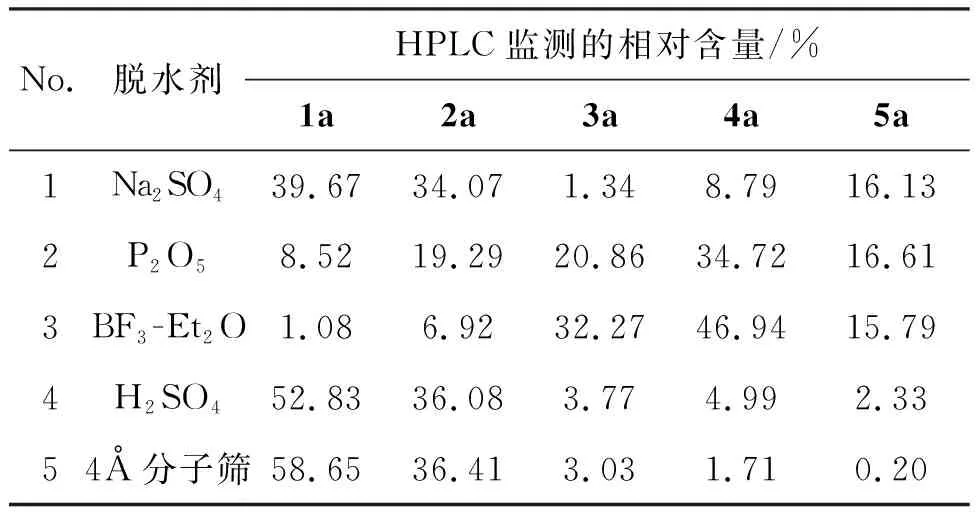
表3 脱水剂对4a选择性和反应活性的影响
(4) BF3-Et2O用量的筛选
1a10 mmol,2a10 mmol,BF3-Et2O为脱水剂,考察脱水剂用量对4a选择性和反应活性的影响,结果见表4。当BF3-Et2O用量为10 mmol时,4a相对含量较高(46.94%)。降低脱水剂用量,原料转化率下降;继续增加脱水剂用量,原料转化率和4a选择性反而下降,这可能是由于过量的脱水剂覆盖在原料表面,不利于分子间发生脱水反应所致。
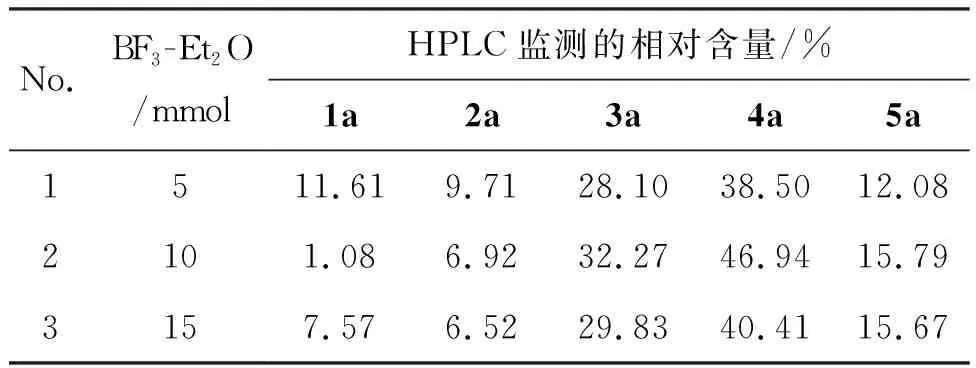
表4 脱水剂用量对4a选择性和反应活性的影响
2.2 底物拓展
以氯苯为溶剂,两种不同取代2-氨基二苯甲酮的物质量比为1/1,以等物质量的BF3-Et2O为脱水剂,回流反应12 h,得到了3个非对称二苯并[b,f][1,5]二氮杂环辛四烯化合物。结果表明,4b的收率(61%)明显高于4a和4c的收率(均为39%),这可能是由于用于制备4b的两种2-氨基二苯甲酮的反应活性相对较高:首先,原料1b中氨基所在苯环对位上没有氯原子,不会使氨基钝化;其次,原料2b中苯环上氟原子的吸电子作用使羰基活化。此外,本课题曾报道对称二苯并[b,f][1,5]二氮杂环辛四烯具有面手性,成功拆分并详细研究了其立体化学[23,25],同样手性HPLC分析表明非对称二苯并[b,f][1,5]二氮杂环辛四烯(4a~4c)也存在一对光学活性对映体。
以两种不同取代2-氨基二苯甲酮为原料,BF3-Et2O为脱水剂,分子间环化缩合一步制得非对称二苯并[b,f][1,5]二氮杂环辛四烯。利用HPLC监控反应过程,优化反应条件,得到最佳合成工艺条件是:以氯苯为溶剂,两种不同取代2-氨基二苯甲酮和BF3-Et2O等物质量,回流反应。该研究为非对称二苯并[b,f][1,5]二氮杂环辛四烯衍生物的合成提供了一种件简便、高效的制备方法。
