猫爪草纳米乳喷雾剂的制备及对慢性咽炎大鼠模型的影响研究
2020-06-05曾春姣1陈玲珑2婷1李跃辉3
曾春姣1 陈玲珑2 刘 婷1 李跃辉3
1.湘潭医卫职业技术学院,湖南 湘潭 411000;2.湖南省中医药研究院附属医院,湖南 长沙 410006;3.湖南省中医药研究院,湖南 长沙 410006
慢性咽炎为咽部黏膜、黏膜下及淋巴组织的弥漫性炎症,常为上呼吸道慢性炎症的一部分[1]。该病多见于成年人,症状顽固,病程长,不易治愈[2]。近年来,该病的发病率持续上升,患者主要表现为咽腔发痒、干燥、刺激性咳嗽等临床症状,导致患者食欲减退、睡眠不佳、失眠等后果,给人们的身心健康造成了严重危害。目前临床对于该病的治疗手段,西医常以化学药物为主,如抗生素、组胺和糖皮质激素等,但这些药物多具一定的毒副作用,且仅对症治疗,疗效欠佳,对于病因复杂的慢性咽炎的治疗往往是治标不治本。中医对于慢性咽炎的治疗毒副作用小,善于从多途径入手治疗,治愈率一般较好,且病情不易反复,具有独特优势。而从现阶段看来,治疗慢性咽炎的中药单方或复方内服制剂均已取得了较好的成绩,而治疗此类疾病效优的外用制剂仍比较缺乏。
猫爪草Ranunculi Ternati Radix属于我国重点发展的三类药材之一,具有清热解毒、消肿散结、止咳祛痰等功效[3-4],临床用于治疗肺结核、淋巴结结核、咽喉炎、肿瘤、疟疾等症[5-6]。现代研究[7]表明,猫爪草主要含有黄酮类、苷类、挥发油、有机酸等,其中黄酮类成分含量丰富,且具有镇咳、祛痰、消炎作用。目前,临床上常用的猫爪草的制剂主要以颗粒剂和水煎汤剂为主,由于咽喉黏膜的特点为穿透性较高且酶相对较少,但药物滞留时间短,为了延长猫爪草在咽喉黏膜的滞留时间,提高其生物利用度,将其开发成使用便利、效果上佳的纳米乳喷雾剂来弥补其内服制剂的缺陷[8-9],对治疗慢性咽炎十分有益。迄今为止有关猫爪草的外用剂型仍鲜有研究,其纳米乳喷雾剂剂型亦涉及较少。该项目已成功通过正交试验法优选了猫爪草总黄酮的最佳醇提工艺,为促进猫爪草药材的进一步开发利用,本文中拟利用伪三元相图制备出猫爪草纳米乳喷雾,并初步观察了猫爪草纳米乳喷雾对慢性咽炎大鼠模型的影响,以期为该制剂的研发提供依据。
1 仪器与试药
1.1 试剂与样品 猫爪草药材(昌都振兴中药饮片实业有限公司,批号18053002)、猫爪草提取物(自制,批号:20181126);聚氧乙烯醚氢化蓖麻油(RH40)(批号:20170613)、山梨醇酐油酸酯-80(司盘80)(批号:20170911)、聚山梨酯-80(吐温80)(批号:20170809)、肉豆蔻酸异丙酯(IPM)(批号:20170718)、油酸乙酯(批号:20170820)、蓖麻油聚氧乙烯醚(EL-40)(批号:20170824)、液体石蜡(批号:20170911)、卵磷脂(批号:20170628)均购自武汉远成共创科技有限公司;丙三醇(批号:000120170104)、丙二醇、和1,3-丁二醇均购自中国医药集团上海化学试剂公司、猫爪草纳米乳喷雾剂(湖南省中医药研究院制剂室提供,批号20190325)、复方一枝黄花喷雾剂(贵州百灵企业集团制药股份有限公司,批号20180415,国药准字Z20025898)。
1.2 仪器 YP5102型电子天平(上海光正医疗有限公司);78HW-1型恒温磁力搅拌器(杭州仪表电机厂);DK-98-Ⅱ恒温水浴锅(天津市泰斯特仪器有限公司);SKP02.420型电热恒温培养箱(黄石恒丰医疗器械有限公司);BCD-208K型冰箱(青岛海尔股份有限公司);JEM-1230型电子显微镜(日本电子公司);TGL-16B台式高速离心机(湖南星科科学仪器有限公司);UV-2450型紫外分光光度计(上海奥析科学仪器有限公司);ZEN3690 粒子检测仪(马尔文仪器有限公司);电子天平(梅特勒-多仪器有限公司);病理图像分析仪(OLYMPUSDP71,奥林巴斯映像销售有限公司);HX2002T电子天平(慈溪市天东衡器厂);LEICABM2135型石蜡切片机。
1.3 动物 SPF级SD大鼠60只,体重180~200 g,雌雄各半,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2016-0002,饲养于湖南省中医药研究院实验动物中心,所有实验动物于SPF级屏障环境中饲养,饲养环境通风良好,室温20~25℃,相对湿度55%~75%,12 h光照昼夜循环。
2 方法与结果
2.1 猫爪草纳米乳的制备工艺研究
2.1.1 猫爪草提取物的制备 以总黄酮提取量和浸膏得率的综合评分为评价指标,通过正交试验优选的猫爪草的提取工艺。按照已确定的工艺制备猫爪草提取物:在60°C的温度条件下,称取适量猫爪草粗粉加乙醇回流提取2次,第1次加8倍量75%乙醇提取1.5 h,第2次加7倍量75%乙醇提取1 h;合并两次提取液过滤,在温度为60~70℃和真空度为-0.08Mpa的条件减压浓缩干燥得猫爪草提取物。
2.1.2 溶解度试验 在预实验的基础上,比较猫爪草提取物在不同油相(IPM、油酸乙酯、液体石蜡、卵磷脂)、乳化剂(Tween-80、RH40、EL-40、Span-80)和助乳化剂(正丁醇、丙三醇、1,2-丙二醇、无水乙醇)中的溶解度。取上述12种辅料各2 mL分别置于具塞离心管中,每根离心管分别加入足量的猫爪草提取物,密封后置于涡旋混合器上涡旋20 min,使药物充分溶解,然后将混合物于3000 r/min的转速下离心15 min,吸取上清液1 mL,用甲醇稀释至50 mL,再吸取甲醇液3 mL,置于25 mL容量瓶中,加水3 mL,加5%NaNO2溶液1 mL,摇匀,放置6 min,加NaOH试液10 mL,再加水至刻度,摇匀,放置15分钟,以相应的试剂为空白,照紫外-可见分光光度法(《中国药典》2015年版四部通则0401),测定吸光度在500 nm波长处,测定总黄酮含量,计算猫爪草提取物的不同辅料中的溶解度。结果见表1。
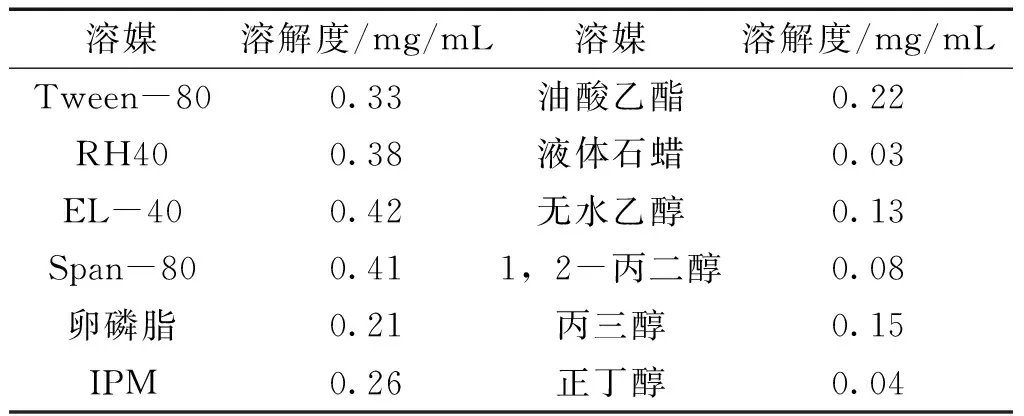
表1 猫爪草提取物在不同溶媒中的溶解度
为使制剂对药物有最大的增溶能力,必须选择对药物溶解度较大的油相、乳化剂和助乳化剂。由表1可知,猫爪草提取物在油相(IPM、油酸乙酯、卵磷脂)、乳化剂(EL-40、Span-80、RH40)和助乳化剂(丙三醇、无水乙醇)中溶解度较高;在助乳化剂中,猫爪草提取物在丙三醇的溶解度最大,且丙三醇的副作用少。故初步确定IPM、油酸乙酯、卵磷脂为纳米乳的备选油相;EL-40、Span-80、RH40为纳米乳的备选乳化剂,助乳化剂为丙三醇。
2.1.3 油相的确定 由上步溶解度试验确定丙三醇为本品纳米乳处方中的助乳化剂,将乳化剂(EL-40)和助乳化剂(丙三醇)按3∶1的质量比(Km)均匀混合成混合乳化剂,然后将混合乳化剂与油相(IPM、油酸乙酯和卵磷脂)按质量比 1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1比例分别混合,在磁力搅拌下,缓慢加入蒸馏水滴定,直至溶液呈稳定透明,记录体系变化时各相滴定终点的用量。采用Origin8.0软件,分别以水相、油相及混合乳化剂为3个顶点, 绘制伪三元相图,通过伪三元相图形成纳米乳面积区域的大小的方法来确定油相,结果见图1。
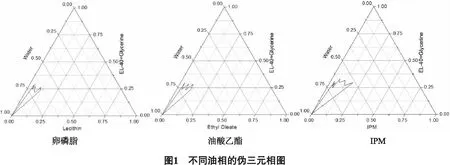
图1为Km为3∶1时,3种不同油相的伪三元相图,由此可见以IPM为油相时,形成的纳米乳面积最大,确定IPM作为本处方中纳米乳的油相。结合溶解度试验结果,选定油相为IPM,助乳化剂为丙三醇,进行后续试验。
2.1.4乳化剂的确定 将3种乳化剂(EL-40、Span-80、RH40)与助乳化剂(丙三醇)按3∶1的质量比(Km)均匀混合成混合乳化剂,再与油相(IPM)按质量比1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1比例分别混合,按“2.2.3”项下绘制伪三元相图,结果见图2。
图2为Km为3∶1时,3种不同乳化剂的伪三元相图,由此可见以EL-40为乳化剂时,形成的纳米乳面积最大,确定EL-40作为本处方中纳米乳的乳化剂。因此确定本处方中纳米乳的组成为:IPM(油相)-EL-40(乳化剂)-丙三醇(助乳化剂)。
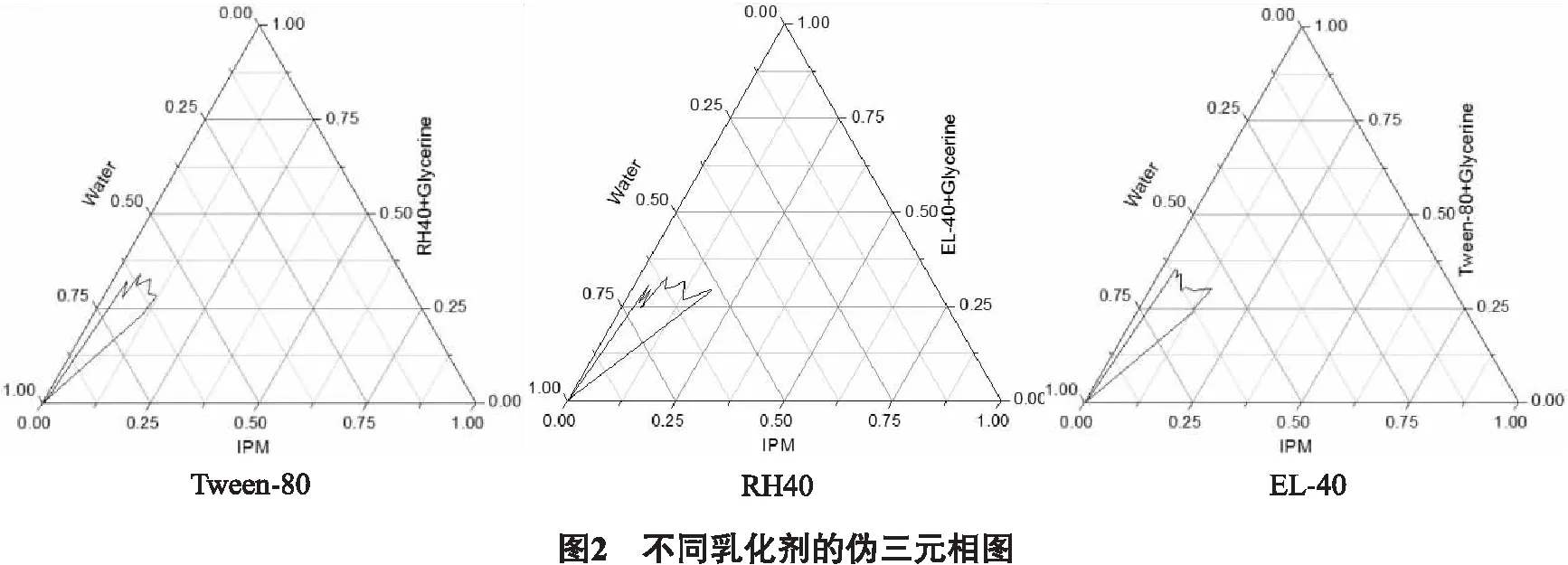
2.1.5 Km值的确定为进一步优化纳米乳的处方体系,考察不同Km对纳米乳化区域的影响,继续使用水滴定法绘制伪三元相图的办法确定最佳的纳米乳处方,将EL-40(乳化剂)与丙三醇(助乳化剂)按质量比(Km)为2∶1、3∶1、4∶1混合作为混合乳化剂,再与IPM(油相)按照1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1比例分别混合,按“2.2.3”项下绘制伪三元相图,结果见图3。
由伪三元图可知,当乳化剂和组乳化剂的质量比(Km)为3∶1时,形成的纳米乳区域最大,因此最终选择Km值为3∶1的纳米乳体系。
2.1.6 猫爪草纳米乳的制备 以IPM为油相,EL-40为乳化剂,丙三醇为助乳化剂,从Km值为3∶1的伪三元相图中选择处方,油相-乳化剂-助乳化剂=10∶21∶7∶60,精密称取除水以外的辅料,再精密称取猫爪草提取物适量加入上述辅料,37 ℃恒温水浴磁力搅拌使猫爪草提取物完全溶解,在搅拌下滴加处方量的水相,即得澄清透明猫爪草提取物纳米乳,装入冷喷壶即得猫爪草纳米乳喷雾剂。
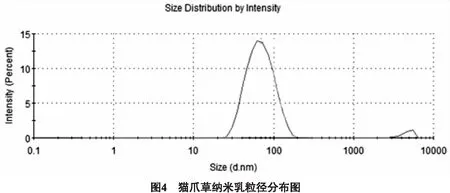
2.1.7 猫爪草纳米乳粒径的测定 取猫爪草纳米乳5 mL,使用激光粒度分析仪测定其粒径。以聚苯乙烯球形小珠士作为外标、光散射测定角度为90°进行测定。结果表明,猫爪草纳米乳的平均粒径为(84±3.12)nm,PDI为0.106。结果见图4。
2.1.8 猫爪草纳米乳稳定性研究 采用恒温加速试验考察,取猫爪草纳米乳于-5、25、45、65 ℃及相对湿度在75%的条件下保存,分别于5 d、10 d后,取样观察其外观;取猫爪草纳米乳于离心管中,10000 r/min离心25 min,考察其外观,结果如表2。
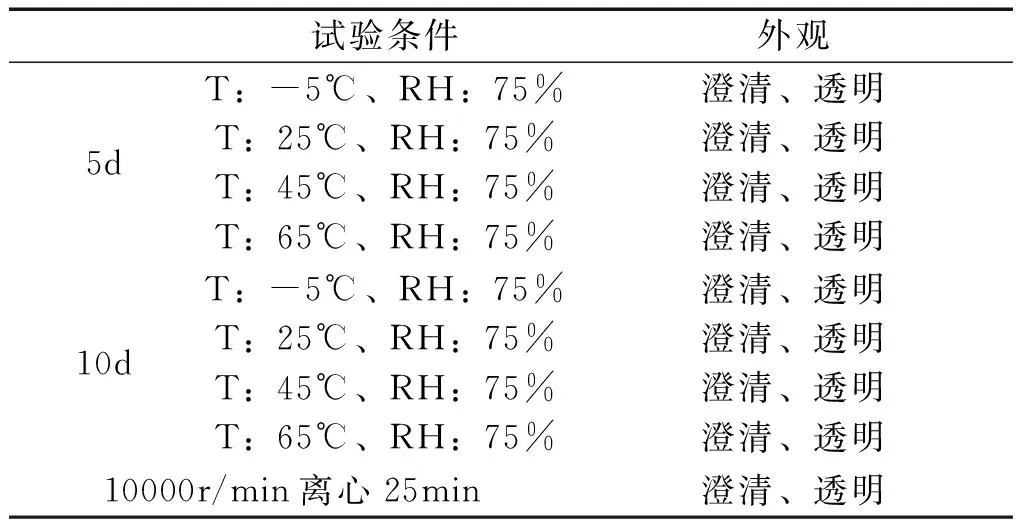
表2 猫爪草纳米乳稳定性考察结果
从上述试验结果可得知,猫爪草纳米乳在不同的环境中均能得到澄清透明的液体,表明猫爪草纳米乳稳定性良好。
2.2 猫爪草纳米乳对慢性咽炎大鼠模型的影响
2.2.1 造模及分组[10]取SPF级SD大鼠60只,雌雄各半,随机分空白组、模型组、阳性对照组(复方一枝黄花喷雾剂)、猫爪草高剂量组、猫爪草中剂量组、猫爪草低剂量组,共6组,每组10只。以苦味酸标记,并记录每只大鼠的重量,各组大鼠均用普通饲料喂养,自由饮水。阳性对照组、猫爪草高剂量组、猫爪草中剂量组、猫爪草低剂量组,上、下午各用2.5%氨水喷其咽部1次,每次用喷雾器喷3揿,连续15 d;空白组同法予蒸馏水喷咽部,连续15 d。每日观察大鼠的纳食、活动量、饮水量、口腔分泌物及有无搔抓口咽部动作等,并每日观察大鼠咽部1次。模型组于第16天用10%水合氯醛麻醉后,处死动物,分离咽部组织以供作病理切片观察。造模完成后,连续5 d参照李仪奎《中药药理实验方法学》中的人与动物剂量换算方法,阳性对照组每天按0.25 g/kg剂量给药;猫爪草高剂量组、猫爪草中剂量组、猫爪草低剂量组每天剂量按0.6 g/kg、0.3 g/kg、0.15 g/kg给药;空白组予同体积蒸馏水。
2.2.2 病理形态学观察 处死大鼠,分离咽部组织用10%中性甲醛固定,石蜡包埋切片,作常规石蜡切片,HE 染色,中性树脂封片,并于光镜下观察各 组大鼠咽组织病理变化,并进行病理评分[11]:观察标本是否有上皮细胞坏死脱落、炎细胞浸润、间质水肿等情况。其中炎细胞浸润计3分,出现上皮细胞坏死脱落计1分,间质水肿计1分。
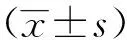
2.2.4 实验结果 猫爪草纳米乳对慢性咽炎大鼠咽部组织病理形态学的影响见图5和表3。
表3 猫爪草纳米乳喷雾剂对慢性咽炎大鼠模型病理学评分的影响 (分,
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
空白对照组: 咽部黏膜层次结构清晰,复层鳞状上皮光滑完整,表层角化过度,黏膜下层未见水肿,可见个别炎细胞浸润(图5-A)。
模型对照组: 咽部黏膜复层鳞状上皮坏死、脱落,黏膜下层增厚,间质水肿、血管扩张充血,大量炎细胞浸润(图5-B)。
阳性对照组、猫爪草高剂量组、猫爪草中剂量组:咽部黏膜复层鳞状上皮欠光滑,黏膜下层可见轻度水肿和血管扩张充血,散在少量炎细胞浸润(图5-C、D、E)。
猫爪草低剂量组: 咽部黏膜复层鳞状上皮局灶脱落,固有层及黏膜下层水肿,大量炎细胞浸润(图5-F)。
实验显示,与空白对照组比较,模型对照组大鼠病理学评分显著升高,差异有统计学意义(P<0.01);与模型对照组比较,阳性对照组、猫爪草高剂量组大鼠病理学评分显著降低,差异有统计学意义(P<0.01);猫爪草中剂量组大鼠病理学评分显著降低,差异有统计学意义(P<0.05)。
3 讨论
纳米乳又称微乳,是由水、油、表面活性剂和助表面活性剂等自发形成,粒径为1~100 nm的热力学稳定、各向同性,透明或半透明的均相分散体系,由于其便于制备、作为药物载体具有缓释和靶向的作用,从而备受关注[12-13]。伪三元相图法是目前国内、外研究微乳的主要手段之一[14],其主要目的是研究制备相图时微乳相及其它状态的分布区域情况,并考察不同组分配比时的性状变化。该法可以通过微乳相面积的大小来判定微乳体系的相对稳定程度,并通过选择微乳区域中含乳化剂较少的点来确定制备微乳的各组分的大致比例[15]。本实验通过溶解度考察筛选出了适合制备猫爪草纳米乳的油相、乳化剂和助乳化剂,采用水滴定法绘制伪三元相图确定油相和乳化剂种类及Km。将猫爪草提取物制备成纳米乳剂型后,所得纳米乳粒径小且呈正态分布,纳米乳系统稳定,性状良好,澄清透明,不易分层和絮凝。
为了初步考察猫爪草纳米乳对慢性咽炎的影响,本实验采用低浓度氨水直接喷雾法长时间刺激大鼠咽部黏膜,建立慢性咽炎大鼠模型,操作方法简单安全,是目前使用最广泛的模型建立方法[16]。实验结果显示:空白对照组咽部黏膜层次结构清晰,复层鳞状上皮光滑完整,表层角化过度,黏膜下层未见水肿,可见个别炎细胞浸润;模型对照组咽部黏膜复层鳞状上皮坏死、脱落,黏膜下层增厚,间质水肿、血管扩张充血,大量炎细胞浸润。经复方一枝黄花喷雾剂和猫爪草纳米乳喷雾剂干预后,慢性咽炎模型咽黏膜上皮细胞的增生和炎症细胞的浸润均有一定程度的缓解作用,动物咽部组织病理学评分显著降低,说明猫爪草纳米乳喷雾剂对慢性咽炎具有一定的疗效,本文将对该制剂的深入研发奠定实验基础。
