脯氨酰羧基肽酶和血管紧张素转化酶2在IgA肾病中的表达及其病理意义*
2020-06-03徐晋徉何常胡斌
徐晋徉, 何常, 胡斌
(贵州医科大学附属医院 病理科, 贵州 贵阳 550004)
IgA肾病是最常见的原发性肾小球疾病[1],其病理特征为肾活检免疫病理显示IgA或以IgA为主的免疫球蛋白及补体成分在肾小球系膜区呈弥漫性颗粒状或团块状沉积,有时可伴有毛细血管袢沉积,可引起一系列的临床及病理改变[2], 20%~40%的IgA肾病患者在20年内发展为终末期肾病(end-stage renal disease,ERSD)[3-4]。肾脏组织中除经典的肾素-血管紧张素系统(RAS),即循环RAS外,还有着独立的RAS系统。有研究显示,独立的RAS系统可能与肾脏的炎症疾病存在一定关系[5-6]。本研究以RAS系统为中心,选择RAS系统的2个相关蛋白脯氨酰羧基肽酶(prolylcarboxypeptidase,PRCP)、血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)为研究对象,观察其在IgA肾病患者的肾穿刺组织中的表达,分析PRCP、ACE2表达与各类型IgA肾病病变程度的关系,探讨RAS系统在IgA肾病的发生发展中的作用。
1 材料与方法
1.1 材料
1.1.1一般资料 收集54例医院病理科经肾穿刺活检明确诊断为IgA肾病患者的肾活检组织标本作为IgA肾病组。纳入标准:所有标本由一位高级职称病理医师独立阅片,所有标本均经苏木素-伊红(HE)染色、六胺银(PASM)染色、马松三色(Masson)染色、过碘酸雪夫(PAS)染色、结合IgG、IgA、IgM、C3、C1q、Fib、HbsAg、HbcAg、HP等免疫荧光染色以及电镜确诊为IgA肾病。排除由糖尿病、过敏性紫癜、乙型肝炎感染、肝硬化、系统性红斑狼疮、恶性肿瘤等系统性疾病引起的继发性肾小球疾病,排除先天性遗传性肾脏疾病,排除在本次肾脏穿刺明确诊断前有血管紧张素2受体阻滞剂(angiotensin receptor blocker,ARB)或血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)使用史患者,排除缺乏新鲜组织免疫荧光结果而采用石蜡组织免疫荧光辅助诊断者,排除光镜检查肾小球数量较少者及临床病理资料不完整者。54例IgA肾病组患者,男34例、女性20例,年龄12~76岁、中位年龄35岁;按其病变程度分型,局灶增生型20例、IgA肾病合并膜性肾病(membranous nephropathy,MN)20例、新月体型14例。另随机抽取20例经肾活检确诊为微小病变肾病(minimal change disease,MCD)患者为对照组,排除标准与IgA肾病组相一致,其中男16例、女4例,年龄13~65岁、中位年龄33岁。
1.1.2试剂及方法 一抗:兔抗人多克隆抗体PRCP(工作浓度1 ∶200),兔抗人多克隆抗体ACE2(工作浓度1 ∶200)购自北京百奥思科生物医学技术有限公司;二抗:通用二步法试剂盒PV-5000,购自北京中杉金桥生物技术有限公司;DAB显色试剂盒,购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1PRCP、ACE2表达 按照试剂盒说明书采用免疫组化法检测2组的肾穿刺组织的PRCP、ACE2表达,切片染色时使用PBS缓冲液替代一抗进行操作作为阴性对照。
1.2.2结果判定标准 每个标本切片分别选取肾小球区和肾小管区2个部位分别进行评估。(1)肾小管区:在显微镜下放大400倍摄取随机肾小管视野10个/高倍镜,对所选视野阳性信号用Image-pro Plus图像分析软件进行图像分析;以积分光密度(integral optical density,IOD)该值表示该成分在肾小管间质中的相对表达量[7-8]。(2)肾小球区:以阳性肾小球所占百分比和其染色强度2项评分之积来判断表达程度[9],染色强度分为4级评分,不着色(-)计1分,浅黄色(+)计2分,棕黄色(++)计3分,黄褐色(+++)计4分;阳性肾小球所占百分比分为6级评分,无阳性肾小球计0分,阳性率 ≤20%计1分,阳性率 21% ~40%计2分,阳性率 41%~60%计3分,阳性率 61%~80%计4分,阳性率≥81%计5分。每张切片分别由2位有经验的临床病理科医生单独读片,当2者之间存在差异时,通过同时使用双头显微镜以达成共识。(3)新鲜组织免疫荧光示免疫球蛋白及补体成分沉积量评估分为5级进行评分:(-)计0分、(+)计1分、(++)计2分、(+++)计3分、(++++)计4分[10]。
1.3 统计学方法
数据采用SPSS 23.0软件进行统计学分析,组间分析采用多个独立样本比较的秩和检验(Kruskal-WallisH检验);采用Spearman分析IgA肾病组PRCP、ACE2表达与各类型IgA肾病病变程度的关系;P<0.05为差异有统计学意义。
2 结果
2.1 PRCP、ACE2在肾组织中的分布
IgA肾病的镜下改变呈多样性,除系膜细胞及系膜基质增生以外,可以表现为内皮细胞增生、节段性硬化、新月体形成等,亦可见肾小管上皮细胞空泡和颗粒变性、刷状缘脱落、萎缩及肾间质水肿、纤维化等(见图1)。在对照组和IgA肾病组的肾组织中PRCP、ACE2均有不同程度的表达,在肾小管及间质区域中主要表达在肾小管上皮细胞,以胞质及胞膜为主,棕黄色呈弥散性分布,在肾间质血管中未见明显表达;在肾小球区域肾小球壁层、脏层上皮细胞均有表达,以胞膜为主,棕黄色呈线性或颗粒性分布,在新月体中增生的壁层上皮细胞多数呈高表达(见图2及图3)。
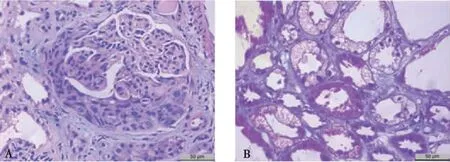
注:A为细胞性新月体,B为肾小管上皮细胞空泡和颗粒变性。
图1 IgA肾病的肾小球和肾小管病变
Fig.1 Glomerular and tubular lesions in IgA nephropathy
2.2 PRCP在肾小管区和肾小球区的表达
2.2.1肾小管区 经Kruskal-WallisH检验,IgA肾病组PRCP蛋白在肾小管区的表达高于对照组,差异有统计学意义(H=29.455,P<0.05);进一步比较PRCP蛋白在肾小管区的表达发现,IgA肾病组中局灶增生患者、合并MN患者显著高于对照组患者(P<0.05),IgA肾病组中新月体患者与对照组比较、局灶增生患者与合并MN患者比较、局灶增生患者与新月体患者比较,差异无统计学意义(P>0. 05)。提示PRCP在IgA肾病患者肾小管区的表达高于MCD患者,但随着疾病的进展至新月体型IgA肾病后,PRCP在肾小管区的表达下降至MCD患者水平。见图2及图4。
2.2.2肾小球区 经Kruskal-WallisH检验,IgA肾病组PRCP蛋白在肾小球区的表达高于对照组,差异有统计学意义(H=52.501,P<0.05);进一步比较PRCP蛋白在肾小球区的表达发现,IgA肾病组中局灶增生患者、合并MN患者、新月体患者均显著高于对照组患者(P<0.05),新月体患者显著高于局灶增生患者、合并MN患者(P<0.05)。提示PRCP在IgA肾病患者肾小球区的表达高于对照组患者,但随着疾病的进展,PRCP在肾小球区的表达量逐渐升高。见图2及图4。
2.3 ACE2在肾小管区和肾小球区的表达
2.3.1肾小管区 经Kruskal-WallisH检验,IgA肾病组ACE2蛋白在肾小球区的表达高于对照组,差异有统计学意义(H=23.669,P<0.05);进一步比较ACE2蛋白在肾小管区的表达发现,IgA肾病组中局灶增生患者显著高于合并MN患者和对照组患者(P<0.05),对照组与合并MN患者比较、局灶增生患者与合并MN患者比较、局灶增生患者与新月体患者比较、合并MN患者与新月体患者比较,差异无统计学意义(P>0.05)。提示ACE2仅在局灶增生型IgA肾病患者的肾小管区的表达高于对照组患者。见图3及图5。
2.3.2肾小球区 经Kruskal-WallisH检验,IgA肾病组ACE2蛋白在肾小球区的表达高于对照组,差异有统计学意义(H=56.087,P<0.05);进一步比较ACE2蛋白在肾小球区的表达发现,IgA肾病组中局灶增生患者、合并MN患者、新月体患者均显著高于对照组患者(P<0.05),新月体患者显著高于局灶增生患者、合并MN患者(P<0.05)。提示ACE2在IgA肾病患者肾小球区的表达高于对照组患者,但随着疾病的进展,ACE2在肾小球区的表达量逐渐升高。见图3及图5。

注:A、a为对照组,B、b为局灶增生,C、c为IgA肾病合并MN,D、d为新月体,其中a~d为肾小管区,A~B为肾小球区。
图2 IgA肾病组和对照组肾穿刺组织中PRCP蛋白表达(免疫组织化学,×400)
Fig.2 Protein expression in renal puncture tissue of IgA nephropathy group PRCP control group (immunohistochemistry,×400)
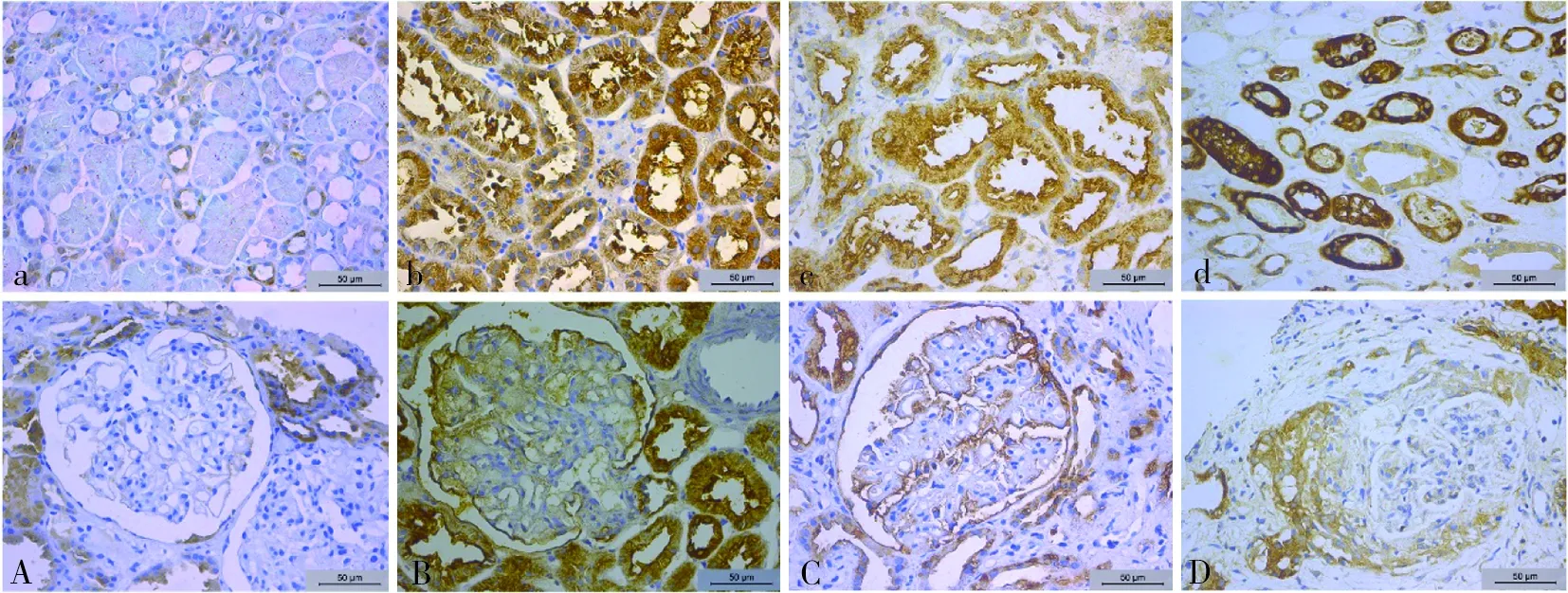
注:A、a为对照组,B、b为局灶增生,C、c为IgA肾病合并MN,D、d为新月体,其中a~d为肾小管区,A~B为肾小球区。
图3 IgA肾病组和对照组肾穿刺组织中ACE2蛋白表达(免疫组织化学,×400)
Fig.3 Expression of ACE2 protein in renal puncture tissue of IgA nephropathy group and control group (immunohistochemistry,×400)
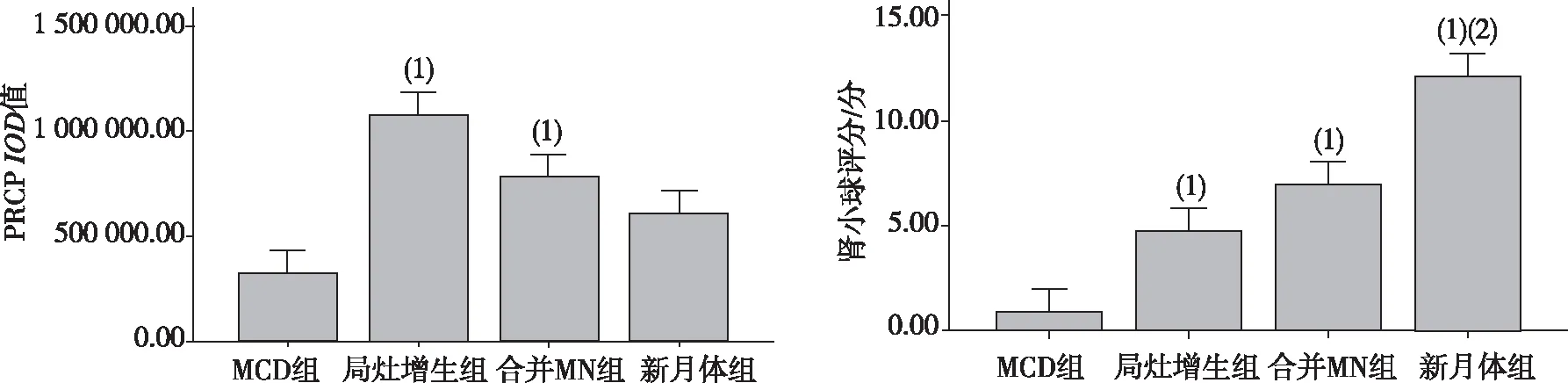
注:(1)与MCD组比较,P<0.05;(2)与局灶增生组比较,P<0.05。
图4 对照组和各IgA肾病组患者肾穿刺组织中PRCP蛋白表达IOD值及肾小球评分比较
Fig.4 Comparison ofIODvalues glomerular score of PRCP protein expression in renal puncture tissues of control group and nephrotic group
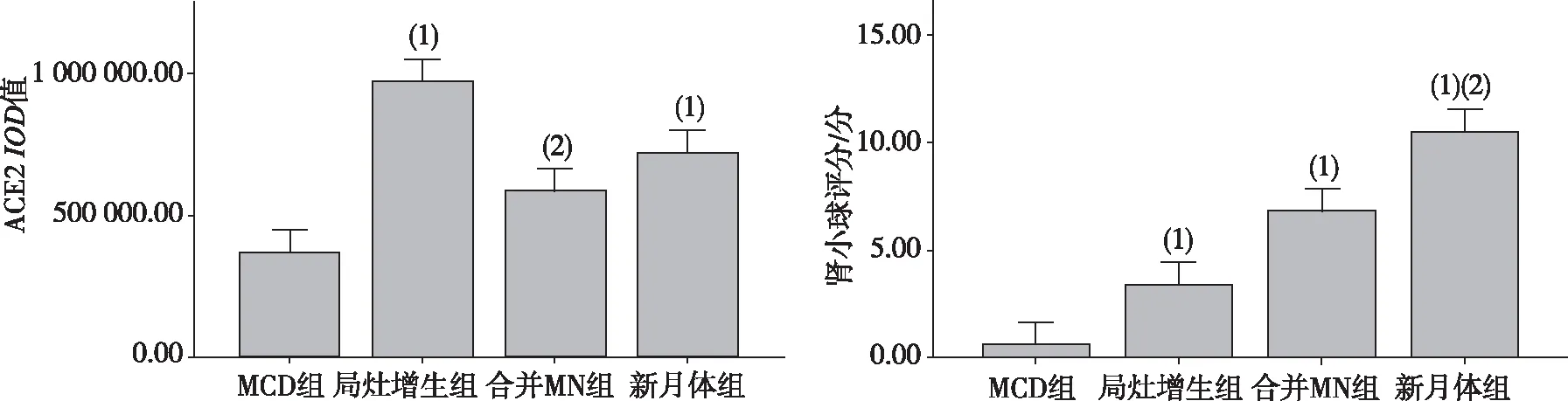
注:(1)与MCD组比较,P<0.05;(2)与局灶增生组比较,P<0.05。
图5 对照组和各IgA肾病组患者肾穿刺组织中ACE2蛋白表达IOD值及肾小球评分比较
Fig.5 Comparison ofIODvalues glomerular score of ACE2 protein expression in renal puncture tissues of control group and nephrotic group
2.4 IgA肾病患者组织中PRCP、ACE2的表达与IgA在肾小球中沉积的相关性
Superman相关分析结果显示,PRCP在肾小球区的表达与IgA在肾小球中的沉积呈负相关(r=-0.301,P=0.0027),ACE2在肾小球区的表达与IgA在肾小球中的沉积呈正相关(r=0.306,P=0.024)。
3 讨论
IgA肾病是世界范围内最普遍的原发性肾小球疾病,尤其以亚洲地区人群发病率最高[11],任何年龄均可发病,以儿童和青少年最为常见[12]。目前对于IgA N的发病机制的认识还不明确,主要认为与异常糖基化的IgA的产生有关[13],肾穿刺活检免疫荧光检测可见IgA为主的免疫球蛋白及补体成分在肾小球系膜区沉积。明确其发病机制对指导疾病临床治疗、改善预后是至关重要的。
RAS系统是人类调节血压和液体平衡最重要的激素系统之一,临床上通过各类药物中断或影响这个系统中的不同反应阶段从而达到控制血压,改善心力衰竭,改善肾功能衰竭等目的[14]。目前研究认为在肾脏组织中存在与循环RAS系统互相关联并相对独立的局部RAS系统[15]。有研究报道,可能与IgA肾病和/或肾脏疾病高度相关的蛋白有PRCP[16]。PRCP作为RAS系统与激肽释放酶-激肽系统(KKS)重要的连接点,在一些报道中发现在炎症相关的肾脏疾病的发展的各个连续阶段有血浆PRCP水平的升高[17]。另外在大量糖尿病肾病(diabetic nephropathy,DN)的研究中发现ACE2可通过影响组织微循环进而对糖代谢以及肾组织病变产生作用,也可通过改变机体氧化应激水平、影响肾小管上皮间充质转分化等参与DN的病变过程[18],并逐渐开始作为DN诊断和治疗的新靶点[19],但在IgA肾病的领域研究较少[20]。
本研究采用免疫组化的方法针对PRCP、ACE2的研究显示,PRCP、ACE2在IgA肾病患者的肾组织中高表达,在对照组的MCD患者肾脏组织中少量表达,两者之间的差异有统计学意义(P<0.05),主要定位在肾小管上皮细胞上,以胞质和胞膜为主,棕黄色呈弥散性分布,另外在肾小球系膜系膜、壁层上皮细胞、脏层上皮细胞也有表达,以胞膜为主,棕黄色呈线性或颗粒性分布,但在肾间质血管及各类炎症细胞中未见明显表达。通过对IgA肾病不同病理表现分组的组间统计分析可见,随着疾病的进展,PRCP与ACE2在肾小球区域和肾小管区域的表达呈现出不同的发展趋势,PRCP及ACE2在肾小球区的表达量随疾病发展逐渐升高,尤其在形成新月体的肾小球中增生的壁层上皮细胞高表达,而在肾小管区的表达量随疾病发展逐渐下降,推测肾间质纤维化,肾小管上皮萎缩,其分泌的蛋白量减少。Superman相关分析结果显示,PRCP在肾小球区的表达与IgA在肾小球中的沉积呈负相关(r=-0.301,P=0.0027),ACE2在肾小球区的表达与IgA在肾小球中的沉积呈正相关(r=0.306,P=0.024)。异常糖基化的IgA现阶段被认为是IgA肾病的主要发病机制[21],ACE2的表达与其沉积量相关,ACE2也很可能在IgA肾病的发生发展过程中起着重要作用。
综上所述,在IgA肾病的进展过程中,伴随着PRCP、ACE2分泌量的变化,RAS系统可能在IgA肾病的发生发展过程中起到一定作用,但其具体作用机制还不十分清楚,还需进一步研究。对于PRCP、ACE2等RAS系统相关蛋白的检测,对于判断肾病的预后有一定帮助。
