阿立塞替通过靶向Aurora激酶A提高人非小细胞肺癌细胞的放射敏感性*
2020-06-03李舜杨智松韩国征李红艳齐浩明
李舜, 杨智松, 韩国征, 李红艳, 齐浩明
(1.大庆龙南医院, 黑龙江 大庆市 163000; 2.石河子大学第一附属医院 中医二科,新疆 石河子 832008; 3.渭南市中心医院 心血管内科, 陕西 渭南 714000)
肺癌是致死率非常高的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%~85%[1]。近年来,NSCLC的治疗多采用手术、放疗、化疗、靶向治疗等方法,其中放疗及靶向治疗已成为近期的研究热点[2-4]。由于长时间放疗会使癌症细胞产生放射抵抗,故寻找提高癌细胞放射敏感性的靶点非常必要。Aurora激酶A可通过调节复制中心体、形成双极纺锤体,对有丝分裂纺锤体上的染色体排列及有丝分裂中发挥关键作用[5]。研究表明,Aurora激酶A是成神经管细胞瘤和高级胶质母细胞瘤的潜在靶点[5-8],还认为Aurora激酶A涉许多类型的癌症(乳腺癌、结肠癌、卵巢癌、肝癌及胰腺癌)[9-14]。最新研究结果表明,SMARCB1基因可通过抑制Aurora激酶A的表达而达到抑制非中枢神经系统(central nervous system,CNS)横纹肌样瘤细胞生长的作用[15]。阿立塞替(Alisertib, MLN8237)是一种有效的市场化的选择性Aurora A抑制剂,对肿瘤有一定的抑制作用,是效果良好的放射增敏剂,本研究旨在探讨阿立塞替对NSCLC放射敏感性的影响及其作用机制。
1 材料与方法
1.1 材料仪器
肺癌细胞NCI-H1975购自美国菌种保藏中心,MLN8237购自美国阿拉丁工业公司, RPMI-1640培养液购自美国赛默飞世尔科技公司,胎牛血清购自美国赛默飞世尔科技公司,阴性siRNA、si Aurora Kinase A及siPORT NeoFX转染剂购自美国爱普拜斯公司,FAM-siRNA购自上海吉玛制药技术有限公司,Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国碧迪公司,RT-PCR试剂盒购自美国赛默飞世尔科技公司,BCA试剂盒购自上海碧云天生物技术研究所,qTR-PCR实验试剂盒美国赛默飞世尔科技公司,细胞培养箱购自美国赛默飞世尔科技公司,6 MV X 线直线加速器购自德国西门子公司(剂量率为0.5 Gy/min),流式细胞仪购自美国贝克曼库尔特有限公司),酶标仪购自美国英杰生命技术有限公司。
1.2 方法
1.2.1细胞培养 采用含有10%胎牛血清的RPMI-1640培养液于37 ℃、5% CO2的恒湿培养箱中常规培养肺癌细胞NCI-H1975,3~4 d传代1次,取生长状态良好的对数生长期细胞进行后续实验。
1.2.2RNAi载体的转染 将靶向Aurora激酶A mRNA的siRNA和非靶向siRNA以及荧光标记的siRNA(FAM-siRNA)以每6孔板5 nmol/L siPORT NeoFX转染剂为载体,按照逆转染方案转染到部分肺癌NCI-H1975细胞系中,并分组为:单纯对照组(Control)、阴性对照组(Si control)及靶向Aurora激酶A组(si Aurora Kinase A)。
1.2.3CCK-8细胞活力实验 将siRNA转染的、及未转染肺癌NCI-H1975细胞分别(5 000个细胞/孔)接种在96孔板中,常规培养。对于用siRNA转染过的细胞,在转染72 h后,吸去培养基,加入10 μL CCK-8溶液,再孵育2 h,并分为Control 组、Si control 组和Si Aurora Kinase A组;对于未转染的细胞,常规培养24 h后,以排枪向各孔中加入不同浓度(低浓度40 nmol/L、高浓度160 nmol/L)的MLN 8237[16],并分为Control(DMSO)组,40 nmol/L组和160 nmol/L组;在作用24 h后,加入10 μL CCK-8溶液,并再孵育2 h。而后同样用酶标仪测定450 nm波长处的吸光度(OD值),按照以下公式计算细胞活力(以细胞活力反映细胞抑制率):细胞活力=[OD值(加药)-OD值(空白)]/[OD值(未加药)-OD值(空白)×100%。
1.2.4细胞凋亡实验 将以siRNA转染、及未转染肺癌NCI-H1975细胞分别(5 000个细胞/孔)接种在96孔板中,收集用siRNA转染72 h、及未转染的NCI-H1975细胞常规培养24 h,并在未转染的组中加入不同浓度的MLN 8237(40 nmol/L及160 nmol/L)再次作用24 h,而后分别收集各组细胞于离心管内,以1 000 r/min离心5 min,PBS洗涤并离心2次;用Binding Buffer 500 μL悬浮细胞、Annexin V-FITC 5 μL和PI 5 μL染色溶液混匀后在避光条件下室温中反应15 min;用流式细胞仪检测、分析各组细胞凋亡率,分组同1.2.3。
1.2.5克隆形成实验 将对数生长期的肺癌NCI-H1975细胞按照射剂量不同接种于含3 mL培养基中(皿的直径为60 mm,按照照射剂量由低到高接种细胞数为200、400、800、1 200及1 600个/孔),在细胞培养箱中静置6 h待其贴壁;细胞贴壁后按照不同浓度进行给药,并分为Control(DMSO)组、40 nmol/L MLN 8237组及160 nmol/L MLN 8237组,每组设3个复孔;药物作用24 h后,以每皿DMEM 3 mL高糖培养基换液,将细胞分别以 0、2、4、6、8 Gy的剂量进行X射线照射;然后用磷酸盐缓冲液(PBS)洗涤细胞,并在新鲜培养基中培养;7 d后,用甲醇固定细胞,干燥后结晶紫染色10 min,清水缓缓冲去染液、干燥。以肉眼计数克隆数:含50个以上的细胞团计数为1个克隆,计算克隆形成率、出种率( plating efficiency,PE) ,细胞存活分数(survival fraction,SF),按单击多靶模型SF=1-(1-e^(-D/D0))n拟合绘制细胞存活曲线,并计算其平均致死剂量(Do),准阀计量值(Dq),辐射值在2 Gy时单击多靶模型拟合函数的细胞存活分数值(SF2)及辐射增敏比(SER)。
1.2.6qRT-PCR实验 (1)Aurora Kinase A 引物:上游序列为TGATCCTTAGAGCAGCTTCG,下游序列为CTAGGGTTACTTGGAATGAT。(2) p21引物:上游序列为TAGTTCATCGAGTCGCTTT,下游序列为CACTCTGTTGCCACCTATCG。(3)p16引物:上游序列为CGAGCTAACAAGCAAGCAGC,下游序列为ACGTCACCGGATCCTCCAGAAC。(4)GAPDH 引物:上游序列为GTCTGCTCTGACTTCAACAGAG,下游序列为ACCAACCTGTCGCTGTAGCAAA。qRT-PCR 反应体系(20 μL):上游引物(F)1μL、下游引物(R)1 μL,2×TaqMan® qPCR Greenmololaster Mix 10 μL, cDNA模板200 ng,nuclease free water 20 μL。GAPDH为内源对照。qRT-PCR程序:95 ℃、3 min, 95 ℃、15 s,60 ℃、30 s,95 ℃、15 s,40个循环;65 ℃上升至95 ℃。最后使用ΔΔCt方法计算基因表达相对量。
1.2.7荧光素酶分析实验 使用Cignal Finder 10 Pathway Reporter Arrays(SA Biosciences)进行Pathway分析。将肺癌NCI-H1975细胞接种在添加了荧光素酶激动剂的96孔板中, 12 h后,用不同浓度(低浓度40 nmol/L、高浓度160 nmol/L)MLN 8237及照射(6 Gy)处理细胞,而后将细胞再培养24 h。使用双荧光素酶测定系统(Promega)在Glomax多光度计(Promega)测量荧光素酶活性,将荧光素酶活性标准化为海肾荧光素酶活性、并计算比率。用GraphPad Prism软件分析数据。
1.3 统计学方法

2 结果
2.1 NCI-H1975细胞的转染效率及敲减效率
将荧光标记的siRNA(FAM-siRNA)转染到NCI-H1975细胞中,其转染效率达89.91%,表明以siPORT NeoFX转染剂作为载体能满足实验要求,如图1。检测NCI-H1975细胞中Aurora Kinase A 的表达量并计算敲减效率,如图2所示,Si Aurora Kinase A组Aurora Kinase A的表达量为32.68%,与对照组及Si Control组相比显著降低,差异有统计学意义(P<0.01)。
2.2 抑制Aurora激酶A及加入MLN8237对 NCI-H1975细胞生长影响
CCK8实验结果表明,Si Control组的细胞生长率为(86.34±2.83)%,Si Aurora Kinase A组细胞生长率为(72.13±2.95)%,抑制Aurora激酶A可明显抑制NCI-H1975细胞的生长(P=0.001 4);与对照组比较,加入40 nmol/L MLN8237组的NCI-H1975细胞生长率(78.52±2.36)%明显降低,P=0.000 4;加入160 nmol/L MLN8237组的NCI-H1975细胞生长率(51.37±3.12)%也显著降低,差异具有统计学意义(P<0.000 1),提示MLN8237对NCI-H1975细胞有抑制作用,且随浓度的增大,其抑制率增高。见图3。

光镜下明场荧光显微镜下暗场
图1 NCI-H1975细胞FAM-siRNA的转染效率(200×)
Fig.1 Transfection efficiency of FAM-siRNA on NCI-H1975 cells(200×)

注:(1)与Control组和Si Control组比较,P<0.01。
图2 3组NCI-H1975细胞中Aurora Kinase A的表达量
Fig.2 Expression of Aurora Kinase A in the 3 groups
2.3 抑制Aurora激酶A及加入MLN8237对 NCI-H1975细胞凋亡的影响
通过Annexin-V/PI双染法结合流式细胞术检测NCI-H1975细胞在经不同处理之后的凋亡水平,如图4、5所示,Aurora激酶A被抑制后A3组的细胞凋亡率为(31.52±1.51)%,与A2组细胞凋亡率(1.35±0.43)%比较,细胞凋亡水平提高(P<0.001)。 40 nmol/L MLN8237的B2组细胞凋亡率为(39.52±1.51)%,160 nmol/L MLN8237的B3组细胞凋亡率为(82.67±2.64)%,加入MLN8237的B2、B3组细胞凋亡率明显高于单纯对照组B1组,差异有统计学意义(P<0.001)。
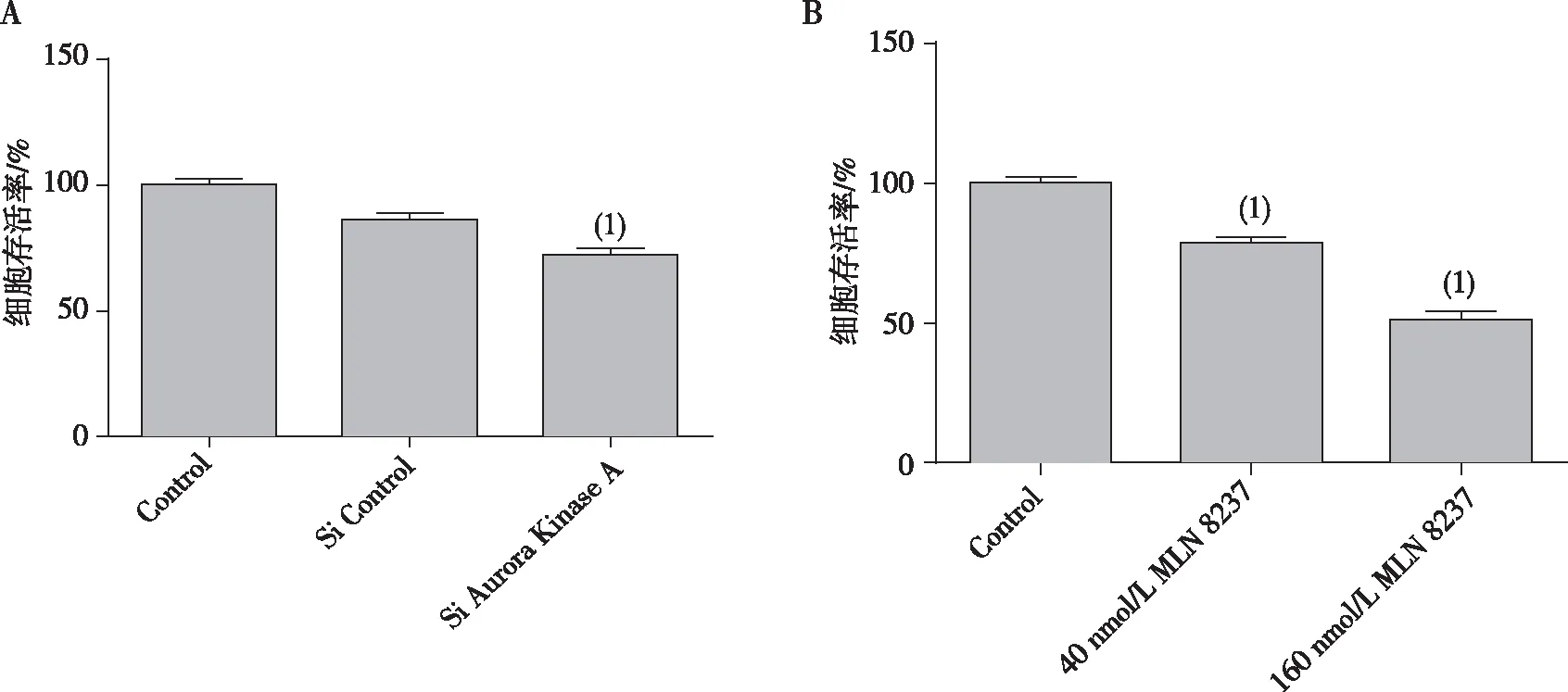
注:A为抑制Aurora激酶A对 NCI-H1975细胞生长的影响,(1)与Si Control组比较P<0.01;B为加入不同浓度MLN8237对 NCI-H1975细胞生长的影响,(1)与Control组比较,P<0.001。
图3 抑制Aurora激酶A及加入MLN8237对NCI-H1975细胞生长的影响
Fig.3GrowthofNCI-H1975cellseffectedbyinhibitingofAurorakinaseAandaddingwithMLN8237
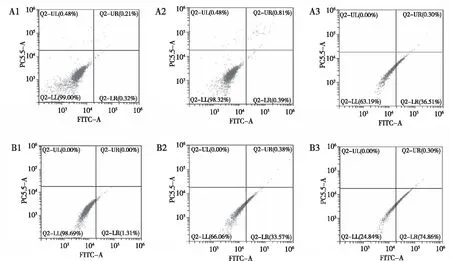
注:A1为Control组,A2为Si Control组,A3为Si Aurora Kinase A组,B1为Control组,B2为40 nmol/L MLN8237组,B3为160 nmol/L MLN8237组。
图4 不同组别NCI-H1975细胞凋亡水平
Fig.4 Representative diagram about the apoptosis of NCI-H1975 cells in the different groups

注: A为抑制Aurora激酶A后对NCI-H1975细胞凋亡影响的统计图,(1)与Si Control组比较,P<0.001;B为加入MLN8237对 NCI-H1975细胞凋亡影响的统计图,(1)与Control组比较,P<0.001。
图5 抑制Aurora激酶A及加入MLN8237对 NCI-H1975细胞凋亡的影响
Fig.5 Apoptosis of NCI-H1975 cells effected by inhibiting Aurora kinase A and adding with MLN8237
2.4 MLN8237对 NCI-H1975细胞放射敏感性的影响
通过克隆形成实验观察MLN8237对NCI-H1975细胞放射敏感性的影响,结果显示MLN8237可明显提高NCI-H1975细胞的放射敏感性。将各组SF值通过单击多靶模型进行拟合:SF=1-(1-e^(-D/D0)^n,得出图6所示曲线,发现加入MLN8237能够显著降低照射后NCI-H1975细胞的克隆形成能力,对NCI-H1975细胞具有明显的放射增敏作用,且随剂量增大其增敏效果越显著,见表1。
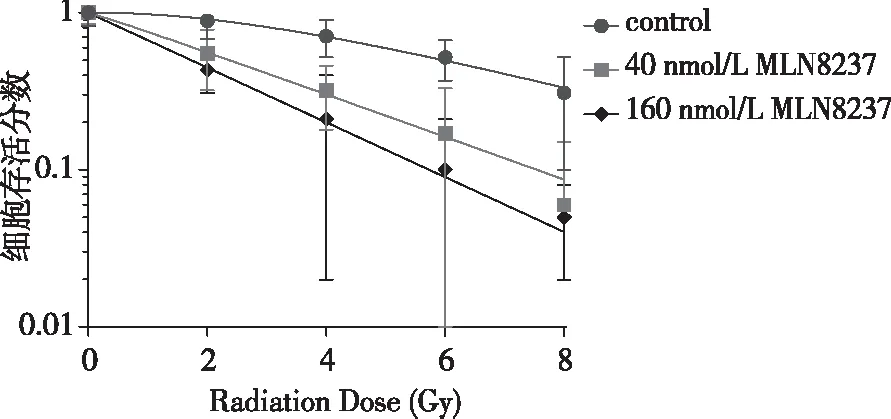
注:对照组与40 nmol/L MLN8237组比较,P<0.001;对照组与160 nmol/L MLN8237组比较,P<0.001。
图6 MLN8237对NCI-H1975细胞照射后克隆形成能力影响
Fig.6 Effect of MLN8237 on the cloning ability of NCI-H1975 cells after irradiation
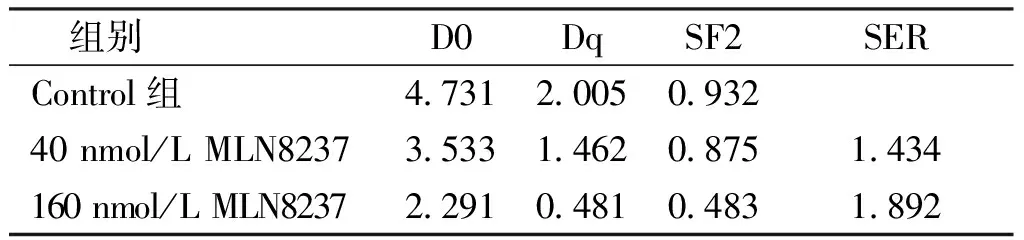
表1 NCI-H1975细胞IR后多靶单击数学模型拟合细胞存活曲线参数Tab.1 NCI-H1975 cell Irradiated multi-target click mathematical model fit with cell survival curve parameters
2.5 抑制Aurora激酶A对照射(6Gy)后NCI-H1975细胞p21及p16表达的影响
通过qRT-PCR评估NCI-H1975细胞中p16及p21的表达后发现,加入MLN8237(Aurora激酶A抑制剂)照射后,p16及p21的表达明显上调,并且药物浓度越高,上调越明显,差异有统计学意义(P<0.001)。见图7。

注:(1)与IR组比较,P<0.001。
图7 抑制Aurora激酶A对照射后NCI-H1975细胞p16及p21表达的影响
Fig.7 Expression of p16 and p21 in NCI-H1975 cells effected by inhibiting Aurora kinase A after IR
2.6 抑制Aurora激酶A对照射(6Gy)后NCI-H1975细胞E2F及JNK活性的影响
如图8所示,通过双荧光素酶测定系统测量荧光素酶活性发现,加入MLN8237(Aurora激酶A抑制剂)照射后显著降低了E2F的活性(P<0.001);然而JNK的活性显著提高,差异有统计学意义(P<0.001)。
3 讨论
有关研究发现,抑制蛋白激酶可以抑制癌细胞的生长并且可以增强辐射[16]。Aurora激酶A家族其中维持正确的染色体分离的Aurora激酶A与许多不同的癌症有关[17]。本研究在前言中已提到,Aurora激酶A是成神经管细胞瘤和胶质母细胞瘤的不良标志物[5, 8]。近期也有研究报道,Aurora激酶A是SMARCB1在肾脏和肌肉横纹肌样瘤的直接靶标,并进一步阐明了抑制Aurora激酶A在治疗横纹肌样瘤时的关键作用[15]。该研究的数据也为Aurora激酶A靶向治疗NSCLC提供了强有力的生物学依据,并为Aurora激酶A抑制剂的临床试验提供了理论基础。而在本研究中证明了Aurora激酶A是治疗NSCLC的潜在靶点。CCK8及凋亡实验显示抑制Aurora激酶A能抑制NCI-H1975细胞的生长并诱导该细胞的凋亡;克隆形成实验显示加入Aurora激酶A的抑制剂MLN8237能有效提高NCI-H1975细胞的放射敏感性。放疗在NSCLC治疗过程中起重要作用,但由于辐射剂量通常受正常组织毒性的限制,添加一定的放射增敏剂加强放疗效果,降低放疗的副作用具有重要意义[18]。本研究的数据表明添加Aurora激酶A的抑制剂MLN8237与放疗联合治疗NSCLC,其放射增敏效果良好,在未来的临床实验中本研究也将对此加以探索。
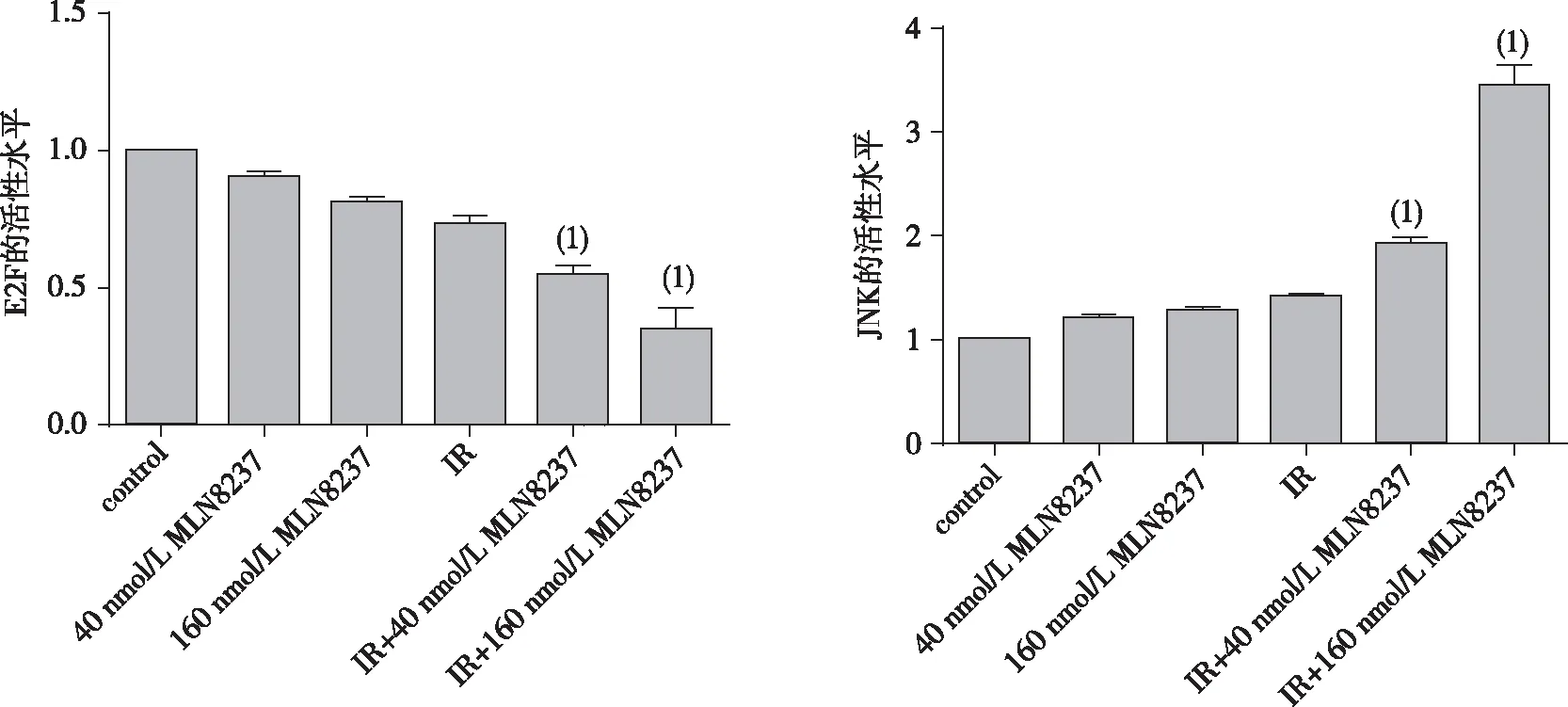
注:(1)与IR组比较,P<0.01。
图8 抑制Aurora激酶A调节照射后E2F及JNK的荧光素酶活性
Fig.8 Activity of E2F and JNK in NCI-H1975 cells adjusted by inhibiting Aurora kinase A after IR
最近的研究已发现了一系列的Aurora激酶A的抑制剂,例如ZM447439(AstraZeneca,Boston,MA)和VX-680(Merck,Rahway,NJ),都能显著抑制Aurora激酶A和B[19-20]。另外一些研究中的MLN8237已被证明对Aurora激酶A有显著的选择性,抑制效果更明显[21]。同时本研究的相关实验也表明了MLN 8237是一种很有前景的NSCLC治疗小分子抑制剂,是一种效果明显的放射增敏剂,可用于建立对NSCLC治疗的临床实验。另有相关研究指出,抑制Aurora激酶A可增强非典型畸胎瘤样横纹肌瘤细胞的放射敏感性[15]。对于MLN 8237抑制Aurora激酶A而提高NSCLC放射敏感性的机制,本研究也做了一些相关研究。通过qRT-PCR实验本研究评估了NCI-H1975细胞中p16及p21的表达,发现Aurora激酶A被抑制后,p16及p21的表达明显上升,从而阻断了细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)CDK4-6对RB蛋白的磷酸化,进而抑制了细胞周期,降低了NCI-H1975细胞的增殖[22];通过荧光素酶分析实验本研究发现,抑制Aurora激酶A显著降低了E2F的活性,但JNK的活性显著提高,这激活了丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号转导通路,从而诱导了促凋亡信号传导机制,促进了NCI-H1975细胞的凋亡[23]。
综上所述,阿立塞替能通过靶向Aurora激酶A,抑制NCI-H1975细胞增殖及诱导其凋亡,从而提高NCI-H1975细胞的放射敏感性。然而,由于放射增敏靶向药物的分子机制十分复杂,而本研究只是部分对其进行了探索,其放射敏感性的临床潜力及具体分子机制在将来仍需进一步完善。
(2020-03-03收稿,2020-05-11修回)
中文编辑: 刘 平; 英文编辑: 冉海勇
