心血管发育相关基因mpx在斑马鱼早期胚胎发育中的表达*
2020-06-03向文碧周栋珍李志操周艳华张鹏崔冬冰何志旭舒莉萍
向文碧, 周栋珍, 李志操, 周艳华, 张鹏, 崔冬冰, 何志旭, 舒莉萍**
(1.贵州医科大学 细胞工程生物医药技术国家地方联合工程实验室, 组织工程与干细胞实验中心, 贵州 贵阳 550004; 2.中国医学科学院成体干细胞转化研究重点实验室, 贵州 贵阳 550004; 3.贵州医科大学 儿科学教研室, 贵州 贵阳 550004; 4.贵州大学, 贵州 贵阳 550025; 5.贵州省贵阳市妇幼保健院 贵阳市儿童医院, 贵州 贵阳 550003; 6.遵义医科大学附属医院 儿科学教研室, 贵州 遵义 563000)
髓过氧化物酶(myeloperoxidase, MPO) 是髓系细胞的特异性标志物,主要由中性粒细胞以及单核细胞分泌[1-2]。随着对MPO的深入研究,发现MPO涉及多种疾病进程。既往国内外研究证实,MPO与心血管疾病(cardiovascular disease,CVD)的发生有关[3-4],髓样特异性过氧化物酶mpx基因是斑马鱼中最接近哺乳动物MPO基因的同源物[5]。基于斑马鱼胚胎通体透明、体外受精、发育迅速等优势,本研究以斑马鱼为实验动物开展相关实验研究,旨在探讨斑马鱼mpx在胚胎发育过程中的表达,为进一步探索mpx与CVD的关系及开发治疗CVD的新药奠定基础。
1 材料与方法
1.1 材料
1.1.1实验动物 野生型斑马鱼由本课题组实验中心饲养:28 ℃循环水中养殖,幼鱼和成鱼分别以草履虫和丰年虾喂养,光照12 h/d,收集受精后0.75 h、3.7 h、6 h、9 h、12 h、18 h、24 h、30 h、36 h、48 h、72 h(hours post-fertilization, hpf)共11个时相的胚胎,用于提取总RNA和原位杂交。
1.1.2主要实验试剂 限制性内切酶Hind Ⅲ、XhoⅠ、DNA Marker、Trizol、First Strand cDNA Synthesis Kit试剂均购自Thermo公司,KOD-Plus PCR酶购自Toyobo公司,T3聚合酶购自Promega公司,T4 DNA连接酶购自Fermentas公司,地高辛RNA和NucAwayTMSpin Columns均购自Ambion公司,BCIP/NBT试剂盒购自VECTORLab公司,Proteinase K购自Sigma公司,酵母提取物和氨卞青霉素均购自素索莱宝生物科技公司。
1.2 方法
1.2.1斑马鱼总RNA提取及cDNA的合成 收集0.75 h、3.7 h、6 h、9 h、12 h、18 h、24 h、30 h、36 h、48 h、72 hpf共11个时相的斑马鱼胚胎,每个时相25枚置于1.5 mL的Ep管中,按Trizol法提取总RNA,然后用First Strand cDNA Synthesis Kit试剂盒按说明书将RNA逆转录成 cDNA后于-20 ℃保存备用。
1.2.2mpx基因片段克隆 用NCBI查询mpx基因的全长cDNA,根据mpx全长cDNA设计mpx基因引物序列,mpx-R:5′-CCCAAGCTTCCTCAACGACAGCACTCTGA-3′,mpx-F: 5′-TCGCTCGAGTACTC
CAGGTAGGGTTGAGCA-3′,该引物含有Hind Ⅲ和XhoⅠ酶切位点。PCR扩增程序为:94 ℃ 2 min,(94 ℃ 15 s、61 ℃ 30 s、68 ℃ 1 min)36次循环,68 ℃ 10 min。将扩增的目的条带割胶回收。
1.2.3pCS2+-mpx探针质粒构建及鉴定 用Hind Ⅲ和XhoⅠ酶将PCR扩增的mpx产物和载体pCS2+进行双酶切,电泳分析双酶切产物并割胶回收。将酶切后的mpx基因PCR产物和载体pCS2+用T4连接酶进行连接、连接产物进行转化,通过AMP抗性进行筛选,长菌后挑单克隆用于菌落mpx基因RT-PCR鉴定,并通过试剂盒抽提pCS2+-mpx探针质粒;再将获得的pCS2+-mpx探针质粒用HindIII和XhoI酶进行双酶切鉴定,且送诺赛基因公司进行测序鉴定。
1.2.4地高辛标记的mpx基因反义mRNA的制备 用Hind ⅢI将pCS2+-mpx质粒酶切线性化并回收,再以线性化的pCS2+-mpx质粒为模板,加入地高辛标记的寡核苷酸用T3聚合酶合成mpx探针并回收,电泳鉴定后保存在-70 ℃。
1.2.5斑马鱼全胚胎原位杂交(whole mount in situ hybridization,WISH) 洗涤和脱水:将不同时相的胚胎从4 ℃冰箱取出并用1×PBST进行洗涤,再用1×PBST配置的不同浓度的甲醇将胚胎进行梯度脱水处理。预杂交:加入1 mL预杂交液于68 ℃预杂交15 min,去掉预杂交液,加入0.3 mL杂交液于68 ℃预杂交1 h。杂交:加入300 ng探针于68 ℃杂交过夜。洗涤:去掉杂交液后用不同浓度SSCT进行洗涤。封闭:用阻滞液封闭2 h。孵抗体:于阻滞液中加入为1 ∶5 000(体积比)地高辛抗体,于冷库中4 ℃孵育过夜。洗涤:用MABT进行洗涤。染色:用BCIP/NBT染液室温进行染色约4 h,边染色边观察并记录。终止染色和拍照:染色完毕后,用1×PBST洗去染液终止染色,并用体视显微镜进行拍照。
2 结果
2.1 mpx基因扩增结果
mpx基因扩增结果得到一条单一的位于100~200 bp的电泳条带,大小跟设计的mpx目的片段173 bp相符(图1),说明mpx基因片段扩增成功。

注:M为DNA marker Ⅰ,1为mpx RT-PCR product,2为Blank control。
图1mpx基因 RT-PCR产物的琼脂糖凝胶电泳结果
Fig.1 Electrophoresis ofmpxgene amplified by RT-PCR
2.2 酶切鉴定结果
pCS2+-mpx双酶切后得到两个条带,一条位于100~200 bp,这与目的片段mpx基因的173 bp大小是一致的;另外一条约4 016 bp,这与pCS2+载体Hind Ⅲ、XhoI双酶切产物的电泳结果一致(图2)。说明pCS2+-mpx探针质粒构建成功。
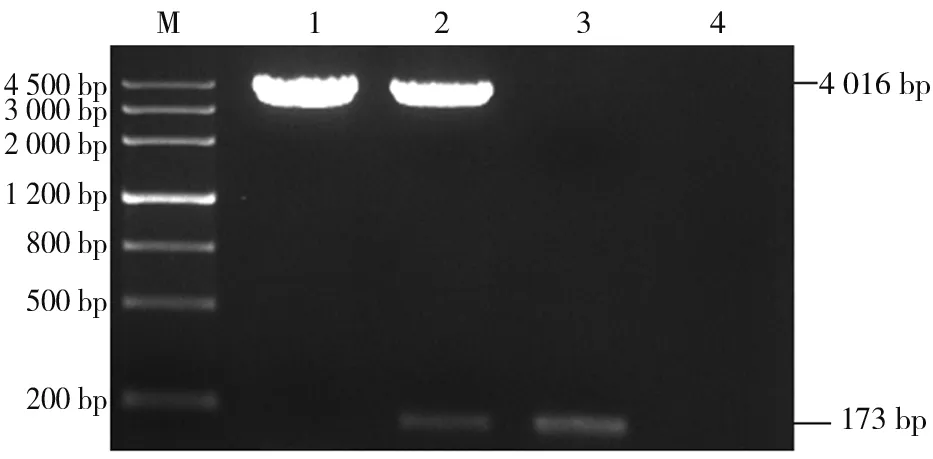
注:M为DNA marker Ⅲ,1为pCS2+,2为pCS2+-mpx,3为mpx PCR product,4为Blank control。
图2pCS2+-mpx重组质粒HindⅢ、XhoⅠ双酶切产物的琼脂糖凝胶电泳结果
Fig.2 Electrophoresis of digestion products ofpCS2+-mpxbyHindⅢ andXhoⅠ
2.3 pCS2+-mpx重组质粒菌落RT-PCR鉴定结果
pCS2+-mpx重组质粒经菌落RT-PCR得到的条带与设计的mpx目的片段一致(图3)。
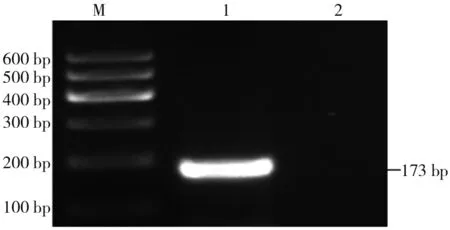
注:M为DNA marker Ⅰ,1为mpx RT-PCR product,2为Blank control。
图3pCS2+-mpx重组质粒菌落RT-PCR产物的琼脂糖凝胶电泳结果
Fig.3 Electrophoresis of RT-PCR product of bacterial colony for recombinant plasmidpCS2+-mpx
2.4 pCS2+-mpx重组质粒测序结果
通过氨苄抗性筛选的pCS2+-mpx重组质粒经测序结果如图4,经NCBI检索对比发现与mpx基因一致。说明pCS2+-mpx探针质粒构建正确。
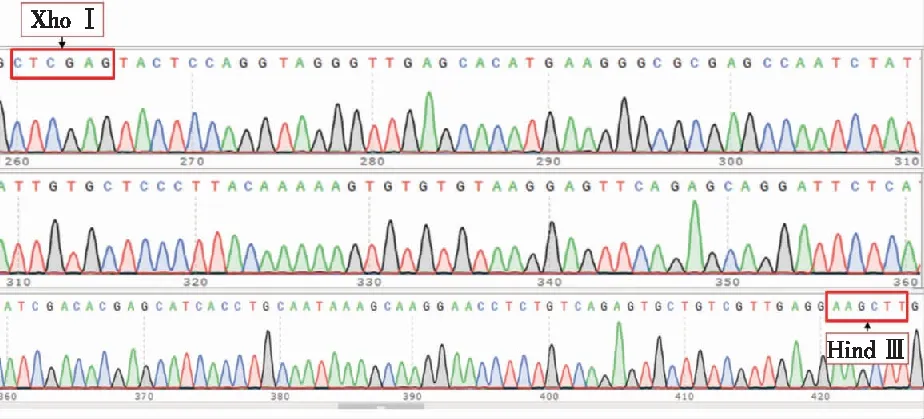
图4 pCS2+-mpx重组质粒测序结果Fig.4 Verification of sequence in recombinant plasmid pCS2+-mpx by sequencing
2.5 mpx基因的斑马鱼全胚胎原位杂交结果
结果显示在18 hpf前的斑马鱼胚胎中无明显阳性信号表达,在24 hpf,斑马鱼胚胎中间细胞团有较弱的蓝紫色阳性信号表达;从24 hpf开始一直持续到72 hpf,在斑马鱼胚胎卵黄囊表面、心脏和轴向脉管系统中出现较强的的蓝紫色阳性信号表达;尤其是在72 hpf,在整个胚胎头部、卵黄囊表面、尾部中均有弥散的蓝紫色阳性信号表达(图5)。说明mpx基因在斑马鱼胚胎18 hpf以后开始表达,并且主要在心血管系统中高表达。
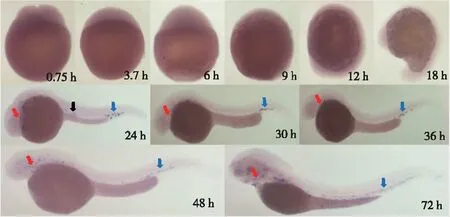
注:红色箭头所示心脏,蓝色箭头所示轴向脉管系统,黑色箭头所示中间细胞团。
图5mpx基因的斑马鱼全胚原位杂交结果(40×)
Fig.5 Expression pattern ofmpxgene in zebrafish embryos at different periods after fertilization using whole-mount in situ hybridization (40×)
3 讨论
MPO是血红素过氧化物酶超家族的主要成员,主要表达于中性粒细胞、单核细胞[6]。人MPO是一种同源二聚体蛋白,其质量大小为146 kDa,主要由两个结构完全相同但功能相互独立的73 kDa的蛋白质所构成。人类mpo基因位于17号染色体,由12个外显子和11个内含子构成,大小约11 kb。MPO在血液中水平升高与炎症和氧化应激增加有关[7-8],并且国内外研究表明MPO与CVD (包括冠状动脉疾病、动脉高压、肺动脉高压、心肌缺血再灌注相关损伤、中风、心律失常和静脉血栓形成等)之间存在联系[9-13],MPO升高可能意味着CVD的风险增加[14]。斑马鱼相比于其它模式生物具有胚胎通体透明、体外受精、发育迅速等用于VCD研究和开发心血管新药的优势[15],因此本研究以斑马鱼为实验动物开展相关研究。
mpx基因是斑马鱼中最接近哺乳动物MPO基因的同源物。成年斑马鱼体内主要包括嗜异性粒细胞(即中性粒细胞)和较稀有的嗜酸性粒细胞这两种粒细胞。mpx基因主要表达在斑马鱼的中性粒细胞,并且斑马鱼中性粒细胞的发生发展及功能活性与哺乳动物中性粒细胞类似[16]。因此,本研究主要探讨斑马鱼mpx基因的具体表达模式,以期为进一步探索mpx与CVD的关系和开发治疗CVD的新药奠定基础。本课题首先通过设计mpx基因引物成功扩增出mpx基因片段,并通过基因重组技术构建pCS2+-mpx重组质粒,经菌落mpx基因RT-PCR、双酶切和测序鉴定pCS2+-mpx质粒构建成功。然后,以pCS2+-mpx质粒为模板用T3聚合酶成功制备了mpx反义RNA探针。最后,用全胚胎原位杂交技术检测了斑马鱼mpx在胚胎发育中的具体表达情况。
原位杂交结果显示,mpx基因在18 hpf前的斑马鱼胚胎中无明显表达,提示mpx基因在斑马鱼胚胎中18 hpf前可能不表达或者表达量较少以致于用全胚胎原位杂交技术无法检测出。在24 hpf,mpx基因在斑马鱼胚胎中间细胞团中低表达,这与中性粒细胞产生的位置一致[17]。斑马鱼心血管系统由静脉窦、心房、心室和动脉球等结构组成,斑马鱼的心血管发育速度较快, 心肌在22 hpf即开始收缩,24 hpf产生心跳,48 hpf心血管系统发育基本完成[18-19]。在22 hpf时,原始心管能够产生有节奏的蠕动波,在大约33 hpf原始心管心管发育成S形构型并分化成心房和心室时,这些蠕动波转化为规律协调的收缩[20-21]。本研究发现,mpx基因24~72 hpf在斑马鱼卵黄囊表面及心脏高表达,这与斑马鱼心脏发育的主要部位和时间相吻合,提示mpx基因可能参与调控斑马鱼心脏的发育。血管是所有器官功能和发育的基本组成部分,具有不同的大小和特殊的反应性,这取决于它们的功能和它们所连接的器官[22]。斑马鱼血管发育始于内皮祖细胞从中胚层迁移形成原始主动脉和主要静脉而形成简单的循环,在24 hpf后,建立主要的轴向血管[23-24]。到72 hpf时,主要的轴向血管通过背腹对齐的节间动脉和节间静脉相连,随后产生两个单独的背侧纵向吻合血管以连接躯干每侧的节间血管[25-26]。本研究发现,从24 hpf开始斑马鱼mpx基因在卵黄囊表面和轴向脉管系统中高表达,一直持续到72 hpf,这与斑马鱼早期胚胎血管发育的时间和部位一致,尤其是在72 hpf,mpx基因在整个斑马鱼胚胎头部、卵黄囊表面、尾部中弥散表达,这与血管是所有器官和组织的基本组成部分的特点相吻合,提示mpx基因可能与斑马鱼血管的发育相关。
综上所述,本研究通过构建pCS2+-mpx质粒制备mpx反义RNA探针,并以mpx反义RNA探针进行全胚胎原位杂交技术证实,mpx基因在斑马鱼的心血管系统发育的时间和部位中都有表达,提示mpx基因可能参与调控斑马鱼心血管系统发育,但具体机制有待进一步研究。
