CalothrixinB衍生物对白血病K562细胞的抑制作用及机制*
2020-06-03龙群肖潇宋晶睿饶青刘晟何志旭李艳梅
龙群, 肖潇, 宋晶睿, 饶青, 刘晟, 何志旭, 李艳梅**
(1.贵州医科大学 基础医学院 免疫教研室 & 组织工程与干细胞实验中心, 贵州 贵阳 550004; 2.贵州医科大学 省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550014; 3.贵州省中国科学院 天然产物化学重点实验室, 贵州 贵阳 550014)
白血病是一组以造血干细胞异常增殖和分化受阻为特点的血液系统恶性肿瘤,分为急性髓系白血病(acute myeloid leukemia, AML)、慢性髓系白血病(chronic myeloid leukemia, CML)、急性淋巴细胞白血病(acute lymphocyte leukemia, ALL)及慢性淋巴细胞白血病(chronic lymphocytic leukemia, CML),其中AML和CML是常见的白血病恶性血液病[1-2]。人类白血病细胞系K562是一种造血祖细胞,已被广泛用于CML的研究,它是由一名CML患者建立的细胞系[3-4]。CML是一种以费城(Ph)染色体为特征的骨髓增生性疾病,分为慢性期、加速器和急变期,在美国,CML在成人中约占新诊断疾病的15%[5]。Ph染色体是由22号染色体长臂易位到9号染色体长臂上,使断点簇区域激酶(breakpoint cluster region kinase,BCR)基因与Abelson激酶(abelson kinase,ABL)基因形成融合基因,编码的BCR-ABL融合蛋白可以激活多种下游信号通路,如信号转导及转录激活蛋白3(signal transducer and activator of transcription, STAT3)、蛋白激酶B (protein kinase B, AKT)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,从而抑制造血祖细胞分化,导致细胞过度增殖和抵抗凋亡,并破坏遗传稳定性[6-7]。目前已经有很多药物被开发用来治疗CML,其中酪氨酸激酶抑制剂(TKIs)是一项重要的发现,尤其是伊马替尼的使用,CML已成为一种可控制的、长期存活率超过85%的慢性疾病[8]。然而在临床中,由于BCR-ABL突变、BCR-ABL过表达及其他独立于BCR-ABL的信号通路存在,大约15%~20%的CML患者最终会形成对伊马替尼的耐药性,然后进入加速阶段,最后达到急变期[9-10];而一旦CML患者发展到无法控制的程度,治疗会更加困难[11],因此对CML的治疗依然需要不断的研究探索。CalothrixinB是一种具有潜在抗增殖活性的眉藻蓝细菌次生代谢产物,它不仅对人HeLa细胞具有纳摩乐级的生长抑制作用,而且在体外还能抑制抗氯喹疟原虫的生长,但是其对髓系白血病细胞活性较差,经过修饰改造后又可有较好活性[12-13]。本实验室合成了一系列CalothrixinB的衍似物,通过筛选,本研究选出了L20(图1) 这个对K562细胞株具有活性的化合物,采用该化合物处理K562细胞,观察处理后K562细胞的细胞凋亡及细胞周期的变化进一步研究其抑制K562细胞增殖的作用机制,报告如下。
1 材料与方法
1.1 细胞、试剂及主要仪器
人慢性髓系白血病K562细胞株来自于美国ATCC细胞库。用含5%胎牛血清的RPMI 1640培养基培养,于37 ℃、5% CO2、湿度为95%的恒温箱中进行孵育。L20是由贵州省中国科学院天然产物化学重点实验室刘晟老师合成,分子量为 462 kD,化学式如图1,纯度大于 95%的一个CalothrixinB 衍生物。RPMI1640培养基购于美国Giboc公司,胎牛血清购于美国VACCA 公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购于 Sangon 生物技术公司,细胞浓度的DMSO、四唑盐(MTT[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide])试剂、细胞周期染料(propidium iodide, PI)、BCA(bicinchoninic acid) 蛋白浓度测定试剂盒、细胞裂解液(immunol precipitation, IP)、蛋白酶抑制剂(phenylmethylsulfonyl fluoride, PMSF)和彩虹245光谱蛋白Marker (11-245kD) 购于北京索莱宝公司,Annexin V-FITC 凋亡检测试剂盒购于BD 公司,RNA酶抑制剂购于日本Takara公司,活性氧(reactive oxygen species, ROS)检测试剂盒、SDS-PAGE凝胶快速配制试剂盒购于北京碧云天公司。B淋巴细胞瘤-2基因(B-cell lymphoma-2, BCL-2)(ab 32124)、B淋巴细胞瘤-2相关X(BCL2-Associated X, BAX)(ab 32503)、细胞周期蛋白依赖性激酶1(cyclin-dependent kinases 1,CDK1)(ab 131450)、 磷酸化细胞周期蛋白依赖性激酶1(phosphorylation-cyclin-dependent kinases 1, p-CDK1) (ab 47594)抗体购于Abcam公司,细胞分裂周期蛋白25同源蛋白C(cell division cyclin 25 homolog C,Cdc25C)(4688)、 磷酸化细胞分裂周期蛋白25同源蛋白C(Phosphorylation-cell division cyclin 25 homolog C, p-Cdc25C)(9528)、剪切的Caspase3 (9662)、Caspase 9(9502)、多聚 (腺苷二磷酸核糖)聚合酶(poly ADP-ribose polymerase, PARP)(9542)、细胞外调节蛋白激酶(extracellular regulated,ERK)(4695)和细胞外调节蛋白激酶(phosphorylation-extracellular regulated,p-ERK)(4370)购于CST公司。甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(301341) 购于中国正能。细胞培养箱(3111),超净工作台(1384型 A2型)购于美国Thermo公司,倒置显微镜(Axio Vert A1)购于美国ZEISS公司,多功能酶标仪(Synergy 2Multi-ModeReader)购于美国BioTek公司,流式细胞仪(NovoCyte 2040R)购于美国ACEA公司。

图1 化合物L20的结构和分子量Fig.1 Structure and molecular weight of compound L20
1.2 方法
1.2.1MTT法检测K562细胞存活率 将处于对数期生长的K562细胞铺于96孔板中,细胞浓度为6 000个/孔,体积为90 μL。L20浓度分别按10.00、5.00、2.50、1.25、0.63 mmol/L倍比稀释,DMSO为对照组,每个浓度同时做5个重复。在每孔中分别加入10 μL稀释后的药物 ,拍匀后置于恒温箱中培养72 h。用普通光学显微镜拍取 细胞形态后, 在每孔中加入 MTT 10 μL,混匀后继续放入温箱中孵育4 h,用3 000 r/min离心30 min,轻轻将上清吸尽,然后每孔中加入 DMSO 160 μL ,置于摇床上,37 ℃、150 r/min摇15 min;待结晶完全溶解后,用酶标仪在490 nm处读取吸光度值(OD)。然后用公式计算各浓度药物对K562细胞的抑制率:抑制率=(对照组A490 nm-治疗组A490 nm)/对照组A490 nm×100%。
1.2.2Annexin V-FITC/PI 双染法检测细胞凋亡 将处于对数期生长的K562细胞均匀铺于6孔板中,每孔的细胞浓度为10×107/L,体积为2 mL。每孔加入2 μL浓度分别为10.00、5.00及2.50 mmol/L的L20,并以DMSO为对照组。37 ℃培养24 h,48 h后收集细胞,用预冷的PBS洗2遍后,再用1×Binding buffer 50 μL重悬,然后分别加入Annexin V-FITC和PI 2.5 μL,混匀后避光染色15 min,然后离心去染料,1×Binding buffer 200 μL重悬后用艾森 NovoCyte 流式细胞仪对细胞凋亡情况进行检测。
1.2.3流式细胞仪检测细胞周期 将处于对数期生长的K562细胞以50×107/L 铺于60 mm×60 mm的皿中,体积为3 mL,每皿中加入3 μL浓度分别为10.00、5.00及2.50 mmol/L的L20,并以DMSO为对照组。37 ℃培养24 h后收集细胞,用预冷的PBS洗2遍,再加入500 μL预冷70%乙醇,-20 ℃过夜。离心去除乙醇,再用预冷 PBS 洗2次,然后在每管中加入 500 μL 细胞周期染液[RNaseA (100 mg/L)+PI(50 mg/L)+Triton X-100(0.2%)]混合物。混匀后避光,37 ℃孵育20 min。离心去除染料,再用预冷PBS洗两次,然后用200 μL PBS重悬,过滤后用艾森 NovoCyte 流式细胞仪对细胞周期进行检测。
1.2.4ROS的检测 为了研究L20诱导K562细胞凋亡与线粒体的损伤有关,本研究用活性氧试剂盒来检测细胞内氧化应激的水平。将处于对数期生长的K562细胞以50×107/L铺于60 mm×60 mm的皿中,每皿3 mL,每皿加入浓度3 μL分别为10.00、5.00及2.50 mmol/L的L20,并以DMSO为对照组。37 ℃培养24 h后收集细胞,按试剂盒说明书进行探针装载,然后用荧光显微镜进行拍照观察。
1.2.5Western蛋白印迹 将处于对数期生长的K562细胞以50×107/L铺于60 mm×60 mm的皿中,每皿3 mL。每皿加入3 μL浓度分别为10.00、5.00及2.50 mmol/L的L20,以DMSO为对照组。37 ℃培养24 h收集细胞,用预冷的PBS洗2遍,加入细胞裂解液(IP ∶PMSF=100 ∶1),混匀置于冰上30 min,12 000 r/min离心15 min,收集上清,BCA蛋白定量试剂盒测定蛋白浓度,确定上样量。然后用5×SDS buffer,95 ℃变性6 min。取50 μg样品进行SDS-PAGE 电泳,220 mA,120 min 转到PVDF 膜上,然后用3%的BSA封闭1 h,4 ℃过夜敷一抗,1×TBS 洗3遍,室温敷二抗1 h,1×TBS 再洗3遍,然后用Odyssey 红外成像系统进行扫膜。
1.3 统计学方法

2 结果
2.1 L20对K562细胞增殖抑制的影响
MTT结果显示,K562细胞经L20(10.00、5.00、2.50、1.25及0.63 μmol/L)处理 72 h后,与DMSO组比较,L20组抑制率随浓度的增加而增加(P<0.05或P<0.01),通过计算,L20对K562细胞的半抑制浓度(IC50)为(5.46±3.09)μmol/L(图2A)。普通显微镜下观察结果显示,K562细胞经L20处理72 h后,与DMSO组比较,L20组(10.00、5.00、2.50及1.25 μmol/L)K562细胞数量减少、形态发生变化,并有细胞死亡碎片产生(图2B)。

注:A为L20(10.00、5.00、2.50、1.25及0.63 μmol/L) 对K562细胞作用72 h的抑制率,B为L20(10、5、2.50、1.25及0.63 μmol/L) 对K562细胞作用72 h后细胞形态的改变,放大倍数(×200 );与DMSO组比较,(1)P<0.05,(2)P<0.01。
图2 化合物L20对K562细胞增殖的抑制作用(72 h)
Fig.2 Growth inhibition of K562 cells effected by compound L20(72 h)
2.2 L20对 K562细胞凋亡的影响
结果显示,L20(10.00、5.00、2.50 μmol/L)分别处理K562细胞24 h和48 h后,与DMSO组比较,L20组K562细胞凋亡率随浓度的增加而增加(P<0.05或P<0.01)。见图3。
2.3 L20对 K562细胞周期的影响
结果显示,L20(10.00、5.00、2.50 μmol/L)作用于K562细胞24 h后,与DMSO组比较,L20组K562细胞处于G2/M期的比例随浓度的增加而增加(P<0.01),处于G1期和S期的K562细胞则随浓度的增加而减少(P<0.05或P<0.01)。见图4。
2.4 L20对K562细胞ROS的影响
结果显示,L20(10.00、5.00、2.5 μmol/L)作用于K562细胞24 h后,与DMSO组比较,加药组显示绿色荧光的细胞数变多并且荧光强度增加,说明L20可以增加ROS在K562细胞中的累积。见图5。
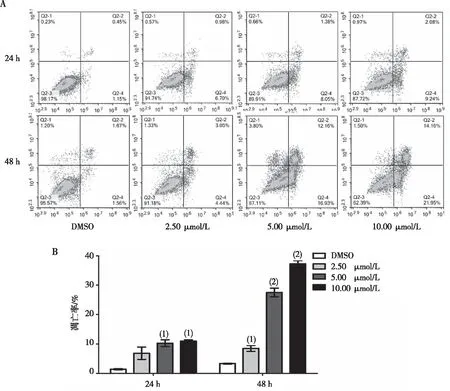
注:A为流式细胞仪分析的凋亡结果,B为凋亡率统计图。与DMSO组比较,(1)P<0.05,(2)P<0.01。
图3 L20对K562细胞作用24 h、48 h时的细胞凋亡率
Fig.3 Apoptosis of K562 cells effected by compound L20 after 24 h and 48 h
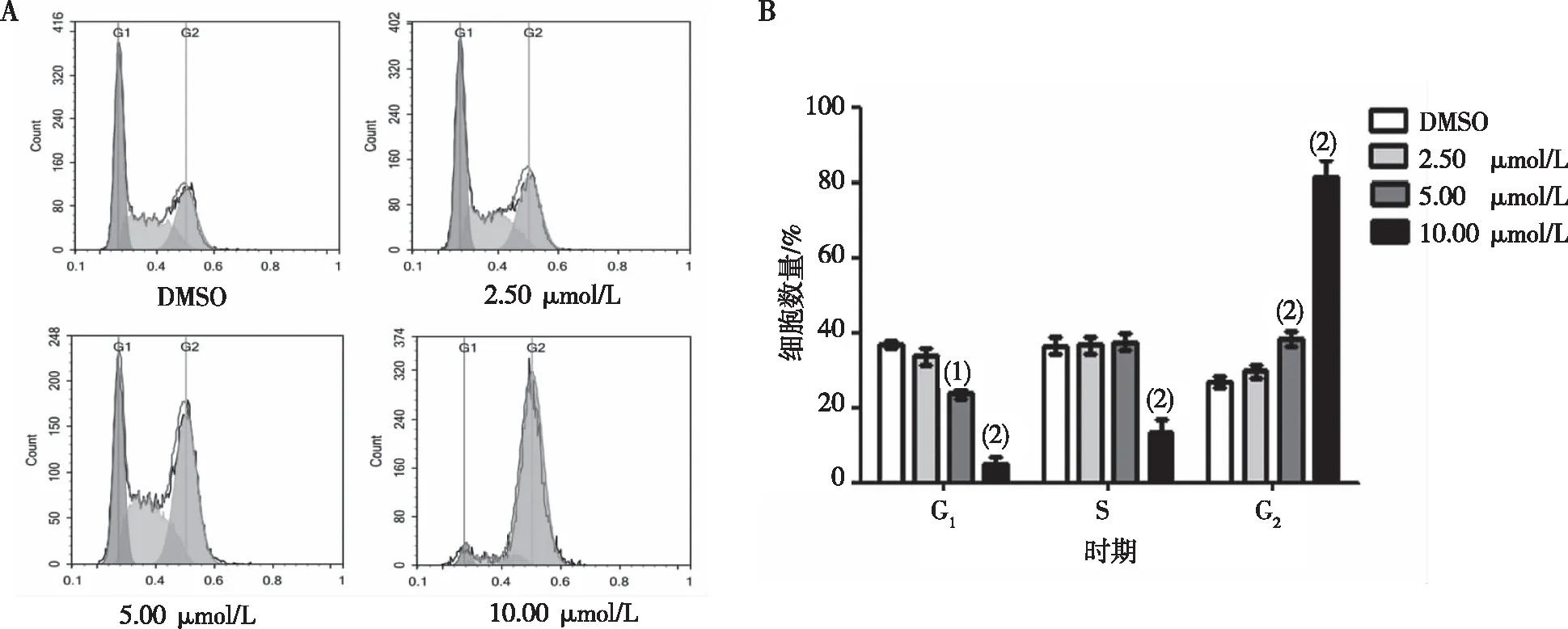
注:A为流式细胞仪分析的周期分布结果,B为细胞周期统计图。与DMSO组同周期比较,(1)P<0.05,(2)P<0.01。
图4 L20对K562细胞作用24 h时的细胞周期变化
Fig.4 Cell cycle of K562 cells effected by compound after 24 h
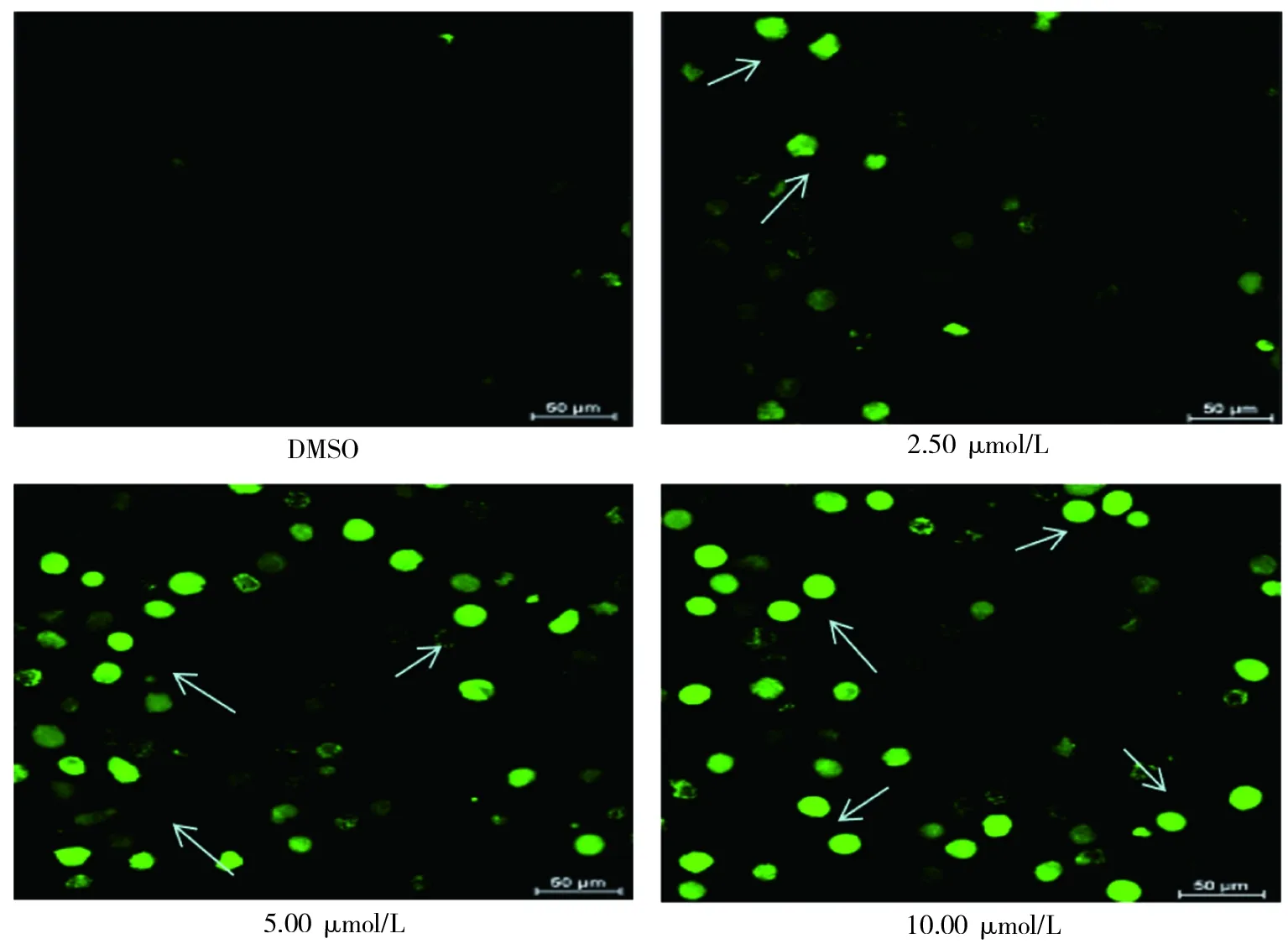
注:箭头所示为阳性细胞。
图5 L20作用于K562细胞24 h后对ROS的影响(荧光染色,×400)
Fig.5 ROS of K562 cells effected by compound L20 after 24 h(microscope,×400)
2.5 L20对K562细胞凋亡和周期蛋白的影响
L20对K562细胞凋亡和周期蛋白影响的结果显示,K562细胞经L20处理24 h后,与DMSO组比较,磷酸化ERK减少,抗凋亡蛋白BCL-2表达减少,促凋亡蛋白BAX表达增加,剪切的Caspase 9、Caspase 3和PARP均增加(图6-A);细胞周期相关蛋白磷酸化CDK1和总的CDC25C增加,磷酸化CDC25C减少(图6-B)。
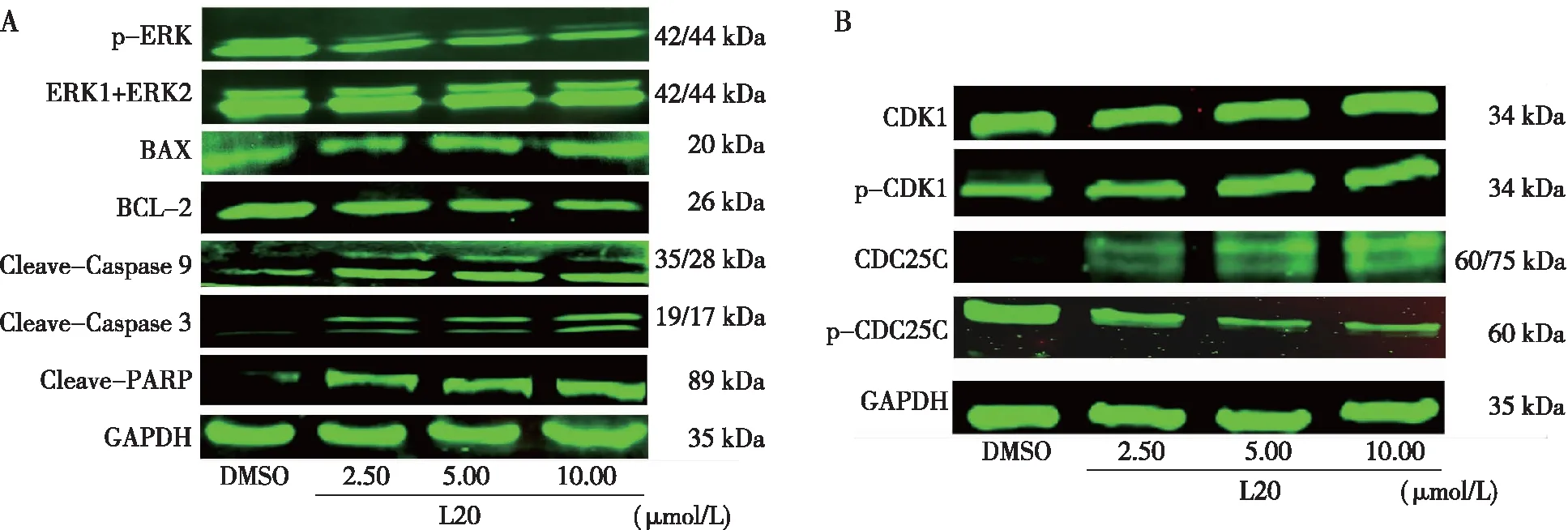
注:A为凋亡相关蛋白,B为周期相关蛋白
图6 L20作用于K562 24 h后对凋亡周期蛋白的影响
Fig.6 Expression levels of apoptosis-and cyclin-related proteins of K562 cells effected by compound after 24 h
3 讨论
本研究结果显示,与对照组DMSO比较,化合物L20作用于K562细胞后,抑制率随着浓度的增加而增加(P<0.05或P<0.01),且在显微镜下观察到细胞数量减少,说明L20能够抑制K562细胞的增殖;凋亡率随着浓度的增加而增加(P<0.05或P<0.01),细胞周期被阻滞在G2/M期的比例也随浓度的增加而增加(P<0.01),说明L20可以诱导K562细胞凋亡并将细胞周期阻滞在G2/M期;化合物L20作用于K562细胞后,细胞内ROS增多,提示L20诱导K562细胞凋亡与线粒体相关;在蛋白水平上,磷酸化ERK减少,调控凋亡及G2/M期的相关蛋白表达也发生了变化,进一步揭示了L20诱导K562细胞凋亡和阻滞细胞周期的机制。
肿瘤的发生是由于基因突变使细胞增殖与死亡之间的稳态被破坏从而导致肿瘤细胞不可控制的生长,因此在研究抗肿瘤药物时,通常将凋亡和周期阻滞作为抗肿瘤的两大指标[14-15]。凋亡由线粒体和死亡受体两条途径介导,其中BCL-2家族成员是调节线粒体凋亡途径的重要蛋白,包括促凋亡蛋白BAX和抗凋亡蛋白BCL-2[16-17]。BAX的增加和BCL-2的减少可以在线粒体上形成小孔道,使线粒体中的细胞色素C释放到胞浆,细胞色素C又能激活执行凋亡程序的Caspase 3、Caspase 9,使剪切的Caspase 3和Caspase 9增多,最终DNA修复酶PARP被Caspase3裂解,使剪切的PARP增多[18-19]。另外,线粒体中活性氧的堆积也会使线粒体膜电位发生改变,使线粒体膜通透性增加,致使细胞色素C从线粒体中释放出来[20]。从本研究的结果可看出,L20抑制了抗凋亡蛋白BCL-2的表达,并增加促凋亡蛋白BAX的表达及ROS的产生,提示L20诱导K562细胞凋亡与ROS参与的线粒体凋亡途径相关。有文献报道p-CDC25C下调可以抑制CDK1/CyclinB1复合体的活性,CDK1/CyclinB1复合体的激活是调控细胞周期从G2期进入M期的关键复合物,其报道还称细胞内p-CDK1和CyclinB1的积累是无活性CDK1/CyclinB1复合物存在的证据[21],因此化合物L20通过下调p-CDC25C的活性来抑制CDK1/CyclinB1复合体的活性使细胞周期阻滞在G2/M期。
ERK/MAPK通路被认为是经典的MAPK信号级联,它在肿瘤发生过程中发挥重要作用,包括调节细胞生长、分化、增殖、凋亡和转移等多种生物学功能[22-23]。在CML K562细胞中由于BCR-ABL融合基因的表达,使MAPK通路异常激活,并且有研究证明ERK1/2 MAPK通路的异常激活与CML患者的生存和耐药具有密切联系[24-25],因此抑制ERK的活性对CML的治疗也有十分重要的意义,说明L20有成为抗肿瘤药物的潜能。
综上所述表明,L20可以通过抑制ERK/MAPK通路,调控BAX/BCL-2的表达及ROS的生成来诱导K562细胞经线粒体途径凋亡,并通过下调p-CDC25C活性来抑制CDK1/CyclinB1复合体的活性将K562细胞阻滞在G2/M期,从而发挥抗肿瘤增殖活性,说明CalothrixinB衍生物L20有希望成为抗肿瘤化合物研究的候选化合物。但本研究没有确切找到L20的上游靶点,也没有在动物体内进行体内实验,因此下一步打算更深入的挖掘其上游靶点及进行体内实验,在化学方面也希望能以此化合物为基础衍生出活性更好的化合物。本研究虽然存在一定的局限性,但第一次发现了CalothrixinB衍生物L20 在CML K562细胞中的作用及机制,为临床上研究新药物提供了新方向。
