神经生长因子对小鼠海马神经元细胞系HT22分化及DNMT表达的影响
2020-06-02姜树原王强张晓璐刘晓蕾谢雅彬巴德仁贵刘友
姜树原 王强 张晓璐 刘晓蕾 谢雅彬 巴德仁贵 刘友
(1包头医学院生物医学研究中心 内蒙古自治区低氧转化医学重点实验室,内蒙古 包头 014040;2包头医学院基础医学与法医学院)
内因和外因共同调控神经细胞生长分化,神经生长因子(NGF)在神经细胞分化中有重要作用〔1,2〕。细胞分化伴随着相关基因的激活与转录变化〔3〕。研究发现NGF通过激活DNA甲基转移酶3B,在诱发大鼠肾上腺嗜铬细胞瘤(PC12)分化为成熟神经细胞中发挥了关键作用〔4〕。也有研究发现了NGF的诱导分化作用,在细胞分化过程中NGF对于神经元发育是必需的因子〔5〕。
DNA甲基化是目前研究最为深入的表观遗传调控机制之一,参与基因转录的调控。这种调控方式主要是通过DNA甲基转移酶(DNMTs)催化来完成的,目前发现有催化活性的DNMT为DNMT1、DNMT3B、DNMT3A〔6,7〕。研究发现,在成年大鼠神经干细胞中DNMTs的激活调控着染色质重塑和基因表达〔8〕。到目前为止,尚不清楚NGF是否影响了DNA甲基化而启动了神经元的分化。
HT22细胞株是小鼠海马神经元细胞系,可被用于检测神经细胞诱导分化的现象〔9,10〕。据报道,已分化的HT22细胞拥有更多有丝分裂期后的神经元特性,如神经突触生长和胆碱能标志物、受体蛋白表达,而在未分化的细胞中,这些特性都不存在〔11〕。目前尚不清楚在HT22细胞分化过程中,NGF在DNMTs介导的基因表达调控中是否发挥作用。本研究旨在探讨NGF诱导HT22细胞分化是否与DNA甲基化相关。
1 材料和方法
1.1材料 HT22细胞,由中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室提供;N2添加剂购自美国Gibco公司;佛波醇12,13-二丁酸酯、鼠抗β-actin单克隆抗体购自美国Sigma公司;TRIzol试剂和反转录试剂盒购自美国Invitrogen公司;放射免疫沉淀法(RIPA)裂解液和电化学发光(ECL)购自上海碧云天生物技术公司;二喹啉甲酸(BCA)蛋白检测试剂盒购自美国Pierce公司;兔抗DNMT1、DNMT3A和DNMT3B多克隆抗体购自美国Novus Biologicals公司;EpiQuik核提取试剂盒和EpiQuik DNMT活性/抑制分析超级试剂盒购自美国Epigentek公司。
1.2细胞培养 将HT22细胞培养于含有10%胎牛血清(FBS)、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养基,置于5% CO2、37℃的培养箱中培养。
1.3细胞分组及处理 HT22细胞分为未分化组和分化组。未分化组使用不含任何药物的等体积DMEM培养基培养。分化组使用含有50 ng/ml NGF-β、1×N2添加剂、100 mmol/L佛波醇12,13-二丁酸酯、100 mmol/L双丁酰环磷腺苷的DMEM培养基孵育24 h,诱导细胞分化。
1.4real-time PCR分析 用TRIzol试剂从HT22细胞中提取总RNA,用反转录试剂盒将总RNA反转录为cDNA,使用ABI7900系统进行real-time PCR反应。引物序列DNMT1 正义链:5′-CCTGGCTAAAGTCAAGTCCCT-3′,反义链:5′-GTGTGTGTTCCGTTCTCCAAG-3′;DNMT3A 正义链:5′-GGCCGAATTGTGTCTTGGTG-3′,反义链:5′-CCATCTCCGAACCACATGAC-3′;DNMT3B 正义链:5′-AAGCTCCCGGCTGTCTAAGA-3′,反义链:5′-CTGCGTGTAATTCAGAAGGCT-3′;β-actin 正义链:5′-GGCTGTATTCCCCTCCATCG-3′,反义链:5′-CCAGTTGGTAACAATGCCATGT-3′。以β-actin的CT值做内参,其值为△CT。目的基因mRNA的相对含量CT值通过△△CT表达,△△CT =△CT(目标样本)-△CT(参考样本)。目的基因表达的变化可通过每组比较每组△△CT值进行分析。
1.5免疫印迹检测 细胞经24 h培养后,磷酸盐缓冲液(PBS)冲洗,加入RIPA缓冲液,置于冰中10 min。提取蛋白并用BCA蛋白检测试剂盒测定蛋白浓度。然后用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离相同量的蛋白样品,转移至硝酸纤维素膜上,5%脱脂奶粉封闭,用兔抗DNMT1、DNMT3A和DNMT3B多克隆抗体和鼠抗β-actin单克隆抗体(1∶1 000稀释)孵育〔12〕。使用ECL,ImageJ分析其灰度值。Western印迹数据以β-actin作为内参。
1.6DNMT活性检测 使用EpiQuik核提取试剂盒提取HT22细胞核蛋白。使用EpiQuik DNMT活性/抑制分析超级试剂盒检测DNMT活性。将10 μg核提取物加入到富含胞嘧啶的DNA底物包被酶联免疫吸附试验(ELISA)板中,37℃孵育60 min,抗5-甲基胞嘧啶抗体识别甲基化的DNA,使用酶标仪,450 nm定量检测甲基化的DNA量,其含量与酶活性呈正比。
1.7细胞周期分析 用6孔板培养细胞,PBS收集并洗涤细胞2次。收集的细胞以800 r/min离心5 min,重悬于0.5 ml PBS中,4.5 ml 70%乙醇固定过夜,800 r/min离心5 min收集细胞,加入含有0.1% Triton X-100的0.1 mg/ml RNase A 和0.2 mg/ml碘化丙啶(PI)染液中,室温避光孵育30 min,使用流式细胞仪测量细胞周期,ModFit 3.0进行分析。
1.8统计分析 采用SPSS10.0软件进行t检验。
2 结 果
2.1分化的HT22细胞形态 使用倒置显微镜观察细胞形态变化。未分化组HT22细胞表现为神经突起长度较短的纺锤状外观,分化组HT22细胞神经突起总长度增加(图1箭头)。

图1 未分化和分化的HT22细胞形态(×100)
为了量化HT22形态学改变,采用IncuCyte测量神经突的长度和神经突长度/胞体集群。数据表明总神经突的长度和神经突长度/胞体集群数于3 h出现提高,于24 h显著提高。孵育24 h,分化的细胞总神经突的长度和神经突长度/胞体集群数为6.00和0.07,而未分化的细胞为1.50和0.02,见图2。
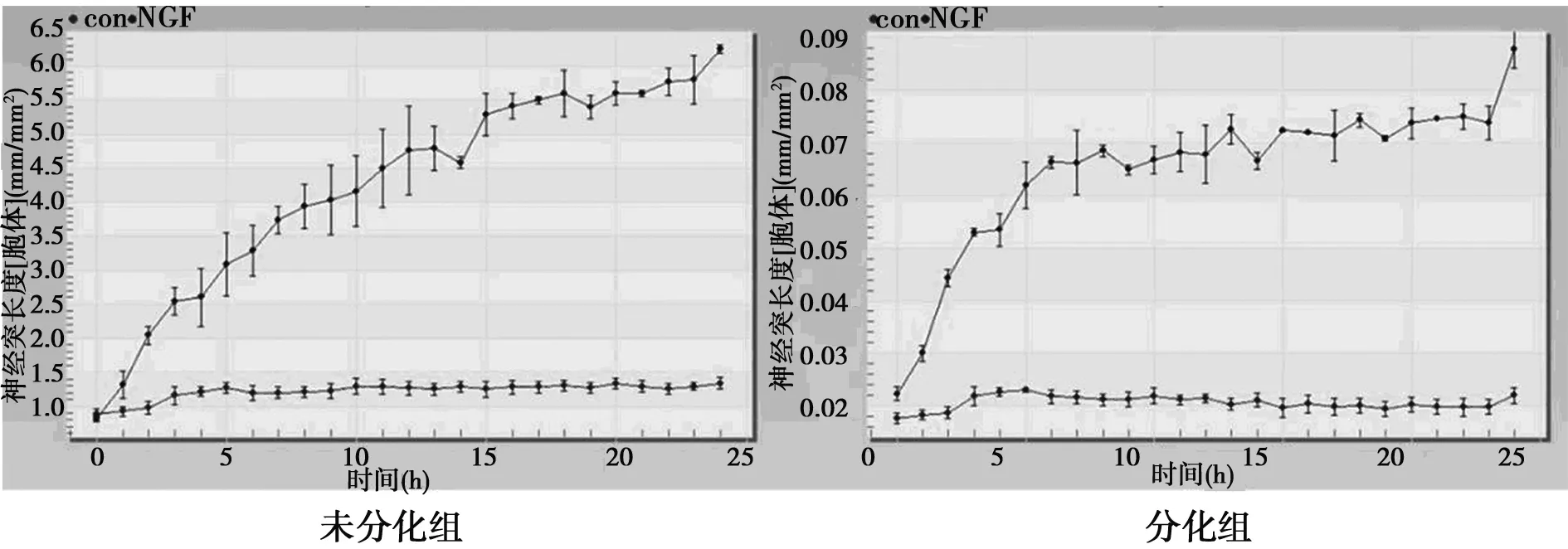
图2 IncuCyte测定分析神经突总长度和 神经突长度/细胞团数
2.2DNMTs mRNA和蛋白表达水平 与未分化组HT22细胞相比,分化组细胞的DNMT1、DNMT3A和DNMT3B mRNA表达水平明显升高(均P<0.05)。见表1。分化组DNMT1、DNMT3A蛋白质表达较未分化组显著增高(P<0.05)。两组DNMT3B蛋白表达水平无明显差异 (P>0.05)。见表2,图3。
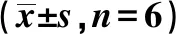
表1 NGF对HT22细胞DNMTs mRNA 表达的影响
与未分化组比较:1)P<0.05;表2同
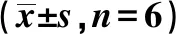
表2 NGF对HT22细胞DNMTs蛋白质 表达的影响
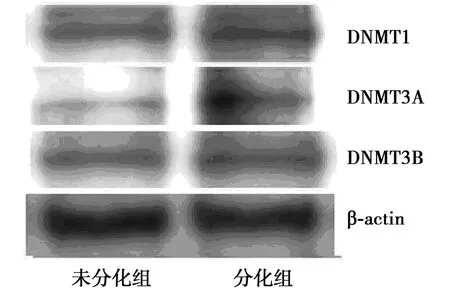
图3 DNMT1,3A和3B蛋白表达NGF对 HT22细胞蛋白质表达的影响
2.3DNMT活性 与未分化组细胞DNMTs活性(7.02±1.41)相比,分化组细胞DNMTs活性显著升高(14.06±3.85,P<0.05)。
2.4细胞周期 分化组细胞与未分化组细胞的周期模式发生了变化,未分化组细胞周期分布为:G1期(54.5±0.24)%,G2期(1.88±0.95)%,S期(43.62±0.72)%;分化组:G1期(25.12±2.89)%,G2期(18.78±0.43)%,S期(56.102±2.78)%。分化组细胞G2/S期细胞数量增加。
3 讨 论
NGF是神经营养因子家族成员,对细胞分化至关重要〔13〕。报道称神经生长因子能促进PC12细胞分化,且在促进PC12细胞分化成神经元细胞中具有重要作用〔14〕。与NGF促进PC12细胞的分化作用相同,NGF诱导HT22细胞神经突长度的增加。本研究结果表明,NGF刺激了HT22细胞的分化。
报道称在受NGF诱导PC12细胞分化时,伴随着DNMT1和DNMT3A表达的减少,DNMT3B的表达选择性上调〔4〕,与本研究结果相反。本研究结果表明,受NGF诱导的HT22细胞的分化与DNMTs mRNA和蛋白质表达水平的变化及其活性的增强相关。
