姜黄素通过促进ROS产生诱导人脑胶质瘤细胞凋亡
2020-06-02刘国安靳亚东冉苗苗李贵琛杨麒励
刘国安,靳亚东,冉苗苗,李贵琛,杨麒励,丁 兰
西北师范大学生命科学学院,兰州730070
癌症治疗是当代生物医学最严峻的挑战,丰富的天然产物仍然是人们研究并寻找活性药物的宝库。姜黄素(curcumin,Cur)(1,7-双(4-羟基-3-甲氧基苯基)-1,6-庚二烯-3,5-二酮;diferuloylmethane),结构式见图1,一种脂溶性的黄色化合物,为姜科植物姜黄CurcumalongaLinn的根茎中提取到的姜黄素类化合物中含量最多的一种。姜黄粉用作香料给咖喱提供特定的风味和黄色,具有悠久的食用历史。早期还用来治疗咬伤,烧伤和粉刺等疾病[1]。近些年发现具广泛的药理活性。姜黄素具有抗炎活性、消除自由基、抗衰老功能及对化疗药物增敏作用等[2],并对肿瘤血管生成和肿瘤转移的关键分子有抑制作用[3]。临床研究显示对多种慢性疾病包括肺病,自身免疫疾病和癌症有效[4],其中对其抗癌活性与机理的研究较多。大部分研究发现,姜黄素的多种药理活性与其抗氧化作用相关[5],它可能在癌发生的各个阶段起到抑制作用。但近些年大量研究发现,很多具抗氧化活性的酚类物质在一定的条件下却表现出促氧化作用,而肿瘤细胞高代谢率引起细胞内活性氧(reactive oxygen species,ROS)高于正常细胞。因此利用促氧化剂进一步升高癌细胞中的ROS,继而杀死癌细胞成为治疗癌症的策略之一。本文检测了姜黄素对人胶质瘤细胞U87的生长抑制作用,并检测了氧化还原指标及凋亡信号通路,试图揭示其作用机理。
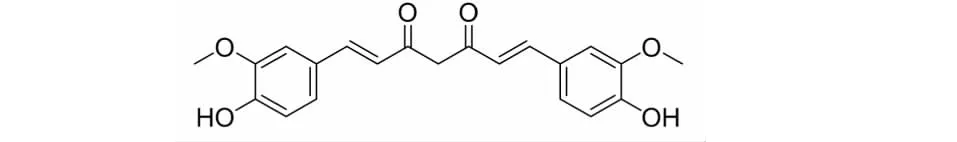
图1 姜黄素结构式
1 材料与方法
1.1 细胞
人胶质瘤细胞U87购自中国科学院上海细胞库
1.2 试剂与仪器
DMEM培养基购自美国Gibco公司,姜黄素购自北京索莱宝科技有限公司(lot:822A025纯度:99.34%),L型谷胱甘肽购自美国Sigma公司,CCK-8和GKT137831购自AbMole公司,活性氧检测试剂盒购自BestBio贝博生物有限公司,DCFH-DA荧光探针购自苏州宇恒生物科技有限公司,SOD酶活试剂盒、T-AOC试剂盒、GSH/GSSG测试盒、MDA试剂盒均购自南京建成生物工程研究所。NADPH-OX(NADPH oxidase)酶联免疫试剂盒购自江来生物科技有限公司,NF-κB/p65单抗、Caspase-3单抗和Caspase-1单抗均购自英国Abcam公司,超敏ECL化学发光试剂盒为新赛美生物有限公司生产。二甲基亚砜购自美国Merck公司,胎牛血清为杭州四季青生物科技公司生产。
超净工作台(苏州苏净集团),CKKX41SF倒置显微镜(日本东京Olympus),IX71型荧光显微镜(日本东京Olympus),基础电泳仪(美国BIO-RAD),多功能凝胶成像系统(美国BIO-RAD),Coulter Allegra64R高速低温离心机(美国Beckman),BIO-RAD m680酶标仪(美国BIO-RAD),细胞培养板(美国Costar),FACSCalibur流式细胞仪(美国BD公司)。
1.3 实验方法
1.3.1 细胞培养与形态学观察
人脑胶质瘤细胞U87培养于含10%灭活小牛血清、青霉素80 U/mL及链霉素80 μg/mL DMEM完全培养基中,37 ℃、5% CO2饱和湿度培养箱中培养。将对数生长期的U87细胞用胰酶消化后调整细胞密度为1.5×105个/mL,接种于6孔板培养24 h,分别加入5 mmol/L谷胱甘肽(glutathione,GSH)预处理1 h后或直接加入终浓度为0、5、10、20、40 μmol/L的姜黄素的完全培养基,继续培养24 h。倒置显微镜下观察细胞形态学的变化并拍照。
1.3.2 CCK-8法检测姜黄素对细胞增殖抑制
CCK-8法检测活细胞数较传统的MTT法更敏感。四唑盐WST-8是MTT类似物,细胞线粒体脱氢酶在电子载体存在时可以将WST-8还原成高水溶性的黄色甲瓒产物,生成的甲瓒与活细胞的数量成正比,颜色深浅表示细胞数多少。检测时U87细胞以密度10×104个/mL接种于96孔板中,贴壁培养24 h后,加入含有不同浓度姜黄素的完全培养基100 μL,培养24 h后每孔加入10% CCK-8溶液10 μL,继续孵育4 h,酶标仪检测450 nm吸光值。细胞生长率计算公式为:生长率=Ai/A0×100%,其中,Ai表示处理组的吸光值,A0表示空白对照组的吸光值。线性回归分析计算半抑制浓度(50% inhibitory concentration,IC50)。
1.3.3 荧光显微镜检测U87细胞内活性氧水平
将培养至对数期的U87细胞配制成浓度为1.5×105个/mL的细胞悬液,接种于六孔板培养24 h后,GSH预处理1 h或者只加入不同浓度姜黄素,继续培养3 h后pH 7.4 PBS洗涤,加入DCFH-DA荧光探针37 ℃染色30 min,PBS洗后荧光显微镜检测。
1.3.4 流式细胞术检测U87细胞内活性氧水平
将3 mL密度为1.5×105个/mL的U87细胞接种于60 mm细胞培养皿中,处理后离心收集细胞,PBS洗涤后加入DCFH-DA,染色后收集细胞,再以PBS洗涤后经260目尼龙网过滤后上流式细胞仪检测。
1.3.5 酶联免疫标记检测NADPH氧化酶活力
以1.5×105个细胞/mL接种U87细胞于6孔板,培养24 h后加不同浓度的姜黄素处理后收集细胞,反复液氮冻融使细胞破碎并释放出细胞内容物。3 000 rpm离心20分钟,收集上清。抗体夹心法酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒检测,酶标仪测定450 nm处吸光值,计算样品NADPH-OX浓度。
1.3.6 丙二醛(MDA)含量、GSH含量、细胞总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活性检测
将细胞以1.5×105个/mL密度接种于6孔板中培养24 h,加不同浓度姜黄素处理24 h;吸去上清并用PBS洗两遍,细胞刮下反复冻融,BCA法测定细胞样品蛋白浓度。测定时按各试剂盒说明操作。
1.3.7 AO/EB荧光染色法检测U87细胞凋亡
细胞以浓度为1.5×105个/mL接种于6孔板,培养24 h后分别加入姜黄素或先以GSH预处理,继续培养24 h后收集细胞,PBS洗涤后加入AO/EB染色,于荧光显微镜下观察细胞并拍照。
1.3.8 Annexin V/PI双染法流式细胞术检测细胞凋亡
将细胞以1.5×104个/mL密度接种于细胞培养皿中,24 h后加不同浓度姜黄素处理24 h后收集细胞,用预冷的PBS洗涤细胞,YF48Annexin V和PI避光孵育处理后,流式细胞仪检测细胞凋亡。
1.3.9 Western blot法检测细胞信号通路蛋白
接种于培养皿中的U87细胞经药物处理24 h之后,用预冷的PBS清洗细胞,裂解细胞后离心取上清以BCA法测定样品蛋白浓度。常规SDS-PAGE电泳后转膜,封闭后一抗及二抗孵育,清洗之后的PVDF膜放于暗盒中,滴加超敏ECL(electrochemiluminescence)化学发光剂,室温下避光60 s,凝胶图像分析仪进行拍照。
1.4 数据统计与制图
用SPSS数据统计软件完成t检验和方差分析,实验结果以mean±SD表示,图片用Origin 软件制作,化学结构式用Chemdraw绘制。
2 结果
2.1 姜黄素对U87细胞的毒性及GSH的抑制作用
CCK-8法检测化合物作用于细胞24 h的增殖率可以看出(图2),姜黄素对U87细胞生长有明显的抑制作用。5 μmol/L就表现出细胞毒性,与对照组相比,各剂量细胞增殖率均显著降低(P<0.01),且随着姜黄素浓度的升高,细胞增殖率逐渐下降。姜黄素浓度在5~100 μmol/L范围内,细胞增殖率从91.68%降至36.01%,显示细胞生长率与姜黄素浓度有剂量依赖关系,回归分析可知IC50=68.32 μmol/L。
显微镜下观察U87细胞生长状态及形态学变化显示(图3),5 μmol/L姜黄素处理组与对照组细胞相近(图3:A和B)。10、20、40 μmol/L姜黄素处理组细胞形态改变明显(图3:C、D、E),显示胞体两端突起,呈收缩细胞增多,贴壁细胞减少,姜黄素浓度较高时细胞失去贴壁性,悬浮在培养基中,有些似已死亡。但10和40 μmol/L姜黄素与5 mmol/L GSH联合处理后细胞明显趋向正常,尤其40 μmol/L组圆形细胞明显变少,神经突起状细胞增多,与对照组细胞相比,无明显的细胞形态改变。GSH是一种抗氧化剂,联合作用后细胞受损情况减弱,贴壁细胞增多,细胞状态恢复到与对照组相似的形态,说明GSH可能通过抗氧化抑制姜黄素引起的氧化损伤,使细胞向正常生长状态恢复。
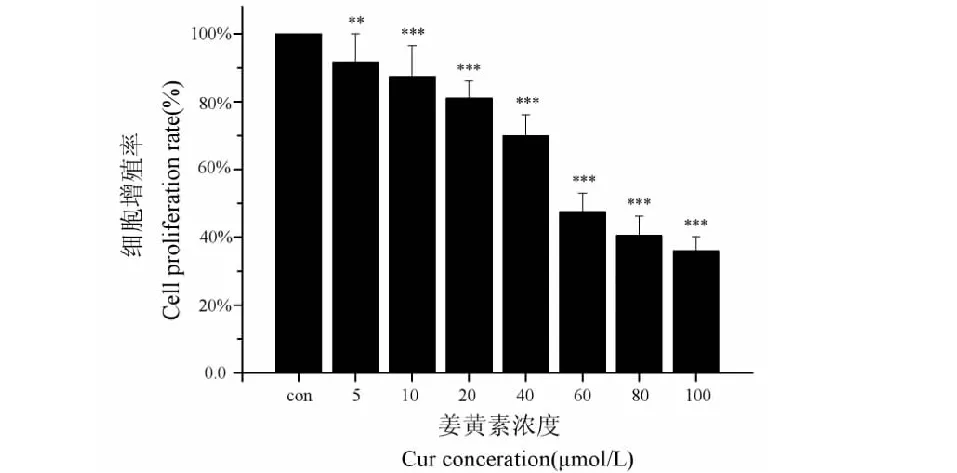
图2 CCK-8法检测姜黄素作用下U87细胞的增殖率
2.2 姜黄素处理使U87细胞ROS升高
ROS是细胞正常代谢过程中产生的包括超氧阴离子自由基等含氧的不稳定离子或小分子,参与细胞生长增殖、发育分化、衰老和凋亡以及许多生理和病理过程。DCFH-DA荧光探针检测细胞显示,姜黄素作用后细胞内ROS升高。对照组细胞内DCF荧光发光微弱(图4:A)表明细胞内ROS含量较低。5、10 μmol/L姜黄素处理U87细胞3 h后胞内荧光依次增强(图4:B和C)表明ROS含量依次增高。而GSH的加入清除了胞内部分ROS(图4:E和F)。
荧光染色后流式细胞术检测细胞内活性氧结果也显示姜黄素促进ROS升高。以对照组荧光强度为1时处理组相对强度见图5,U87细胞经姜黄素(5和10 μmol/L)处理3、6 h后,ROS含量显著上升,且10 μmol/L姜黄素处理组上升水平更显著,是未处理细胞的2倍多。说明在6 h内姜黄素以时间-剂量依赖的方式使U87细胞内ROS水平升高。在加入抗氧化剂GSH预处理1 h组,5和10 μmol/L姜黄素组的ROS水平较姜黄素单独处理均明显降低。说明姜黄素可以引起ROS含量的显著升高,而且抗氧化剂GSH减弱了这种作用。
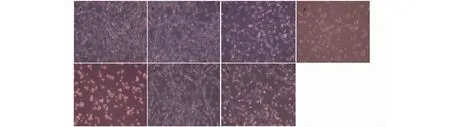
图3 姜黄素与GSH对U87细胞形态的影响(200×)
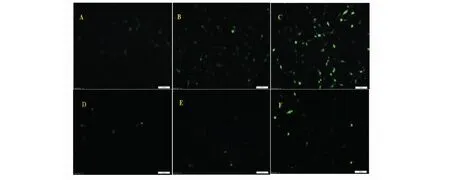
图4 DCFH-DA荧光探针检测姜黄素和GSH作用于U87细胞ROS的变化
2.3 姜黄素诱导U87细胞NADPH氧化酶活性增高
细胞中除了线粒体呼吸链,NADPH-OX是细胞内ROS的主要来源。当以5~40 μmol/L姜黄素作用于U87细胞后,检测发现NADPH-OX活性逐渐升高(图6),10 μmol/L就显示显著差异。NADPH-OX抑制GKT137831的加入,使酶活性差异显著下降。
2.4 姜黄素处理后U87细胞处于氧化胁迫
当细胞中抗氧化系统难以抵御ROS的氧化作用,氧化胁迫(oxidative stress)就会威胁到细胞的正常代谢。MDA是脂质过氧化的产物,其含量反应了细胞膜受ROS氧化损伤的程度。姜黄素处理后细胞MDA含量随姜黄素浓度升高而增加(图7:A),说明5~40 μmol/L浓度的姜黄素引起细胞膜浓度依赖性氧化损伤,且自10 μmol/L起MDA即显著、40 μmol/L时已极显著升高。还原型GSH是细胞内重要的抗氧化因子,具有清除内源性或外源性活性氧代谢产物的作用。姜黄素作用后,GSH含量急剧下降(图7:B),40 μmol/L姜黄素使得GSH下降为原来的十分之一,表明姜黄素的作用使得细胞中氧化作用消耗了大量还原力。
T-AOC是包括酶和非酶系统在内的全部抗氧化物的总抗氧化能力的指标。姜黄素处理使细胞T-AOC显著并呈浓度依赖性降低(图7:C)。SOD是生物体内重要的抗氧化酶,可以清除超氧阴离子等超氧化物,对抗与阻断对细胞造成的损害。如图(7:D)所示,浓度较低(5 μmol/L)时,姜黄素处理降低了细胞SOD,表明氧化胁迫消耗了一部分酶,而浓度升高至10、20 μmol/L时酶活性升高,而40 μmol/L姜黄素处理SOD含量又降低。这可能是由于姜黄素引起的促氧化诱导了SOD的产生,高浓度的姜黄素促氧化作用过强,损伤并降低了细胞SOD活性。

图5 姜黄素单独及与GSH连用后3和6 h后的活性氧水平
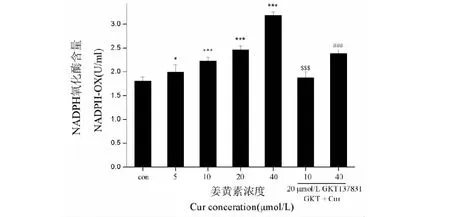
图6 姜黄素作用下U87细胞内NADPH氧化酶活力升高
2.5 姜黄素诱导U87细胞凋亡
荧光染色法检测细胞凋亡的原理是,吖啶橙(acridine orange,AO)能通过细胞膜并嵌入细胞核DNA,发出明亮的绿色荧光;嗅化乙锭(ethidium bro mide,EB)只能进入细胞膜受损的细胞,嵌入细胞DNA并发出橙色荧光。荧光显微镜下可见活细胞核染色质呈均一绿色,早期凋亡细胞核染色质呈绿色凝聚或圆珠状。晚期凋亡细胞呈橙色、固体或圆珠状。非凋亡坏死细胞核染色质呈橙色。

图7 姜黄素作用下U87细胞丙二醛水平、谷胱甘肽含量、总抗氧化能力及超氧化物歧化酶活力
姜黄素处理U87细胞24 h后,AO/EB染色的结果如图8所示,对照组细胞核完整,显示为绿色荧光均一的正常形态(图8:A);5 μmol/L姜黄素处理细胞核内出现染色质凝集,类似早期凋亡(图8:B);10 μmol/L姜黄素引起细胞核内出现黄色和橘红色染色质,表明出现了晚期凋亡(图8:C)。浓度至40 μmol/L时细胞核内出现大量的红色染色质和部分黄色染色质,且核染色质呈固缩状,表明出现了细胞晚期凋亡和坏死(图8:D)。当姜黄素与5 mmol/L GSH联合处理后,呈黄色和红色的核染色质的细胞减少,绿色均一荧光细胞回升(图8:E,F)。可见5~40 μmol/L姜黄素可使U87细胞凋亡,抗氧化剂GSH能减弱姜黄素诱导的U87细胞核损伤及凋亡。

图8 AO/EB法检测姜黄素诱导人脑胶质瘤U87细胞凋亡
Annexin V/PI双染后以流式细胞术检测可量化凋亡细胞。在细胞凋亡的早期阶段,磷酯酰丝氨酸(phosphatidylserine,PS)会外翻到细胞膜的外侧,Annexin V可以选择性结合PS。碘化丙啶(propidium iodide,PI)是一种DNA结合染料,可在细胞凋亡后期对坏死细胞或失去细胞膜完整性的细胞核进行染色,通过流式细胞分析可以检测细胞的状态。
Annexin V/PI双染,流式细胞术检测凋亡细胞结果如图9所示,姜黄素处理组细胞凋亡率上升,呈现浓度依赖性,姜黄素浓度越高,U87细胞凋亡率越高。5、10、20、40 μmol/L处理后细胞总凋亡率从3.87%升高至98.70%。在10、40 μmol/L 姜黄素组加入抗氧化剂GSH联合处理后,细胞总凋亡率分别从7.33%和98.70%下降到6.65%和70.85%,明显减弱了姜黄素诱导的凋亡作用,进一步说明姜黄素通过促氧化诱导U87细胞凋亡。
2.6 Western blot法检测细胞凋亡信号通路蛋白
通过Western blotting检测凋亡相关蛋白信号通路(图10)发现,姜黄素处理使NF-κB/p65蛋白的表达水平明显下降,与5 mmol/L GSH共同处理后蛋白表达水平上升,表明姜黄素引起的ROS升高可以下调NF-κB/p65蛋白的表达;检测线粒体内源性凋亡途径中相关蛋白发现,姜黄素可以升高促凋亡蛋白Bax的表达,降低抗凋亡蛋白Bcl-2的表达,即升高Bax/Bcl-2值;并发现姜黄素诱导的细胞凋亡可能是Caspase依赖的。检测结果显示姜黄素下调了Pro Caspase-3的表达,说明相对增加了其激活形式的Caspase-3的量,进而诱导了细胞凋亡。加入抗氧化剂GSH检测这些蛋白显示,GSH均逆转了姜黄素的作用,也说明姜黄素诱导的细胞死亡是通过促氧化作用实现的。
综合以上各项研究结果表明,姜黄素在作用于人脑胶质瘤U87细胞后,通过提高细胞NADPH氧化酶活性而促进ROS产生,引起细胞内氧化应激指标改变,包括T-AOC降低、MDA升高、GSH下降、SOD升高,即姜黄素处理使得U87细胞处于氧化胁迫,且随着浓度升高胁迫加重。ROS的升高,触发了细胞信号通路,下调NF-κB/p65蛋白的表达,诱导线粒体内源性凋亡途径中Bax和Bcl-2的差异性表达,最终通过凋亡执行分子Caspase-3使细胞凋亡。

图9 YF488-Annexin V/PI双染流式细胞术法检测姜黄素与GSH诱导U87细胞凋亡

图10 姜黄素对NF-κB、Bax、Bcl-2、Caspase-3蛋白表达的影响
3 讨论与结论
姜黄素是一种天然膳食多酚类化合物,具有抗癌、抗炎、抗氧化、抗菌、抗病毒、抗糖尿病和促进伤口愈合等多种药理活性。其中抗癌活性备受关注,少量动物模型的实验也证明了姜黄素的抗癌作用。包括多名患者的65个临床试验也证明,姜黄素对人类健康有广泛的有益影响[6]。构效关系研究揭示一些苯环上甲氧基的存在提高了姜黄素的活性[7]。研究表明,姜黄素是通过抗氧化抑制多种类型癌细胞生长,包括肺癌、乳腺癌、宫颈癌、肝癌、胰腺癌和结肠癌,但对人脑胶质瘤的研究甚少。
正常情况下ROS作为活性因子参与细胞信号传导和转录。一些体内外因素会引起ROS升高,若细胞氧化-还原失去平衡产生氧化胁迫,ROS就会通过损伤DNA导致突变而作为癌发生的触发剂。但与正常细胞相比,癌细胞有更高含量的ROS为人们提供了通过加强氧化胁迫杀死癌细胞的思路。一些抗癌药物如紫杉醇可通过产生ROS损伤癌细胞或通过ROS干扰癌细胞代谢。甚至有些抗癌试剂如荜茇明碱(piperlongumine)只结合于癌细胞的几个抗氧化酶如GST和羰基氧化酶的活性位点[8]。很多文献报道了姜黄素的促氧化作用,有研究发现姜黄素可通过提高细胞ROS及相关细胞凋亡信号诱导细胞凋亡[9]。这些似乎与姜黄素的抗氧化作用相矛盾,究其原因,是该化合物作用时的浓度和处理细胞的种类决定的,低浓度时具有抗氧化作用。如用脂多糖处理小胶质细胞(microglia,MG),氧化指标一氧化氮和其合成酶等都升高,而抗氧化酶SOD活性降低。在较低浓度(10~20 μmol/L)的姜黄素作用下,一氧化氮和合成酶等都明显降低,SOD活性明显上升,表明姜黄素在此浓度下具抗氧化性[10],与本文中姜黄素在10~20 μmol/L时对U87细胞SOD活力提升一致。当用姜黄素处理食管癌 KYSE410时,该细胞的MDA含量升高,SOD水平降低,较高浓度(40 μmol/L)引起的氧化胁迫更严重[11]。此外,不同种类细胞效果也不尽相同[12]。本文用姜黄素处理U87细胞,显示姜黄素抑制U87细胞增殖、细胞活性氧水平升高、氧化胁迫增加进而引起细胞信号蛋白变化,最终诱导细胞凋亡。这些结果将为姜黄素的临床应用提供重要数据和理论参考。
