大叶糖胶树吲哚生物碱化学成分研究
2020-06-02张金苹闫慧娇王亚兰王志伟王晓静
张金苹,闫慧娇,王亚兰,王志伟*,王晓静*
1济南大学 山东省医学科学院医学与生命科学学院,济南 250200;2山东省分析测试中心 齐鲁工业大学(山东省科学院),济南 250014;3山东省医学科学院药物研究所;4国家卫生部生物技术药物重点实验室 山东省罕少见病重点实验室,济南 250062
大叶糖胶树是鸡骨常山属(夹竹桃科)植物,该属植物为灌木和乔木,主要生长在非洲和亚洲的热带地区,我国主要分布于广东、云南、广西等地。鸡骨常山属在民间用药比较广泛,其药理活性包括抗高血压、抗菌抗炎和镇痛[1,2]、镇咳[3]、抗哮喘和祛痰活性、抗疟疾、胃肠道疾病,癌症[4]和许多其他疾病。鸡骨常山属植物已被证明是丰富的生物碱来源,特别是吲哚类生物碱,从中分离得到的吲哚生物碱结构骨架变化多样,有诸多潜在的研究价值。
2005年,Ganesh Chandra Jagetia课题组对不同季节的鸡骨常山属植物中生物碱对人宫颈癌细胞HeLa的体外活性进行研究[5],2006年该课题组又对鸡骨常山属植物中生物碱进行了一系列人肿瘤细胞的活性实验,包括人宫颈癌细胞HeLa和人肝癌细胞HepG2,KB细胞人口腔表皮样癌细胞,MCF-7人乳腺癌细胞[6]。2018年,Toh-Seok Kam课题组从鸡骨常山属植物中分离的双生物碱也表现出对KB、PC-3、LNCaP、MCF7、MDA-MB-231、HT-29、HCT 116和549的明显细胞毒性[7]。目前,国内外对大叶糖胶树的研究较少,为了更合理地开发利用,基于前期课题组对吲哚生物碱的研究[8],我们对大叶糖胶树枝叶进行研究,并测试所有化合物对HCT-116人结肠癌细胞和DLD-1人结直肠腺癌上皮细胞的细胞毒性。
1 仪器与材料
Agilent 1100型高效液相色谱仪;Bruker Avance III 400 NMR型核磁共振仪;Agilent Technology 6520 Accurate-Mass Q-TOF 型质谱仪;艾杰尔LC-6AD制备液相色谱仪(天津);Thermo Acclaim TM 120 C18分析型色谱柱(4.6 mm × 250 mm,5 μm);Daisogel C18制备型色谱柱(20 × 250 mm,10 μm);ODS-C18(日本YMC公司产品)硅胶及高效薄层板(青岛海洋化工厂和Merck公司);分析甲醇(天津市科密欧化学试剂有限公司)。
人结肠癌细胞HCT-116细胞株(中国协和医科大学细胞中心);DLD-1人结直肠腺癌上皮细胞(中国协和医科大学细胞中心)。HF 90二氧化碳培养箱(上海力升科学仪器);Nikon Eclipse Ts 2倒置显微镜;LDZM立式压力蒸汽灭菌锅(上海申安医疗器械厂);Spark多功能酶标仪试剂(瑞士Tecan公司);湘仪离心机(湖南湘仪实验室仪器开发有限公司);DMEM高糖培养基(hyclone);青链霉素混合液(索莱宝);PBS;MTT(索莱宝);胰酶(索莱宝)。
大叶糖胶树(Alstoniamacrophylla)采集于广西白色市吞盘乡,样品编号:AR-201903,存放于山东省分析测试中心中药资源可持续利用研究室。
2 方法
2.1 提取与分离
大叶糖胶树枝叶10.2 kg,粉碎,用95%乙醇对粉碎物进行了加热回流提取,浓缩,得到总提取物1 407 g。加水混悬,用2% HCl调pH至2~3以二氯甲烷反复萃取,用10% NaOH 调pH至9~10,以二氯甲烷萃取得总生物碱部位18.0 g和乳化部位61.3 g。
将总生物碱部位18.0 g进行硅胶柱层析,二氯甲烷:甲醇(150∶1→1∶1)梯度洗脱,经HPLC检测后合并得到13个部位(Fr.a~Fr.m)。将Fr.f(1.2 g)进一步经硅胶柱层析,二氯甲烷:甲醇(50∶1→1∶1)梯度洗脱得40个部位(Fr.f-1~Fr.f-40),其中Fr.f-15(445 mg)以55%甲醇-水(含5 mM碳酸铵,10 mL/min,UV 254 nm)经制备液相色谱洗脱,得到化合物1(400 mg,tR27.4 min)。Fr.f-7(103 mg)以59%甲醇-水(含5 mM碳酸铵,10 mL/min,UV 254 nm)经制备液相色谱洗脱,得到化合物2(40 mg,tR29.9 min)。Fr.e(356.5 mg)经葡聚糖凝胶柱层析洗脱得23个部位(Fr.e-1~Fr.e-23),其中Fr.e-22(130 mg)以45%甲醇-水(含5 mM碳酸铵,10 mL/min,UV 254 nm)经制备液相色谱洗脱,得到化合物3(37 mg,tR19.6 min)。Fr.i(1.5 g)进一步经硅胶柱层析,二氯甲烷:甲醇(20∶1→1∶1)梯度洗脱得24个部位(Fr.i-1~Fr.i-24),其中Fr.i-17~21(272 mg)以42%甲醇-水(含5 mM碳酸铵,10 mL/min,UV 254 nm)经制备液相色谱洗脱,得到化合物4(26 mg,tR22.9 min)。Fr.i-22即为化合物5(44 mg,tR10.0 min)。
将大叶糖胶树的乳化部位进行硅胶柱层析,经二氯甲烷:甲醇(100∶1→1∶2)梯度洗脱,经HPLC检测后合并得到5个部位(Fr.1~Fr.5)。其中Fr.3(0.6 g)以59%甲醇-水(含5mM 碳酸铵,10 mL/min,UV 254 nm)经制备液相色谱洗脱,得到化合物6(32 mg,tR28.3 min)。
2.2 HCT-116和DLD-1的细胞毒性试验
HCT-116和DLD-1细胞株的培养将细胞用含10%新生牛血清的DMEM完全培养基(NaHCO3,2 g,100 μg/mL青霉素、100 μg/mL链霉素)培养,37 ℃,5% CO2培养箱培养至细胞覆盖率达90%以上时传代,生长状态良好的细胞用于实验研究。
取96孔细胞培养板,每孔加入浓度为1×104个/mL的细胞悬液100 μL,37 ℃、5% CO2培养箱中贴壁培养24 h后,吸弃原培养液,加入含不同质量浓度的受试药物(溶解在含0.1% DMSO的培养基中)100 μL/孔,使其终质量浓度分别为100 μg/mL(C1)、50 μg/mL(C2)、25 μg/mL(C3)、12.5 μg/mL(C4)、6.3 μg/mL(C5)和3.1 μg/mL(C6),每质量浓度3个复孔,空白组加入等量含0.1% DMSO的培养基(C0),以顺铂为阳性对照,37 ℃、5% CO2培养箱中培养36 h。取出细胞培养板,倒置显微镜下观察细胞形态。每孔加入10 μL MTT溶液(5 mg/mL),继续培养4 h。弃去MTT,每孔加入100 μL DMSO,振荡,使结晶物充分溶解。酶联免疫检测仪490 nm处测量各孔的吸光度值。计算IC50。试验重复进行3次。
3 实验结果
3.1 化合物结构鉴定
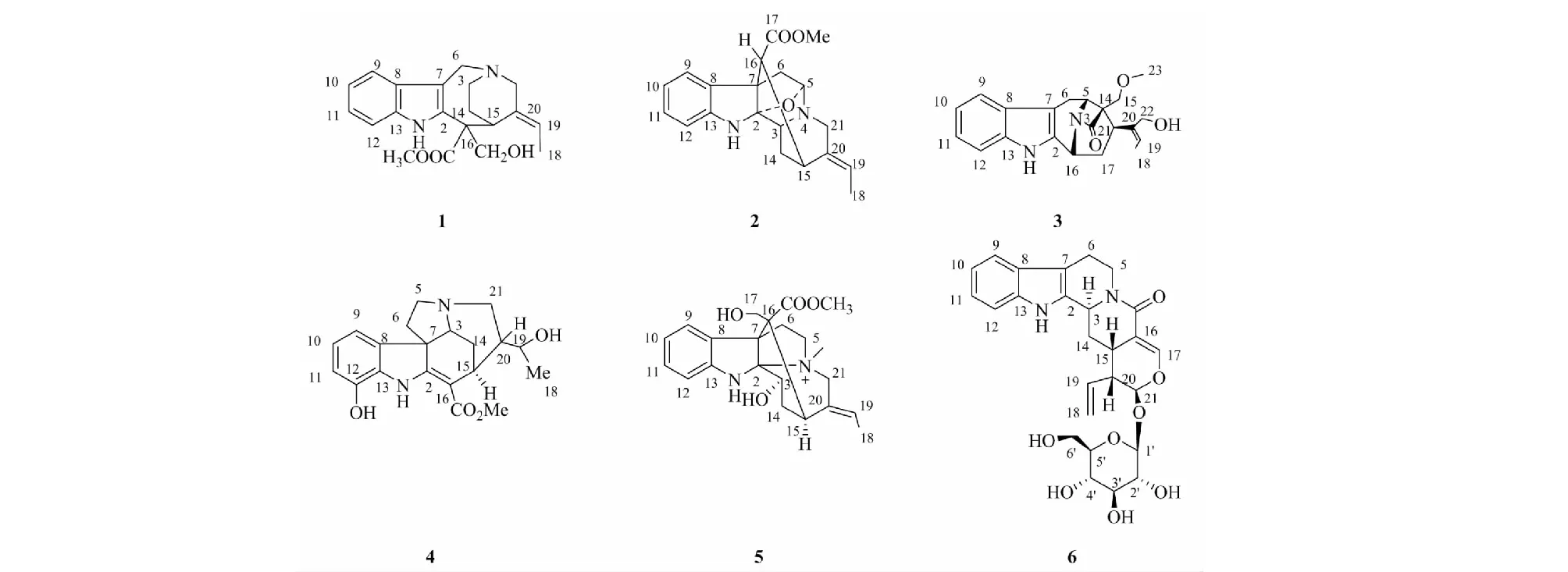
图1 化合物1~6的化学结构
化合物1白色无定形粉末(甲醇);碘化铋钾反应阳性,提示为生物碱类化合物。ESI-MS:m/z341[M+H]+。1H NMR(400 MHz,CD3OD)谱显示有4个吲哚环上的芳香氢信号δH7.50(1H,d,J=8 Hz,H-9),7.42(1H,d,J=8 Hz,H-12),7.18(1H,t,J=7.2 Hz,H-11),7.10(1H,t,J=7.2 Hz,H-10);5个连接氮、氧或者双键的信号δH5.77(1H,q,J=6.8 Hz,H-20),5.02(1H,d,J=15.6 Hz,H-6),4.45(1H,q,J=15.6 Hz,H-6),4.20(1H,d,J=10 Hz,H-17),3.98(1H,d,J=10 Hz,H-17),1个连接吸电子基团的甲基信号1.81(3H,d,J=6.8 Hz,H-18);13C NMR(100 MHz,CD3OD)谱10个烯碳信号δC136.8(C-13),136.5(C-2),131.5(C-20),128.8(C-19),126.6(C-8),123.8(C-11),120.9(C-10),118.2(C-9),112.4(C-12),102.4(C-7);4个连氧或氮原子的碳信号δC70.3(C-17),60.2(C-16),53.4(C-21),53.4(-OCH3)以上数据与文献[9]报道基本一致,故确定化合物1为vallesamine。
化合物2红棕色无定形粉末(氯仿);碘化铋钾反应阳性,提示为生物碱类化合物。ESI-MS:m/z339[M+H]+。1H NMR(400 MHz,CDCl3)谱显示有4个吲哚环上的芳香氢信号δH7.09(2H,overlapped,H-9,12),6.76(2H,overlapped,H-10,11),2个连接氮、氧或者双键的信号δH5.40(1H,d,J=8 Hz,H-19),4.82(1H,s,H-5);1个甲氧基信号δH3.66(3H,s,-OCH3);13C NMR(100 MHz,CDCl3)谱8个烯碳信号δC147.6(C-13),136.4(C-20),135.2(C-8),127.9(C-11),125.1(C-9),120.8(C-10),120.3(C-19),110.6(C-12);1个羰基碳信号δC172.5(C-COOCH3),8个连氧或氮原子的碳信号δC106.3(C-2),87.4(C-5),52.0(C-3),51.8(C-16),51.4(C-OMe),51.2(C-7),46.4(C-21)以上数据与文献[10]报道基本一致,故确定化合物2为picrinine。
化合物3淡黄色无定形粉末(甲醇);碘化铋钾反应阳性,提示为生物碱类化合物。ESI-MS:m/z353[M+H]+。1H NMR(400 MHz,CD3OD)谱显示有4个吲哚环上的芳香氢信号δH7.43(1H,d,J=8.4 Hz,H-9),7.26(1H,d,J=8 Hz,H-12),7.03(1H,t,J=7.2 Hz,H-11),6.96(1H,t,J=7.6 Hz,H-10);2个连接氮、氧或者双键的信号δH5.44(1H,d,J=6.8 Hz,H-19),4.22(1H,d,H-16);1个连接吸电子基团的甲基信号δH1.68(3H,d,J=6.4 Hz,H-18);13C NMR(100 MHz,CD3OD)谱10个烯碳信号δC137.2(C-13),137.1(C-2),136.6(C-20),126.6(C-8),120.7(C-11),118.3(C-10),117.2(C-19),116.8(C-9),110.6(C-12),104.7(C-7);6个连氧或氮原子的碳信号δC67.6(C-15),57.6(C-5),54.7(C-22),51.3(C-23),50.4(C-14),50.2(C-16)。以上数据与文献[11]报道基本一致,故确定化合物3为khasuanine A。
化合物4棕褐色无定形粉末(甲醇);碘化铋钾反应阳性,提示为生物碱类化合物。ESI-MS:m/z357[M+H]+。1H NMR(400 MHz,CD3OD)谱显示有3个吲哚环上的芳香氢信号δH6.78(2H,overlapped,H-9,10),6.68(1H,m,H-11),1个甲氧基的氢信号δH3.86(3H,s,-OCH3);1个甲基的氢信号δH1.13(3H,d,J=6.0 Hz,H-18);13C NMR(100 MHz,CD3OD)谱8个烯碳信号δC171.9(C-2),141.5(C-12),136.7(C-8),110.8(C-9),122.2(C-10),115.0(C-11),131.0(C-13),96.3(C-16);1个羰基碳信号δC169.6(C-COOCH3);5个连氧或氮原子的碳信号δC60.7(C-3),57.5(C-7),53.1(C-5),68.2(C-19),50.9(C-OCH3),以上数据与文献[12]报道基本一致,故确定化合物4为scholaricine。
化合物5白色晶体(DMSO);碘化铋钾反应阳性,提示为生物碱类化合物。ESI-MS:m/z385[M]+。1H NMR(400 MHz,DMSO)谱显示有4个吲哚环上的芳香氢信号δH7.75(1H,d,J=7.6 Hz,H-9),7.11(1H,t,J=7.6 Hz,H-11),6.76(2H,overlapped,H-10,12),1个与氮原子相连的氢信号δH7.54(1H,s,NH);4个连接氮、氧或者双键的信号δH5.74(1H,q,J=6.8 Hz,H-19),4.40(2H,overlapped,H-3,H-21α),4.25(1H,d,J=15.2 Hz,H-21β);3个连接吸电子基团的甲基信号δH3.75(3H,s,-OCH3),3.29(3H,s,-NCH3),1.80(3H,d,J=7.6 Hz,H-18);13C NMR(100 MHz,DMSO)谱8个烯碳信号δC147.5(C-13),132.6(C-20),129.8(C-19),128.8(C-11),128.7(C-8),126.7(C-9),119.5(C-10),110.6(C-12);1个羰基碳信号δC173.2(C-COOCH3);9个连氧或氮原子的碳信号δC100.0(C-2),68.8(C-3),64.7(C-21),64.6(C-17),61.8(C-5),60.6(C-7),55.7(C-16),51.9(-OCH3),49.6(-NCH3)。以上数据与文献[13]报道基本一致,故确定化合物5为echitamine。
化合物6棕褐色无定形粉末(甲醇);碘化铋钾反应阳性,提示为生物碱类化合物。ESI-MS:m/z499[M+H]+。1H NMR(400 MHz,CD3OD)谱显示有4个吲哚环上的芳香氢信号δH7.38(1H,d,J=7.2 Hz,H-9),7.34(1H,d,J=8 Hz,H-12),7.08(1H,t,J=7.2 Hz,H-11),7.00(1H,t,J=7.6 Hz,H-10);4个连接氮、氧或者双键的信号δH5.64(1H,m,H-19),5.40(1H,br s,H-21),5.33(2H,t,J=10.4 Hz,H-18);13C NMR(100 MHz,CD3OD)谱12个烯碳信号δC136.4(C-13),133.4(C-19),133.0(C-2),127.3(C-8),121.1(C-11),119.2(C-18),118.8(C-10),117.3(C-9),110.9(C-12),108.9(C-7),108.9(C-7),107.9(C-16);1个羰基碳信号δC165.7(C-C=O);1个单糖的碳信号δC99.1(C-1′),76.8(C-3′),76.7(C-5′),72.9(C-2′),70.0(C-4′),61.2(C-6′)。以上数据与文献[14]报道基本一致,故确定化合物6为strictosamide。
3.2 HCT-116和DLD-1细胞毒活性
对HCT-116人结肠癌细胞和DLD-1人结直肠腺癌上皮细胞毒活性,镜下观察可见,化合物2和4组细胞形态不规则,破碎明显,其余各化合物不同剂量组细胞形态规则,生长良好,未见细胞破碎等现象,阳性药顺铂组细胞出现明显的细胞破碎现象。各化合物对HCT-116人结肠癌细胞和DLD-1人结直肠腺癌上皮细胞IC50值(见表1)。从表1可知,化合物4的IC50值为16.7 μg/mL,对HCT-116人结直肠腺癌上皮细胞株具有较高的细胞毒活性。

表1 各化合物对HCT-116和DLD-1的IC50值
*结果用每次实验平均值± SD表示(n=3);a阳性对照药。
*The results are expressed as mean ± SD of each experiment(n=3);aPositive control.
4 结论
本文对大叶糖胶树的进行了化学成分研究,分离得到6个不同骨架的单萜吲哚生物碱类化合物,其中化合物3和6为首次从该属植物中分离得到,化合物1、2、4、5为首次从该植物中分离得到。对分离得到的6个化合物进行了对HCT-116人结肠癌细胞和DLD-1人结直肠腺癌上皮细胞毒活性试验,结果显示,化合物2和4具有一定的细胞毒性,化合物4对DLD-1人结直肠腺癌上皮细胞的细胞毒性较为明显(IC50=16.7 μg/mL)。目前,国内外对鸡骨常山属植物的化学成分研究较少,本研究丰富了该属植物化学结构的多样性。
