虫草素衍生物体外抗肿瘤活性及体内药代动力学研究
2020-06-02崔琳琳李国玉
崔琳琳,王 莹,李国玉,袁 甜
1黑龙江省预防与治疗老年病药物研究重点实验室;2哈尔滨商业大学药学院,哈尔滨 150076
1951 年,经过 Cuningham等[1]研究从人工栽培的蛹虫草的培养液中分离得到的一种核苷衍生物—虫草素(3′-脱氧腺苷),同时也是第一个从真菌中分离出来的核苷类抗菌素[2]。经过多年研究,证实了虫草素具有多种药理活性,但是虫草素的全部药理作用并未完全阐明。现在已发现的药理作用如下:抗肿瘤、抗病毒、抗菌、免疫调节、抗衰老、降血脂、降血糖和具有抗缺血再灌注损伤、加强心肌保护的作用、抑制血管内皮平滑肌细胞的增殖、抑制血小板在血管内聚集形成血栓[3-12]等多方面的药理作用。目前,虫草素的研究现在已经成为药物化学中一个极其活跃的领域。
虫草素虽然具有广泛生物活性和药理作用,对多种疾病都有潜在的治疗作用,但从50年代被发现以来有关其体内实验的报道甚少,究其原因,是由于虫草素在体内腺苷脱氨酶(ADA)的作用下快速脱氨基后会变成生物活性极小的3′-脱氧次黄嘌呤核苷,半衰期很短,作用效果短暂,从而影响治疗效果。本实验以虫草素为原料,在5′位置上接入新的基团,合成系列衍生物,拟通过改变虫草素脂溶性从而增加其活性。对合成得到的化合物进行体外抗肿瘤活性评价,并进行体内药代动力学研究。
1 材料与方法
1.1 实验原料与仪器
1.1.1 实验试药
虫草素、2-呋喃甲酰氯、2-噻吩甲酰氯、6-氯烟酰氯(四川省维克奇生物科技有限公司)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(北京欣经科生物技术有限公司)、杜尔贝科改良的伊格尔培养基(DMEM)(Hy Clone/Thermofisher)、小牛血清(FBS)(杭州四季青生物有限公司)、平衡盐溶液和胰蛋白酶消化液(GIBCO公司)、人肝癌HepG2细胞株(中国医学科学院基础医学研究所细胞中心)、色谱甲醇、屈臣氏水、其它化学试剂均为分析纯、实验用水为灭菌二次水。
Wistar大鼠(体重220~240 g),雄性,购自长春市亿斯实验动物技术有限责任公司,动物合格证号:SCXK(吉)-2016-0003,批号:201800024268,健康状况良好。
1.1.2 主要仪器设备
核磁共振氢谱(1H NMR)和碳谱(13C NMR)(Bruker Avance 500 MHz)、超高效液相色谱-质谱(SHI-MADZU Nexera,AB Sciex Triple TOF4600)、高压灭菌锅(日本Sanyo公司)、DL-CJ-1ND医用型超净工作台(中国北京东连哈尔仪器制造有限公司)、高效液相色谱仪(包括LC-10ATvp输液泵、SPD-10Avp紫外检测器、SCL-10Avp 系统控制器、CLASS-VP 6.0 色谱工作站)。
1.2 虫草素衍生物的化学合成
以3′-脱氧腺苷为先导化合物,对其C-5′进行结构改造后得到衍生物分别为:(5′-噻吩甲酰酯)-3′-脱氧腺苷(1)、(5′-呋喃甲酰酯)-3′-脱氧腺苷(2)、(5′-6-氯烟酰酯)-3′-脱氧腺苷(3)、化合物其结构经1H NMR、13C NMR表征确证。
化合物1~3的合成方法:取虫草素原料药1 g(0.004 mol)溶于50 mL无水吡啶中。恒温水浴70 ℃,氮气保护,在磁力搅拌下缓慢滴入酰氯溶液(eq.:1∶1.2)。TLC监测反应(甲醇∶二氯甲烷=1∶10),5 h反应结束。减压蒸除溶剂。将浓缩之后的膏状产物,60 ℃蒸馏水溶解,以除去未反应的酰氯。分别用30 mL乙酸乙酯萃取三次。合并有机相,减压蒸馏得到固体粉末样品。采用干法上样的方法,用少量硅胶粉末拌匀样品,上硅胶柱(2×75 cm玻璃柱,200~300目柱层析硅胶),柱层析(甲醇:二氯甲烷=1∶15)。
目标化合物路线如图1。

图1 目标化合物的合成路线
1.3 体外活性测定以及药动学评价
1.3.1 目标化合物的体外抗肿瘤活性测试
HepG2细胞培养:HepG2细胞解冻后,放入超净工作台,加入离心管内并加含有10%小牛血清的1 640培养液,混匀后离心。弃去上清液,向离心管加入培养液,吹打制成细胞悬液。细胞计数,调细胞浓度以3×104个/mL。置于培养瓶中,将培养瓶放入37 ℃,5%CO2培养箱内培养,进行常规培养传代[13]。
MTT实验:根据文献方法[14-17],将虫草素、化合物1~3均制备成浓度为80、40、20、10、5、2.5、1.25 μg/mL的溶液。细胞以3×105个/mL 接种量接种于96孔培养板,置于5% CO2,37 ℃温箱中培养 48 h后,每孔加入不同浓度的化合物各100 μL,继续培养24,48 h,每孔 6 个平行孔。观察到培养液变黄且细胞未长满时,更换培养液。分别加入100 μLMTT(噻唑蓝)后放回培养箱继续培养4 h 弃去培养基,加入150 μL DMSO,在酶标仪570 nm下读板,根据测得的吸光度值,计算细胞生长抑制率,用分析软件SPSS计算IC50值。
1.3.2 体内药物代谢实验方法
1.3.2.1 色谱条件
色谱柱:Diamonsil-C18,5 μm,4.6×250 mm;流动相:虫草素乙腈-水(8∶92,V/V),化合物1~3甲醇-水(50∶50,V/V);流速:1 mL/min;柱温:30 ℃;进样量:20 μL ;检测波长:虫草素260 nm,化合物1~3 280 nm。
1.3.2.2 系列标准溶液的配制
虫草素、化合物1~3均各自配制成16.7 μmol/mL的灌胃液。其中,化合物1~3均不易溶于水,制备成混悬液,灌胃之前进行摇匀。
1.3.2.3 动物分组及给药方案
取40只Wistar雄性大鼠(体重220~240 g),随机分配为4组,每组10只大鼠。每组各取14 个时间点,禁食不禁水。第一组为虫草素组,第二组为化合物1组,第三组为化合物2组,第四组为化合物3组。禁食24 h后,灌胃给药。除每组中空白对照外,各组中其余大鼠每只给药3 mL,分别于0.5、1、1.5、2、2.5、3、3.5、4、5、7、9、12、15、18 h时间点眼眶取血0.5 mL,置于肝素化离心管中,所有血样均以4 000 rpm高速离心5 min后,吸取血浆冷冻备用。
1.3.2.4 样品前处理
取0.2 mL血浆样品,加入色谱甲醇0.2 mL,震荡混匀,在16 000 rpm下离心15 min,取上清液用0.45 μm有机滤膜滤过,将滤液挥发干,重新加入0.2 mL甲醇,充分震荡混匀,滤液用于血药浓度的测定[18]。
2 结果与讨论
2.1 目标化合物的结构表征结果
化合物1白色粉末,熔点204~205 ℃,产率52.0%,HR-ESI-MS:m/z362.092 8[M+H]+。UV(MeOH)λmax289 nm;IR(KBr)νmax1 113 cm-1;1H NMR(500 MHz,DMSO-d6)δ:8.25(1H,s,2-H),8.14(1H,s,8-H),7.98~7.23(3H,dd,J=6.5,8.8 Hz,5′-CH2),7.33(2H,s,6-NH2),5.94(1H,d,J=13.9 Hz,1′-H),5.79(1H,d,J=12.3 Hz,2′-H),4.72~4.45(4H,dp,2′-OH,4′-H,5′-CH2),2.42~2.11(2H,ddd,J=10.2,12.4,13.6 Hz,3′-CH2);13C NMR(125 MHz,DMSO-d6)δ:161.8(-COO),156.5(2-C),153.2(4-C),149.5(8-C),134.6~128.8(4,5′,-CH=),119.4(5-C),91.3(1′-C),78.0(4′-C),74.8(2′-C),66.3(5′-C),35.2(3′-C)。因此鉴定该化合物为(5′-噻吩甲酰酯)-3′-脱氧腺苷。
化合物2浅黄色粉末,熔点197~198 ℃,产率50.4%,HR-ESI-MS:m/z346.115 4[M+H]+。UV(MeOH)λmax280 nm;IR(KBr)νmax1 126 cm-1;1H NMR(500 MHz,DMSO-d6)δ:8.26(1H,s,2-H),8.13(1H,s,8-H),7.98~6.70(3H,d,J=4.9 Hz,5′-CH=),5.93(1H,d,J=11.9 Hz,1′-H),5.77(1H,d,J=3.1 Hz,1′-H),4.69~4.24(4H,ddtd,2′-OH,4′-H,5′-CH2),2.06(2H,ddd,J=12.1,15.2,17.3 Hz,3′-CH2);13C NMR(125 MHz,DMSO-d6)δ:158.2(-COO),156.5(6-C),153.1(2-C),149.5(4-C),148.3~144.0(5′-CH=),139.3(8-C),119.4(5-C),119.2~112.9(5′-CH=),91.2(1′-C),77.9(4′-C),74.8(2′-C),66.0(5′-C),35.2(3′-C)。因此鉴定该化合物为(5′-呋喃甲酰酯)-3′-脱氧腺苷。
化合物3白色粉末,熔点211~212 ℃,产率60.2%,HR-ESI-MS:m/z392.9[M+H]+。UV(MeOH)λmax280 nm;IR(KBr)νmax1 132 cm-1;1H NMR(500 MHz,DMSO-d6)δ:8.92~7.67(3H,s,5′-CH=),8.25(1H,s,2-H),8.11(1H,s,8-H),7.28(2H,s,-NH2),5.93(1H,s,1′-H),5.76(1H,d,J=10.4 Hz,2′-H),4.79(1H,s,4′-H),4.6~4.59(2H,dp,5′-CH2-),4.51~4.56(2H,dd,J=11.7,16.8 Hz,3′-CH2-),2.09(2H,ddd,J=4.2,12.6,18.7 Hz,3′-CH2-);13C NMR(125 MHz,DMSO-d6)δ:164.3(-COO),156.5(6-C),155.0(2-C),153.1~125.1(5C,5′-CH=),149.5(4′-C),139.7(8-C),119.6(5-C),91.5(1′-C),77.8(4′-C),74.6(2′-C),66.6(5′-C),35.3(3′-C)。因此鉴定该化合物为(5′-6-氯烟酰酯)-3′-脱氧腺苷。
2.2 体外活性测试结果
在体外抗肿瘤活性研究中,以人肝癌细胞HepG2为研究对象。采用MTT法检测不同浓度的化合物1~3对HepG2细胞增殖的影响。图2为三个化合物和虫草素在不同浓度下对肿瘤抑制率变化曲线。如图,经修饰后的3′-脱氧腺苷衍生物均显示了较好的抗肿瘤活性,且对HepG2的抑制效果随化合物浓度的升高而升高。在一定浓度范围内,化合物浓度越大对肿瘤细胞的抑制率越强。虫草素、化合物1~3四者IC50值分别为0.12、0.11、0.07、0.06 μM。本实验为虫草素衍生物抗肿瘤作用的深入研究和探索虫草素衍生物在肿瘤治疗应用方面的前景提供依据,为新药研发提供理论基础。

图2 化合物对HepG2细胞抑制作用
2.3 方法学考察结果
2.3.1 色谱行为
分别取对照组未给药大鼠的空白血浆,按“1.3.2.4”项下处理组织血样样品,分别进样20 μL,得到色谱图A为大鼠空白血浆。将一定量的标准品储备液加入到大鼠空白血浆中,同法操作,得到对照品色谱图B。取大鼠给药后的血浆样品,同法操作,得到样品色谱图C。在上述色谱条件下,测得的虫草素和化合物1~3的色谱图如下,图3-6中“a、b、c、d”分别为虫草素和化合物1~3的色谱峰,保留时间分别为7.68、8.26、5.43、7.11 min。虫草素和化合物1~3各组织的内源性物质分离情况良好,无杂质峰干扰。

图3 空白血浆(A)、空白血浆+虫草素(B)、给药后血浆(C)的色谱图


图4 空白血浆(A)、空白血浆+化合物1(B)、给药后血浆(C)的色谱图

图5 空白血浆(A)、空白血浆+化合物2(B)、给药后血浆(C)的色谱图

图6 空白血浆(A)、空白血浆+化合物3(B)、给药后血浆(C)的色谱图
2.3.2 标准曲线的绘制
取大鼠空白血浆500 μL,分别加入储备液配制成低、中、高(0.5、5、50 μg/mL)三种浓度的标准溶液。按“1.3.2.1”项下色谱条件操作,每个浓度测定6次,记录峰面积。以峰面积(A)对样品浓度(c,μg/mL)进行回归运算。求得回归方程如表1。
结果表明各药物在0.01~100.0 μg/mL范围内线性关系良好(r>0.992 4)。

表1 不同药物的回归方程(n =6)
2.3.3 精密度
精密量取各化合物储备液30 μL至离心管中,加入空白血浆500 μL,配制成低、中、高(0.5、5、50 μg/mL)三种浓度的样品溶液,按“1.3.2.4”项下处理,进样20 μL记录峰面积,三个浓度每个浓度每日内平行测定5次,重复测定5日。得日内日间精密度,结果见表 2、3、4、5。由结果可知,精密度良好,符合生物样品分析方法的要求。

表2 虫草素精密度测定结果(n =5)

表3 化合物1精密度测定结果(n =5)

表4 化合物2精密度测定结果(n =5)

表5 化合物3精密度测定结果(n =5)
2.3.4 回收率
将各化合物配制成低、中、高(0.5、5、50 μg/mL)三种不同浓度的空白血浆供试液各3份,按“1.3.2.4”项下进行处理。按“1.3.2.1”项下各自的色谱条件测定血药浓度,所得峰面积和相应的对照品溶液直接进样所得峰面积进行比较,计算提取回收率,测得结果见表6。表明该方法符合方法学要求。
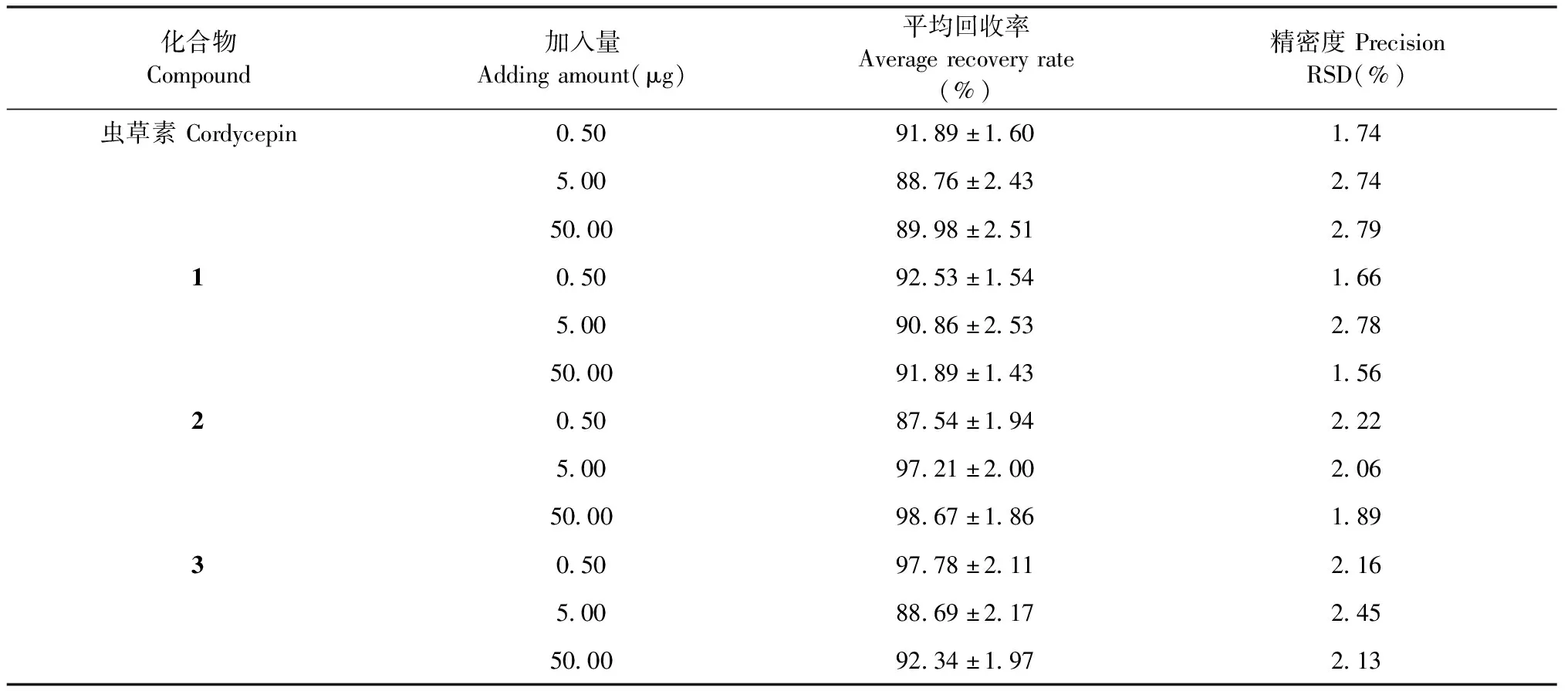
表6 各药物浓度回收率测定结果(n =3)
2.3.5 稳定性
将各化合物配制成低、中、高(0.5、5、50 μg/mL)三种不同浓度的空白血浆供试液,每个浓度测定5次。每个样本分别在放置室温24 h后、反复冻融3次后和在-20 ℃冰箱冷藏15天后的条件下测定,测定各化合物的稳定性。该方法稳定性良好,符合生物样品分析方法的要求。

表7 各药物稳定性测定结果(n =5)
2.3.6 定量限
利用不断减少加入化合物的量的方法使液体中的分析物浓度不断降低,采用信号(S)与噪声(N)的比值大于等于10的标准来确定定量限。

表8 药物的定量限测定结果(n =6)

图7 虫草素、化合物1~3体内药物转化情况(n=6)
2.4 药物转化与代谢分析
2.4.1 药物体内转化情况
为检验化合物1~3在大鼠体内能否转变为虫草素自身来发挥作用,对各组处理后的血样中的虫草素含量进行了测定。测得的各组的虫草素血药浓度随时间变化的曲线如图7所示,化合物1~3进入动物体内后,会逐渐代谢为虫草素来发挥作用。结果显示,虫草素结构修饰物在体内转化为虫草素的效率低。
2.4.2 体内药物代谢分析评价结果
取血浆上清液0.2 mL,按照本章“1.3.2.4”项下样品处理方法操作,进样量20 μL进样测定不同时间内血液中化合物的含量。结果如图8。计算得到的相应的药代动力学参数见表8。

图8 灌胃给药虫草素、化合物1~3后血药浓度-时间分布曲线(n=6)

表9 各药物的药代动力学参数
注:P<0.05,n=6。
从表9结果可见,经过结构修饰后的虫草素,Tmax时间延长,化合物在体内的存在时间延长;Cmax的升高,说明化合物在体内的作用浓度升高,可以更好地发挥药效,进而的减少给药剂量;t1/2的延长,可以减少重复给药次数。
体内化合物转化情况的评价结果表明:化合物在体内能逐渐代谢转变为虫草素,但转化后的药物在体内的作用结果与原型药相比,Cmax降低。Tmax延长,可以使虫草素在体内发挥作用的时间延长。同时,结合Cmax与Tmax数据对比,t1/2的延长可以表明转化后得到的虫草素以低血药浓度在体内存在。体内转化后的化合物在体内代谢情况与虫草素相比,转化后的化合物在体内的代谢时间和血药浓度要低于虫草素原型药。
3 结论
本实验对虫草素进行修饰,对3′-脱氧腺苷的C-5′位进行修饰,接入三种不同的基团,合成了三种衍生物:(5′-呋喃甲酰酯)-3′-脱氧腺苷,(5′-噻吩甲酰酯)-3′-脱氧腺苷,(5′-6-氯烟酰酯)-3′-脱氧腺苷。在虫草素结构中有3个活性部位,分别为2′-OH、5′-OH和6-NH2,本实验中酰氯与5′-OH反应,生成酯基。虫草素的结构修饰物化合物1~3的产率分别为52.0%、50.4%、60.2%。结合反应过程中的TLC检测反应情况和产率来看,实验中均有副产物产生,因在反应中严格禁水,无脂肪酸生成,推测其副产物为5′-OH和6-NH2的产物。分析酰氯与各基团反应生成的产物情况,推测其结果为:化合物存在空间位阻影响,虫草素中5′-OH活性最大,与酰氯反应几率大,产物多。2′-OH因临近五元环,空间位阻大,影响其活性,产率低。6-NH2的活性与5′-OH相比,低于5′-OH。
在经过MTT法筛选其抗肿瘤活性后,经修饰后的虫草素衍生物均显示了较好的抗肿瘤活性,且对HepG2的抑制效果随化合物浓度的升高而升高。在一定浓度范围内,化合物浓度越大对肿瘤细胞的抑制率越强。虫草素、化合物1~3四者IC50值分别为0.12、0.11、0.07、0.06 μM。
合成后的虫草素衍生物在体内半衰期延长,但其在体内的血药浓度变低了。实验中化合物进入动物体内后开始逐渐代谢为虫草素,但是结构修饰物在体内的转化率低,虫草素在动物体内的达峰浓度不高,相同剂量下,难以达到虫草素原型药在动物体内的最高血药浓度,但达峰时间和半衰期有所延长,可以实现虫草素在体内以低浓度的形式发挥疗效。关于结构修饰物在体内转化效率低的问题进行分析,推测其原因可能为:①动物体内对结构修饰物的分解酶少,不能有效的使虫草素衍生物全部在体内代谢分解,只有一小部分被还原为原型药。②实验中的给药方式为灌胃给药,动物体内胃里含有大量的胃酸,pH值偏低,而虫草素衍生物中的被修饰部分为酯基结构,化合物在进入胃内部后,在酸性条件下还原为原型药困难,仅有一小部分在进入消化系统后进行分解代谢,导致在体内的转化率低。评价三种化合物在大鼠体内的药动学研究,为虫草素衍生物抗肿瘤作用的深入研究和探索虫草素衍生物在肿瘤治疗应用方面的前景提供依据,为其新药开发提供思路。
本实验通过化学结构修饰的手段,改变虫草素的结构后,增加对肿瘤的抑制率。同时虫草素衍生物在动物体内可以逐渐代谢转变为虫草素,所以虫草素衍生物可以作为虫草素的前药而发挥作用。虫草素衍生物在动物体内转变成的虫草素的Tmax和t1/2的延长,可以表明转化后得到的虫草素以低血药浓度在体内存在。Cmax和AUC值出现先升高、再降低的有规律性的变化。这说明,虫草素经化学结构修饰后,可使虫草素在体内发挥作用时间延长。该实验可通过化学结构修饰的手段研究开发具有更高药理活性的新型药物,为学者们提供了一条新思路。
