基于聚合物点的电致化学发光生物传感器用于葡萄糖检测
2020-06-01杜钦芝陈时洪
杜钦芝,金 琳,贺 莹,陈时洪*
(1.重庆市第八中学校 重庆 400030;2.西南大学 化学化工学院,重庆 400715)
电致化学发光(ECL)是一种结合电化学和化学发光优点的新型检测技术。由于具有响应速度快、灵敏度高、成本低及易于控制等优点,ECL已经被广泛应用于生物分析、环境检测、食品检测以及临床诊断等领域[1]。
高发光效率的ECL发光体是获得灵敏ECL检测的前提。目前常用的ECL发光体有鲁米诺[2]、异鲁米诺[3]、联吡啶钌及其衍生物[4]、量子点[5]、类石墨相氮化碳[6]、苝类化合物[7]以及金属纳米簇[8]。基于这些发光体的ECL分析一般需要外加共反应试剂或以溶解氧作为共反应试剂以获得高的ECL发光效率。近年来,聚芴类作为一种新型的ECL发光体,由于其高的荧光量子产率和光稳定性已被广泛应用于分析检测[9]。聚[(9,9-二辛基芴基-2,7-二基)-co-(1,4-苯并-{2,1′,3}-噻二唑](PFBT) 属于聚芴类化合物中的一种,在ECL传感及成像中已受到关注[10]。本课题组在最近的研究中进一步发现,羧基功能化的PFBT聚合物点(PFBT-COOH)在无外加共反应试剂和除溶解氧的情况下具有强的ECL发光效率[11],这极大扩展了PFBT在ECL分析领域中的应用。
本文采用PFBT-COOH作为ECL发光体,以其修饰电极,在EDC/NHS作用下与GOD交联,以实现酶的固载而制得ECL酶生物传感器。基于GOD催化底物葡萄糖原位产生的H2O2对PFBT-COOH中ECL信号的高效猝灭作用,可实现对葡萄糖的灵敏检测。PFBT-COOH与猝灭剂H2O2的结合扩展了聚芴类化合物在ECL传感领域,特别是在ECL酶传感领域的应用,为葡萄糖检测提供了新方法。
1 实验部分
1.1 仪器与试剂
MPI-E型电致化学发光分析系统(西安瑞迈分析仪器公司)和CHI760E电化学工作站(上海辰华仪器公司)分别用于ECL和循环伏安(CV)测试,ECL检测时,扫描电压范围和光电倍增管电压分别设置为0~+1.25 V和800 V;纳米材料的微观形貌采用S-4800扫描电子显微镜(SEM,日本日立公司)进行表征;尼古莱IS 10傅里叶变换红外光谱(FI-IR,美国尼古拉公司)和紫外可见分光光度计(UV-vis)(Lambda 17,美国PerkinElmer公司)用于表征纳米材料的光学性质。
PFBT(MW~134 000,多分散性3.5)由ADS染料源公司(加拿大魁北克)提供;聚(苯乙烯-共马来酸酐)(PSMA,平均分子量~1 700)和尿酸购自上海阿拉丁公司;葡萄糖(一水)(Glu)、乳糖、蔗糖和抗坏血酸均购自成都市科龙化工有限公司;葡萄糖氧化酶(GOD)、N-(3-(二甲基氨基)丙基)-N′-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀亚胺(NHS)均购自美国Sigma公司;L-半胱氨酸(L-Cysteine)和超氧化物歧化酶(SOD)由北京百灵威科技有限公司提供;测试底液为0.10 mol/L磷酸盐缓冲液(PBS);所用试剂均为分析纯,实验用水为二次蒸馏水。
1.2 PFBT-COOH的制备
分别将PFBT(4.0 mg)和PSMA(0.8 mg)溶于四氢呋喃(THF)中,强力超声5.0 h以上得到1.0 mg/mL溶液,然后将两种溶液充分混合并迅速注入10.0 mL水中。将混合溶液连续搅拌,直至溶剂THF在真空下完全蒸发后,通过440 nm针筒式滤膜过滤器去除大颗粒聚集体,得到PFBT-COOH分散液。
1.3 传感器的制备
依次用0.3 μm和0.05 μm的Al2O3粉末打磨玻碳电极(GCE,直径4.0 mm)表面,再依次用水、无水乙醇和水超声清洗GCE。待GCE在空气条件下自然晾干后,在其表面滴加7.0 μL PFBT-COOH分散液。室温下晾干后,再滴加10.0 μL EDC/NHS(4∶1) 交联剂,室温避光条件下孵育1.0 h,以活化 PFBT-COOH的羧基官能团。最后滴加10.0 μL GOD溶液(10 mg/mL,0.10 mol/L PBS,pH 7.4),于4.0 ℃避光条件下孵育8.0 h,得到GOD/PFBT-COOH/GCE酶生物传感器,于4.0 ℃冰箱中保存备用。传感器的构建过程如图1所示。

图1 ECL传感器的制备及响应原理图Fig.1 Schematic description of preparation and response of the ECL biosensor
1.4 检测方法
工作电极(修饰的GCE)、参比电极(Ag/AgCl电极)和对电极(铂丝电极)构成三电极检测系统。在3.0 mL PBS测试底液中,在0~+1.25 V范围内,以300 mV/s的扫速扫描以采集ECL信号。在铁氰化钾溶液(K3[Fe(CN)6]/K4[Fe(CN)6],5.0 mmol/L)中,在-0.20 ~+0.60 V范围内,以100 mV/s的扫速扫描以采集循环伏安(CV)信号。
2 结果与讨论
2.1 PFBT-COOH的表征
用SEM表征了PFBT-COOH的微观形貌,结果如图2A所示。可清晰观察到球形的PFBT-COOH聚合物点,其直径为60 ~ 80 nm,平均直径为70 nm。所制备材料的形貌和粒径大小与文献相符[11]。用IR技术表征了未羧基化的PFBT及PFBT-COOH的IR光谱。如图2B所示,与PFBT相比,PFBT-COOH的IR光谱在1 777.52 cm-1处出现1个新的吸收峰,为—COOH官能团的特征吸收峰。图2C为PFBT-COOH的UV-Vis吸收光谱,可观察到PFBT-COOH在300~600 nm范围内显示出较宽的吸收带,这归因于聚合物链的塌陷和弯曲,从而导致较低的共轭度[20]。 PFBT-COOH的2个特征吸收峰分别位于320 nm和455 nm。所得到的UV-Vis光谱与文献相符[20]。IR光谱中1 777.52 cm-1处的—COOH吸收峰证明材料被成功的羧基化,结合SEM图和UV-Vis光谱,表明材料已成功合成。

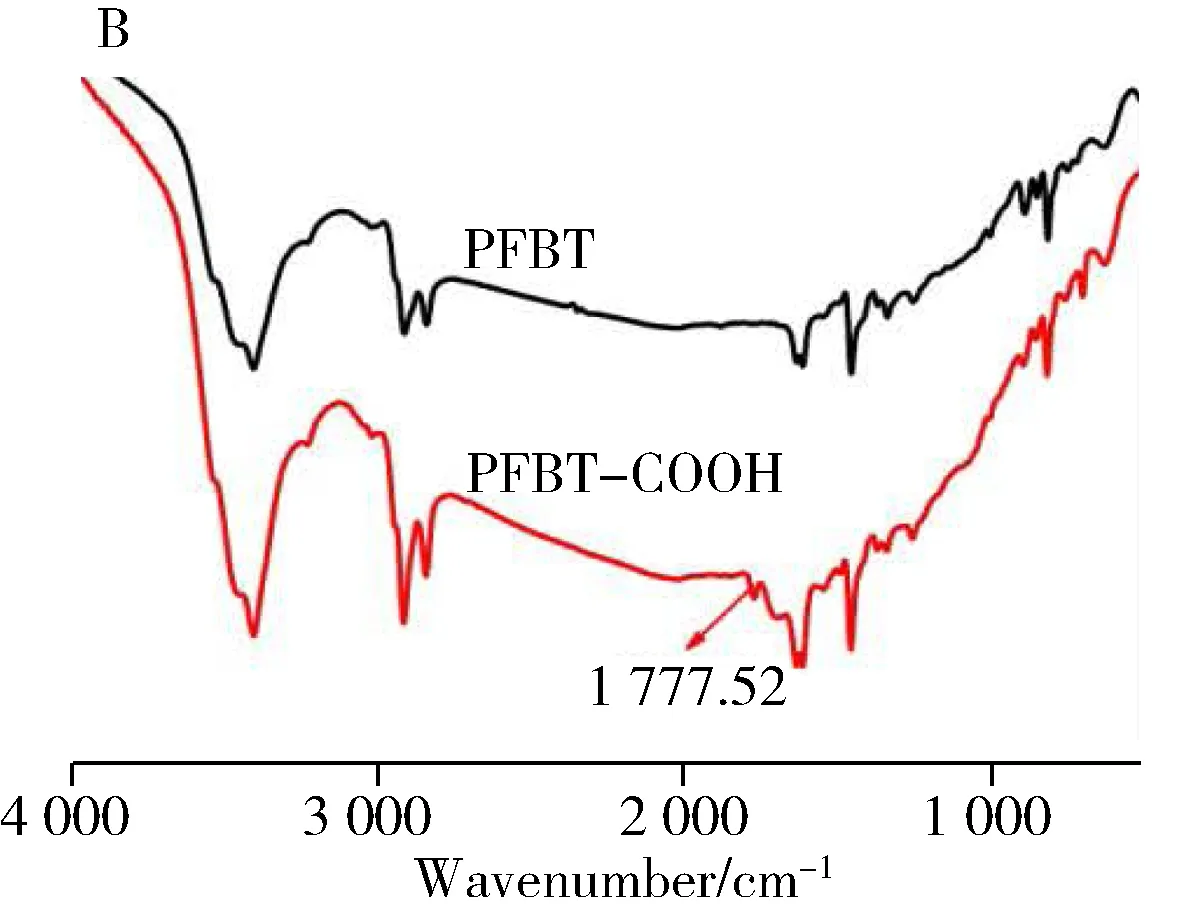

图2 PFBT-COOH的SEM图(A)、红外光谱(B)及紫外可见光谱(C)Fig.2 SEM image(A),IR spectra(B) and UV-Vis absorption spectrum(C) of PFBT-COOH
2.2 PFBT-COOH的ECL行为


图3 PFBT-COOH/GCE在0.10 mol/L PBS(pH 7.4)溶液中的ECL响应(A) ,以及pH值对PFBT-COOH/GCE的ECL响应的影响(B)Fig.3 ECL response of PFBT-COOH/GCE in 0.10 mol/L PBS(pH 7.4) solution(A) and effect of pH value on ECL response of PFBT-COOH/GCE(B)a.with air-saturated atmosphere,b.with N2 atmosphere,c.with air-saturated atmosphere+L-cysteine,d.with air-saturated atmosphere+SOD;scanning potential range:0 ~+1.25 V,scanning rate:300 mV/s


图4 传感器的CV(A)和EIS(B)表征Fig.4 CV(A) and EIS(B) characterizations of the biosensora.bare GCE,b.PFBT-COOH/GCE,c.GOD/PFBT-COOH/GCE
2.3 电极修饰过程的表征
在含有K3[Fe(CN)6]/K4[Fe(CN)6](5.0 mmol/L)的PBS溶液中,测试了不同修饰电极的CV曲线和电化学阻抗(EIS)图谱以表征传感器的组装过程。CV表征结果示于图4A。可见,裸电极(GCE)呈现出一对较好的可逆的[Fe(CN)6]3-/4-氧化还原峰(曲线a)。当PFBT-COOH修饰至电极表面后,相应的氧化还原峰电流值显著下降(曲线b),这是因为PFBT-COOH的导电性差,阻碍了信号探针[Fe(CN)6]3-/4-与电极表面之间的电子传递。当葡萄糖氧化酶(GOD)通过交联被修饰到电极表面后,由于非导电性生物大分子GOD对电子传递的阻碍作用,相应的峰电流进一步减小(曲线c)。图4B为电极修饰过程的EIS表征。由图可见,随着PFBT-COOH和GOD在GCE表面的逐步修饰,其EIS图谱中的半圆直径逐渐增大,表明交流阻抗值逐渐增大,这主要是因为PFBT-COOH和生物大分子GOD阻碍了信号探针[Fe(CN)6]3-/4-与电极表面的电子传递过程,这与CV表征所呈现的变化规律一致。传感器的CV和EIS表征结果也均表明其已成功构建。

图5 不同pH条件下传感器的ECL信号强度Fig.5 ECL signal strengths of the biosensor under different pH conditions
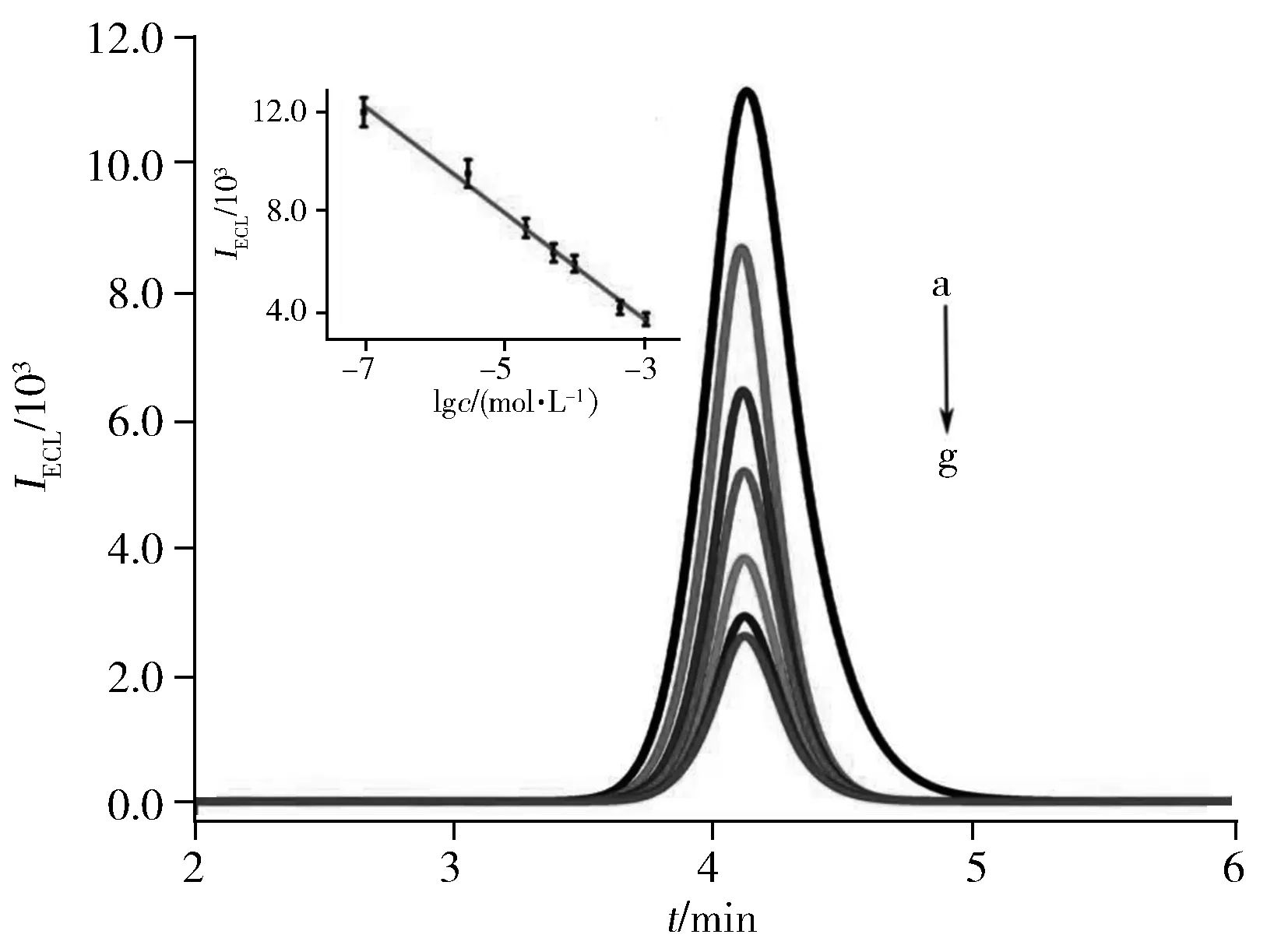
图6 传感器对不同浓度葡萄糖的ECL响应Fig.6 ECL response of the biosensor towards different concentration of glucose glucose concentration(a-g):1.0×10-7,3.0×10-6,2.0×10-5,5.0×10-5,1.0×10-4,5.0×10-4,1.0×10-3 mol/L;insert:the calibration plot for ECL intensity vs.logarithm of glucose concentration
2.4 pH值的优化
由于pH会显著影响酶的活性,所以探究了PBS的pH值对生物传感器(GOD/PFBT-COOH/GCE)的ECL响应影响。图5显示了传感器在不同pH条件下对0.50 mmol/L葡萄糖的ECL响应情况。当pH值由6.0增至7.4时,传感器的ECL信号随pH值的增大而逐渐降低,这是由于GOD催化葡萄糖原位产生的H2O2的量逐渐增加,对ECL信号的猝灭程度增大。当pH为7.4时,生物传感器的ECL信号达到最低,表明GOD的活性在此条件下最佳。此后,随着pH值的升高,ECL信号不断上升,这是由于GOD的活性下降,导致生成H2O2的量减少。因此,实验选择最佳pH值为7.4。
2.5 传感器对葡萄糖的响应
在最佳实验条件下,测试了所构建酶生物传感器对葡萄糖的响应,结果如图6所示。ECL信号强度随着葡萄糖浓度的增加而逐渐降低。当葡萄糖浓度在1.0×10-7~3.0×10-3mol/L范围内,可观察到ECL信号强度(I)与葡萄糖浓度的对数(lgc)呈良好的线性关系(见插图)。线性回归方程为I=-2 129lgc-2 671,相关系数r=0.995 6,检出限(S/N=3)为3.0×10-8mol/L。将本文所构建传感器的响应性能与其它检测葡萄糖的方法进行比较,结果如表1所示。可见,本文所构建的传感器具有较宽的线性范围和较低的检出限。

表1 检测葡萄糖的不同方法比较Table 1 Comparison of different methods for the detection of glucose
*no data
2.6 传感器的稳定性与选择性
稳定性和选择性是衡量传感器性能的重要指标。测试了传感器在含有0.40 mmol/L葡萄糖的PBS(0.10 mol/L,pH 7.4) 溶液中连续扫描10圈,其ECL信号的变化情况(图7A)。结果显示,ECL信号无明显变化,其ECL信号值的相对标准偏差(RSD)为 2.1%,说明该传感器具有良好的稳定性。选择抗坏血酸(Ascorbic acid)、L-半胱氨酸(L-Cysteine) 、乳糖(Lactose)、蔗糖(Sucrose) 和尿酸(Uric acid) 作为潜在的干扰物质,测试了所设计的ECL传感器的选择性。图7B显示了传感器对各干扰物质(浓度均为200 μmol/L)和葡萄糖(20 μmol/L)的ECL响应情况。可见,即使干扰物的浓度为目标物葡萄糖浓度的10倍,干扰溶液的ECL响应信号与空白(Blank) 时的ECL响应信号无明显差异,而存在20 μmol/L葡萄糖时,ECL信号显著下降。当葡萄糖(20 μmol/L)与上述所有干扰物质(浓度均为200 μmol/L)混合(Mixture) 时,ECL信号与只存在葡萄糖时的结果几乎一致,上述结果表明该传感器对葡萄糖具有优良的选择性。


图7 传感器的稳定性(A)和选择性(B)Fig.7 Stability(A) and selectivity(B) of the biosensor
2.7 实际样品的分析
在优化条件下,通过标准加入法对人血清样品进行回收实验,以评估所构建的ECL酶传感器潜在的实际应用能力。如表2所示,传感器测定稀释的人血清样品中葡萄糖浓度为4.5 μmol/L。在稀释的人血清样品分别加入20.0、40.0 、60.0 μmol/L葡萄糖,其测定值表达为平均值±标准偏差(n=3),测得传感器的回收率为98.5%~106%,表明所制备的酶传感器具有较好的准确性,在临床测定人血清样品中的葡萄糖方面具有较好应用潜力。

表2 稀释的血清样品中葡萄糖的回收率Table 2 Recovery of glucose in diluted serum sample
*average of three determination
3 结 论
本研究发现,羧基功能化的PFBT-COOH聚合物点在无外加共反应试剂及除去溶解氧的条件下,具有强的ECL发射,且H2O2对其ECL信号具有高效的猝灭作用。基于酶促反应原位生成的H2O2对PFBT-COOH的ECL信号的猝灭作用,建立了对葡萄糖的高灵敏检测方法。PFBT-COOH与猝灭剂H2O2的结合为ECL酶传感器的构建提供了理想的平台。
