基于非接触电导检测的PCR液滴检测芯片的研究
2020-06-01廖承悦高则航周洪波赵建龙
廖承悦,彭 伙,高则航,齐 同,周洪波*,赵建龙*
(1.中国科学院上海微系统与信息技术研究所 传感技术联合国家重点实验室,上海 200050;2.中国科学院大学,北京 100049;3.上海科技大学,上海 201210)
数字PCR是一种高灵敏度的核酸定量检测方法[1],它将起始待测模板分散到大量的微反应器中,每个反应器包含至少一个或多个拷贝的目标DNA模板,模板在微反应器中进行PCR扩增反应后,对阴性(未包含模板)阳性(包含模板)反应器的数量进行统计并算出它们相应的比例,含有目标DNA分子的微反应器数量满足泊松分布。根据泊松分布公式即可算出目标DNA分子的初始拷贝数[2]。数字PCR技术目前被广泛应用于疾病早期检测诊断和微生物检测分析等[3-4]。
常规的实验室检测PCR扩增反应后的阴性阳性反应器比例的技术为激光诱导荧光法[5],荧光法在PCR反应过程中需要添加荧光探针进行标记,在终端检测过程中需要昂贵复杂的光学设备,难以实现小型化、集成化。相比之下,由于DNA大分子有较好的导电性[6],电化学检测以PCR扩增产物为敏感对象,将DNA扩增带来的电导变化通过电极转换为特征检测信号[7],具有灵敏度高、成本低、易于集成化和微型化等优点[8]。本文研究目标是通过电化学检测的手段实现PCR扩增反应后阴性阳性反应器比例的检测。
近年来,得益于液滴微流控系统高通量、低样品量、高灵敏度的特点[9-10],将微液滴作为载体与电化学检测相结合成为受研究者青睐的无标记检测手段[11-12]。Sohn等[13]设计了电容式细胞计数器,相比于捕获式的检测阵列提高了检测通量,但接触式的电极导致芯片在工作一定时间后会出现电极极化与污染的现象,芯片使用寿命短。Kemna等[14]通过检测空液滴与封装了细胞的液滴之间的阻抗差异,实现了无需标记物的细胞包裹率的检测,然而双电极系统的检测信号中混有背景信号,加大了信号处理的难度。De Ninno等[15]采用电极阵列结构,排除了液滴在通道中位置带来的误差影响,但芯片制造工艺复杂,电极与微流控芯片之间需要高精度的对准键合,芯片成品率低。Saateh等[16]使用共面三电极结构,抑制了背景漂移,实现了液滴合成的单分散性实时监测,但由于共面电极结构产生的是非均匀电场[17],电流密度分布不均使得检测区对于液滴形貌与通道参数过于敏感,影响检测重复性。因此,检测芯片的复用性、灵敏度、成品率、重复性极为关键。
本文设计了基于非接触式电导检测的数字PCR检测芯片,避免了与介质直接接触,提高了芯片复用性。三电极体系实现了信号的差分检测,消去了噪声信号,降低了检测电路的复杂度。而本文采用平行3D电极结构以实现均匀电场分布[18],可降低微通道参数与液滴形貌带来的误差,提高检测稳定性。熔融态铋合金注入结合软光刻工艺,电极通道与微流控通道自对准一体化成型,芯片成品率高、设计参数易调整。最终,实现了PCR反应后阴性阳性液滴的电信号比对,无需荧光探针标记,通量可达100个/秒。在DNA模板物浓度为0.5×104~3×104copies/μL的区间内与荧光强度具有良好的相关性。
1 实验部分
1.1 材料与设备
聚二甲基硅氧烷(Polydimethylsiloxane,PDMS,分析纯,美国DowCorning公司);三氯(1H,1H,2H,2H-全氟辛基)硅烷(纯度97%)、矿物油(生物技术级)、表面活性剂TritonX-100(分析纯),均购自美国Sigma Aldrich公司;光刻胶SU-8(美国Microchem公司);DEPC水(Diethyl pyrocarbonate,焦碳酸二乙酯,纯度99.995%,上海生工生物工程公司);2×Light Cycler®480 Probe Master(瑞士Roche公司);合成设计的各种引物和探针(上海占标生物科技公司);EGFR(Epidermal growth factorreceptor,表皮生长因子受体)基因 19 号外显子突变型的 pGEM 质粒(中国科学院细胞库肺癌细胞株);低熔点铋合金(抚顺佳邦有色金属公司);实验用水均为去离子水。
DP80型CCD图像传感器(日本Olympus公司) 用于观测液滴生成情况;DSO-X2004A示波器(美国Agilent公司)用于信号采集与观测;E3631A开关电源(美国Agilent公司)用做电路电源供给;DG4162信号发生器(美国Rigol公司)用于产生交流激励信号;Cond3210电导率仪(德国WTW公司)。
1.2 芯片设计与制备
微流控芯片的整体设计如图1所示,灰色部分为微流控通道,金色部分为电极,1、3为连续相(矿物油)入口,2为样品注入口,4、5、6用于低熔点铋合金注入,7为收集口。结构A为流动聚焦型结构,用于微液滴合成;结构B为电极与微通道耦合区,用于微液滴的流式电信号检测,其中a、b为激励电极,c为感应电极,d为PDMS绝缘层,e为主通道。整个芯片高度为40 μm,主通道宽度150 μm,单个激励电极有效检测宽度150 μm,感应电极宽度380 μm,PDMS绝缘层5 μm左右。芯片用水冲洗干净后可重复使用。
以单晶硅片为衬底,利用硫酸溶液清洗硅片的表面,水清洗后,在 200 ℃热板上烘5 min使硅片脱水,之后以2 000 rpm 的转速甩涂SU-8 30 s,常温下静置60 min,在热板上先 65 ℃烘3 min,然后95 ℃烘5 min,在光刻机上进行曝光,曝光时间为50 s,曝光后微芯片结构将转移至 SU-8光刻胶上,将硅片放入烘箱内先于65 ℃烘 1 min,再于95 ℃烘 3 min,并进行缓慢降温以减少模具裂纹,显影与硬烘后得到凸型模具。将PDMS预聚体与固化剂按10∶1 比例混合,真空脱气后,浇铸到SU-8模板上,固化后,将PDMS从硅片上揭下与玻璃片一同进行等离子体处理,键合形成PDMS芯片。最后将熔点为60 ℃的低熔点铋合金在80 ℃真空烘箱中加热30 min,使熔融态的铋合金被吸入电极微通道,完成带有电极的微流控芯片制备。相比于传统的检测电极与微流控芯片独立制作再进行对准键合的工艺流程,本研究的检测电极与微流控芯片一体化成型,无需高精度的对准键合。

图1 芯片结构示意图Fig.1 Schematic diagram of chip structureA:flow-focusing structure(流动聚焦型结构),B:structure of detection area(检测区结构)
1.3 PCR反应液滴的制备
本实验使用10 μL体系,包含5 μL 2× Light Cycler®480 Probe Master、0.4 μL上游引物和0.4 μL下游引物、0.3 μL MGB(Minor groove binder,小沟结合)探针、0.3 μL UNG(Uracil-N-glycosylase,尿嘧啶-N-糖基化酶)水解酶(Takara)、1 μL DNA模板(EGFR 基因19号外显子突变型的pGEM质粒),最后补入2.6 μL DEPC水。
通入微流控芯片生成微液滴,并收集转移至离心管中,在PCR原位仪上进行PCR反应,得到混有阳性与阴性的PCR液滴。这些液滴将会导入PCR液滴检测芯片中以测试芯片性能。
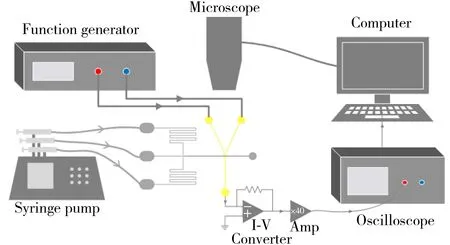
图2 检测系统的示意图Fig.2 Schematic of the detection system setup
1.4 检测平台的搭建
为测试芯片性能,搭建了电学检测系统(如图2)。整个系统包括微流控芯片、信号发生器、信号放大电路(I-V 转换器与二级放大电路)、注射泵、示波器、显微镜和计算机控制系统。信号发生器(DG4162)输出幅度相等,相位相差180°的两路正弦激励信号到微流控芯片的激励电极,检测信号通过自行搭建的信号放大电路(OPA129运算放大器)放大后,由示波器(DSO-X 2004A)进行采集并输出到上位机,信号处理由本课题组编写的Matlab程序实现。微流控芯片与板级电路均置于外壳接地的铸铝材质屏蔽盒中以屏蔽电磁干扰。
2 结果与讨论
2.1 电极结构的模拟仿真
为了探究电极的信号响应情况,本文利用COMSOL Multiphysics软件中的静电学模块进行有限元仿真。矿物油(σ=1×10-14S/m,εr=2.5) 为连续相,水(σ=5×10-5S/m,εr=80)液滴直径140 μm,以5 μm厚度的PDMS(σ=1×10-14S/m,εr=2.8)作为绝缘层,对检测区(图1结构B)电场分布与电流密度进行模拟,图3(A~D)中E1、E2为激励电极,E3为感应电极,分布线为电场线,红色箭头为电场方向,电流方向与电场方向一致。对E1、E2施加幅值相等,相位相差180°的正弦激励电压,主要有以下3种不同情况:①检测区只有连续相(图3A),此时E1与E3,E2与E3之间阻抗相等,产生的交变电流互相抵消;②当液滴经过检测区,在激励电极与感应电极之间时(图3B),两个激励电极与感应电极之间的阻抗不再一致,产生了差分电流;③微液滴在检测区域中心(图3C),电极间阻抗再次相等,此时无差分电流产生。平面电极结构(图3D)电场分布集中在电极附近,在电流密度较高的区域内液滴形貌或位置的微小改变也将引起输出信号的抖动,而本芯片采用的平行3D电极结构所产生的电场分布均匀,有效降低了检测区内通道高度与液滴形貌带来的误差。
对检测区建立等效电路模型如图3E所示,其中Cpex为激励电极间寄生电容,Cw为绝缘层壁电容,Cdl为油相与液相之间的双电层电容,Cp为激励电极与感应电极间电容,Cm为连续相电容,Rm为连续相电阻,Ci为分散相电容,Ri为分散相电阻。
激励电极与感应电极间阻抗值主要由电阻值与容抗组成,当有液滴处在检测区时,阻抗Zd1为:
(1)
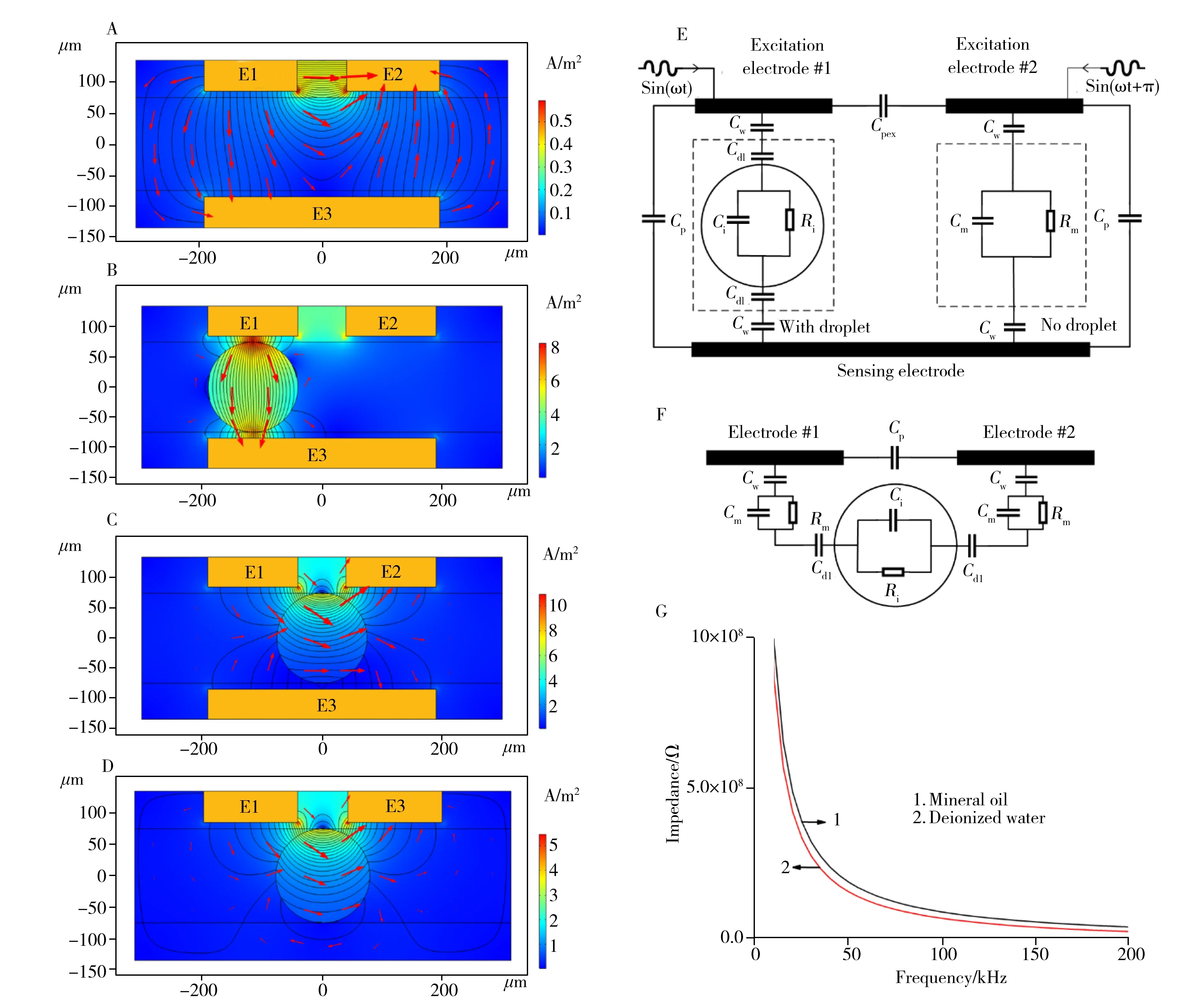
图3 检测区的电路模型Fig.3 Model of detection areaA:no droplet(无液滴),B:the droplet passes through the detection area(液滴经过检测区),C:the droplet in the center of the detection area(液滴在检测区域中心位置),D:electric field distribution of planar electrode(平面电极电场分布),E:three-electrode system circuit model(三电极系统电路模型),F:two-electrode system circuit model(双电极系统电路模型),G:impedance simulation of detection area(检测区阻抗仿真)
式中,ω=2πf为激励信号角频率,f为激励信号频率,R为液滴阻抗值,主要由Ci与Ri决定,Ri与液滴电导率性质有关。当无液滴处在检测区时,由于油相的电导率极低,Cm起主导作用,阻抗Zd2定义为:
(2)
两个激励电极与感应电极间差分电流ΔI可定义为:
(3)
式中,U为交流激励信号,|Zd1|、|Zd2|分别为Zd1、Zd2的模。由(1)、(2)、(3)式可知三电极体系相比于双电极系统(图3F),排除了Cp、Cpex带来的不利影响,抑制了连续相带来的背景噪声干扰,提高了检测精度。电容的定义式为:
(4)
式中,εr为介质的相对介电常数,ε0=8.85×10-12F/m,S与d分别为有效面积与等效厚度,由(4)式可知,降低绝缘层厚度与提高液滴在检测区体积分数均能提高信号强度,但在芯片制作过程中发现,当绝缘层厚度低于5 μm时,在负压灌注熔融态金属的状态下,容易发生金属渗漏到检测区的情况,因此,将绝缘层厚度设计为5 μm。
Cw的理论值为28 fF,这使得系统在低频率时,受绝缘层壁电容与双电层电容的影响,检测回路的阻抗值很高,差分电流难以检测,需选择适宜的检测频段使得系统阻抗降至可检测区间。本文使用的放大电路能对100 fA以上电流产生响应,对有液滴时的电极间阻抗进行有限元仿真(图3G所示),当频率达到50 kHz时,阻抗将下降至200 MΩ左右。此时只需采用合适的激励电压,差分电流可达nA级别。

图4 放大电路对不同振幅和频率的激励的响应Fig.4 Amplifier circuit response to excitations of different amplitudes and frequencies
2.2 检测条件的优化
传感器的响应特性除了依赖于交流激励信号的频率和振幅之外,还与电路中元件的频率特性有关。所设计的信号放大电路的转换比为10 nA/80 mV,信号发生器(DG4162)生成幅值在0.4~2.8 V区间内的正弦信号,该信号通过40 MΩ定值电阻产生10~70 nA内的交变电流,得到放大电路对不同大小的交变电流的幅频响应曲线。如图4所示,超过100 kHz后增益开始下降,为准确反映待测信号,选取激励信号频率为80 kHz。
2.3 微液滴的检测
微液滴在生成过程中受压强、流量等因素的影响不完全均一,相对标准偏差(标准差与平均值之比)一般在3%以内。本文探究了液滴尺寸变化对电信号的影响。采用20 Vpp,频率为80 kHz的激励信号对不同尺寸的水液滴进行电信号检测,结果如图5A示,图5B为其信号原始图像,每2个峰代表1个液滴经过,经Matlab提取信号包络线得到图5C,峰值在液滴中心线与激励电极中心线重合时产生。当液滴长度(L)为180 μm时,液滴形状变为胶囊型。如图5D所示,Ld为液滴长度,Le为两个激励电极中心线之间的间距。此时液滴体积为1 nL,输出的电压信号峰值不再明显变化,相对标准偏差的影响极小。芯片的检测通量与液滴速度密切相关,液滴速度计算式为:
(5)
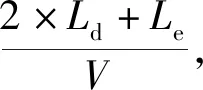
(6)
式中,v为液滴流速,f为激励信号频率,fs为数据采样频率。DSO-X 2004A示波器采样频率最高可达2 GSa/s,可以保证采集到的检测信号不失真。
通过文献调研[20],极低浓度的DNA溶液电导率由溶剂决定,随着DNA浓度的增加,溶液的电导率将迅速增加,区分PCR阴性阳性液滴的关键在于高浓度的DNA扩增产物提高了电导率。初始状态下,液滴电导率由缓冲液电导率决定,液滴中极微量的DNA模板无法对液滴电导率造成影响。通过PCR扩增后,未包含DNA模板的阴性液滴电导率仍以PCR缓冲液的电导率为主导,而阳性液滴中DNA模板数相比于初始状态增至109以上,高浓度的DNA产物使得阳性液滴电导率远大于阴性液滴。推测本实验中阳性PCR液滴电导率在10 μS/cm以上,阴性液滴电导率在0.5 μS/cm左右。为了测试检测系统在此范围内对电导率的敏感度,使用Cond3210电导率仪调配电导率区间为0.5~40 μS/cm的NaCl溶液,生成长度为180 μm的微液滴进行检测。如图5F所示,输出电压幅值随着电导率提高而增大,直到电导率升至30 μS/cm,证明了阳性液滴检测的可行性。

图5 微液滴尺寸、速度、电导率的检测Fig.5 Measurement of droplet size,velocity and conductivityA:relationship between droplet length and output voltage(液滴长度与输出电压关系),B:original voltage signal image(原始电压信号图像),C:droplet signal envelope(液滴信号包络线),D:droplet morphology(液滴形貌),E:laminar flow(层流模式),F:relationship between conductivity and output voltage(电导率与输出电压关系)
2.4 PCR反应后阴性阳性液滴的电信号检测
为了验证本芯片在PCR液滴检测方面的性能,首先使用高精度的荧光检测法对所使用的DNA模板物浓度进行定量分析,以该方法的检测结果为标准,与本文的电导检测法检测结果进行比对。
首先对微液滴进行荧光检测,原理是将液滴单层排列后荧光激发,通过图像采集与处理得到阴性阳性液滴比例。图6A为1 nL大小PCR阳性体系的液滴明场图像,图6B为其荧光激发图像。


图6 荧光法检测阴性阳性液滴比例Fig.6 Proportion of negative and positive droplets detected by fluorescence methodA:bright field image(明场图像),B:fluorescence excitation image(荧光激发图像)
根据泊松分布公式可计算出初始拷贝数:
(7)
式中,λ为每个反应单元中含有的起始DNA分子平均拷贝数,k为单个反应单元中包含的拷贝分子的数目,P为一定λ条件下,每个反应单元中包含k拷贝目标分子的概率。
采用本芯片对未经PCR反应的液滴进行检测,液滴峰值均在400 mV以下。对PCR反应后的液滴进行检测,如图7A所示,可推断出峰1、2为阴性液滴双峰,峰3、4为阳性液滴双峰,阳性液滴峰值大多在500 mV以上。由此可见,DNA扩增产物使得阳性液滴电导上升,从而显示出比阴性液滴更强的调幅信号。使用荧光法与本文的非接触式电导检测法对不同浓度DNA模板所产生液滴的结果进行对比,取500 mV以上电信号液滴为阳性液滴,如图7B所示,在0.5×104~3×104copies/μL浓度区间内电导检测结果与荧光检测结果实现了良好的相关性(y=0.95x+0.013,r2=0.998)。整个检测过程无需标记物、操作简便、成本低,且芯片可重复使用。


图7 阴性阳性液滴的检测Fig.7 Detection of negative and positive dropletsA:droplet electrical signal(液滴电信号),B:comparison of electrochemical and fluorescent results(电化学法与荧光法结果比对)
3 结 论
本文搭建了基于非接触式电导检测的PCR液滴检测系统,并用于1 nL以上的PCR液滴的阴性阳性比例检测,检测过程中无需标记物,与高精度的荧光检测法的相关性良好(r2=0.998),检测通量最高可达100个/秒。芯片的一体化制作方案极大降低了工艺难度,提高了芯片成品率,且易与不同的微流控芯片设计兼容,有小型化、便携化的潜力。未来可通过进一步的微流控通道设计优化与更高灵敏度的外围电路实现更高通量与精度的PCR液滴检测。
