羟基吡啶功能化螺吡喃探针检测尿样中柠檬酸的研究
2020-06-01霍志铭何汶懿肖小华李攻科
霍志铭,何汶懿,王 婕,夏 凌,肖小华,李攻科
(中山大学 化学学院,广东 广州 510275)
柠檬酸是一种重要的有机酸,对大部分需氧细胞而言,柠檬酸是柠檬酸循环(Krebs循环)中的重要代谢物[1]。Giskeødegadård等[2]的研究表明,恶性前列腺癌组织中柠檬酸含量较良性组织低,柠檬酸可作为前列腺癌的生物标志物(Biomarker)之一,其在组织中的浓度可用于评估前列腺癌的等级。尿液中的柠檬酸含量可用来鉴别诊断肾结石[3]和肾小管酸中毒,在骨骼疾病诊断中也发挥着重要作用[4]。柠檬酸的分析方法主要有气相色谱(GC)法[5]、高效液相色谱(HPLC)法[6]、毛细管电泳法[7]和稳定同位素比值法[8]等。但这些方法存在耗时、操作复杂和仪器设备昂贵[9]等不足,发展新型、快速、准确、可视化定量检测柠檬酸的方法具有重要意义。
螺吡喃(Spiropyran,SP)[10]是目前研究广泛的有机光致变色材料之一,其分子由互相垂直的吲哚啉和苯并吡喃两部分通过螺碳结合,有螺吡喃和部花菁(Merocyanine,MC)两种形态。无色的SP态螺吡喃在紫外光激发下,分子的螺碳与相邻氧原子的C—O键发生断裂,开环异构化为有色的MC态。MC态螺吡喃在可见光或热激发下,分子重新闭环,变回无色的SP态[11]。SP态螺吡喃的吸收光谱表现出两个峰,在272 nm处和351 nm处分别为吲哚啉和苯并吡喃的π-π*电子跃迁;而MC态螺吡喃由于部花菁的共轭结构,在568 nm的可见光处有明显吸收峰出现[12]。螺吡喃作为分子探针在分析化学领域应用广泛,如用于金属离子[13-14]、亲核性阴离子[15]和氨基酸[16]等的检测。
开环态螺吡喃的螺碳位为三级碳正离子,受亲核试剂的进攻易发生加成反应[12]。因此,亲核性的柠檬酸可作为螺吡喃的目标物并与之进行特异性结合。此外,生物样品中螺吡喃探针的水溶性及其与样品的结合作用强度是影响探针实际应用效果的关键因素。针对这些问题,本文采用羟基吡啶基团对传统螺吡喃探针进行功能化,实现了探针水溶性及对目标柠檬酸响应能力的共同提高。通过引入羟基吡啶基团,增强了螺吡喃与水的氢键作用及探针的水溶性。此外,柠檬酸与羟基吡啶基团的螯合作用及对探针螺碳正离子的亲核加成作用,协同提高了探针的响应能力,据此建立了尿样中柠檬酸的荧光检测方法。
1 实验部分
1.1 仪器与试剂
Bruker AVANCE Ⅲ 500 MHz超导核磁共振谱仪及Bruker AVANCE 400 MHz超导核磁共振谱仪(瑞士Bruker公司);UV-2600紫外可见分光光度计、RF-5301PC荧光分光光度计和LCMS-8050三重四极杆液相色谱质谱联用仪(日本Shimadzu公司)。
2,3,3-三甲基吲哚、5-硝基水杨醛、3-羟基吡啶、KOH(上海阿拉丁生化科技股份有限公司);NaOH、Na2SO4、醋酸、浓盐酸、NaCl、柠檬酸、乙腈、乙酸乙酯、石油醚、乙醇、四氢呋喃、CHCl3、丙酮、甲醇、CH2Cl2(广州化学试剂厂);MnO2(活化)、氘代氯仿、氘代二甲基亚砜(北京百灵威科技有限公司);碘甲烷(山东西亚化学工业有限公司);哌啶(永华化学科技(江苏)有限公司);SnCl2·2H2O(上海麦克林生化科技有限公司);甲醛水溶液(西陇科学股份有限公司)。以上试剂均为分析纯。99.5%人工尿液(广州学友生物科技有限公司)。
1.2 羟基吡啶功能化螺吡喃探针合成路线
羟基吡啶功能化螺吡喃(Hydroxypyridine functionalized spiropyran,HFS)探针1A的合成路线如图1所示。根据文献[11]制备化合物1b;化合物1b与5-硝基水杨醛反应得到化合物1c。用SnCl2·2H2O作为还原剂将1c氨基化制备中间物2c。另一方面,将3-羟基吡啶与甲醛经过一系列反应后得到另一中间物2d[17-18]。化合物2c和2d在常温下反应得到目标产物HFS探针1A[11]。化合物1f按文献[19]合成。采用1H NMR、13C NMR和质谱表征化合物1c、1A和1f。
化合物1c:1H NMR(500 MHz,CDCl3)δ8.02(d,J=8.6 Hz,2H),7.21(d,J=1.3 Hz,1H),7.10(dd,J=7.2,1.2 Hz,1H),6.93(d,J=10.4 Hz,1H),6.89(td,J=7.4,0.9 Hz,1H),6.77(d,J=8.5 Hz,1H),6.57(d,J=7.7 Hz,1H),5.87(d,J=10.3 Hz,1H),2.75(s,3H),1.30(s,3H),1.20(s,3H)。
化合物1A:1H NMR(400 MHz,CDCl3)δ13.30(d,J=44.3 Hz,1H),8.83(s,1H),8.31 ~8.16(m,1H),7.33(dd,J=8.4,1.4 Hz,1H),7.19(t,J=2.1 Hz,1H),7.18 ~7.15(m,1H),7.13(d,J=2.7 Hz,1H),7.09(dd,J=7.4,1.2 Hz,1H),6.94 ~6.83(m,2H),6.78(d,J=8.6 Hz,1H),6.55(d,J=7.7 Hz,1H),5.78(d,J=10.2 Hz,1H),2.76(d,J=2.0 Hz,3H),1.34(d,J=2.3 Hz,3H),1.19(s,3H)。13C NMR(126 MHz,CDCl3)δ160.87,158.12,154.55,148.08,141.19,139.67,137.62,136.58,128.99,127.69,126.19,124.72,122.81,121.54,120.66,119.80,119.32,115.99,106.90,104.85,60.41,51.95,28.96,25.91,20.16。MS:M=396.2m/z,理论Mt=397.5m/z。
化合物1f:1H NMR(500 MHz,DMSO-d6)δ12.20(s,1H),8.19(d,J=2.8 Hz,1H),7.98(dd,J=9.0,2.8 Hz,1H),7.19(d,J=10.4 Hz,1H),7.11(t,J=7.5 Hz,2H),6.84(d,J=9.0 Hz,1H),6.78(t,J=7.4 Hz,1H),6.64(d,J=7.8 Hz,1H),5.98(d,J=10.4 Hz,1H),3.42-3.22(m,4H),1.17(s,3H),1.06(s,3H)。
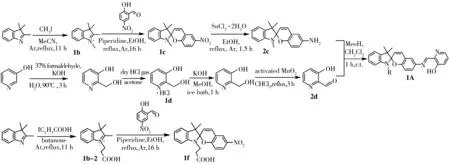
图1 HFS探针1A以及参比探针1c、1f的合成路线Fig.1 Synthesis route of HFS probe 1A and reference probes 1c and 1f
1.3 羟基吡啶功能化螺吡喃探针1A的光谱测定
测定40 μmol/L HFS探针1A乙腈-水溶液(1∶1,体积比)的紫外可见吸收光谱及荧光光谱,光谱测定过程中采用365 nm 3 W外置光源对溶液进行激发。此外,将40 μmol/L HFS探针1A的乙腈溶液与2 000 μmol/L柠檬酸水溶液以1∶1(体积比)比例混合,在35 ℃下超声反应3 min。反应结束后对溶液进行紫外可见吸收光谱及荧光光谱测定。其中荧光光谱测定条件:激发波长为280 nm,发射波长为380 nm,激发和发射狭缝均为5 nm。
1.4 羟基吡啶功能化螺吡喃探针1A的抗干扰实验
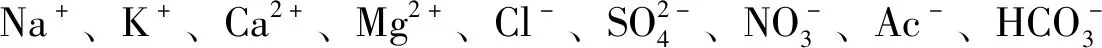
1.5 标准曲线建立
分别将浓度为20.0、30.0、40.0、60.0、80.0、100.0、120.0 μmol/L的柠檬酸水溶液与80 μmol/L HFS探针1A的乙腈溶液以1∶1(体积比)比例混合,于35 ℃下超声反应60 min。反应结束后测定溶液在280 nm紫外激发下于380 nm波长处的荧光强度。
1.6 人工尿液中柠檬酸回收率的测定
配制分别含有40.0、50.0、60.0 μmol/L的柠檬酸的水-人工尿液混合溶液,其中人工尿液占2.5%(体积分数,下同)。分别将该柠檬酸水溶液与80 μmol/L HFS探针1A的乙腈溶液以1∶1(体积比)比例混合,于35 ℃水浴中超声反应60 min。反应结束后测定溶液在280 nm紫外激发下于380 nm波长处的荧光强度,并计算柠檬酸回收率。
1.7 羟基吡啶功能化螺吡喃探针1A与柠檬酸反应的 Job's plot曲线
在室温下,将不同浓度的HFS探针1A的乙腈溶液与柠檬酸水溶液按1∶1(体积比)比例混合,反应至平衡后测定380 nm处的荧光强度。实验中HFS探针1A及柠檬酸的总浓度维持在80 μmol/L。
1.8 3种螺吡喃探针与柠檬酸结合能力对比实验
分别在40 μmol/L参比探针1c、1f和HFS探针1A的乙腈溶液中加入2 000 μmol/L的柠檬酸水溶液(1∶1,体积比),25 ℃下反应20 min,对比溶液变色情况。
2 结果与讨论
2.1 羟基吡啶功能化螺吡喃探针1A的结构表征
按HFS探针1A的原子编号(图2A),通过核磁共振谱图并结合质谱数据对其进行结构表征。
图2 HFS探针1A的结构及原子编号(A)、核磁共振氢谱(B)、核磁共振碳谱(C)图及质谱(D)Fig.2 Structural sketch with atomic number(A),1H NMR(B),13C NMR(C) and MS(D) of HFS probe 1A the corresponding atoms of HFS probe 1A are labeled in the 1H NMR and 13C NMR spectra(核磁氢谱及碳谱上对HFS探针1A原子的化学位移依编号作了归属)
从图2B可知,编号10~12的3个甲基(1.2、1.3、2.8 ppm)及编号为16、17两个烯基(5.8、7.1 ppm)是螺吡喃骨架的特征峰,而编号30的酚基(13.4 ppm)、编号23的亚氨基(8.8 ppm)及编号28的吡啶基N-邻位H(8.2 ppm)则是羟基吡啶功能团的特征基团。图2C的核磁碳谱提供了相似的证明结果,从图中能清晰区分不同碳原子的归属。结合质谱的分子离子峰数据M=396.2m/z(理论Mt=397.5m/z,图2D),可证明HFS探针1A的结构如图2A所属。
2.2 羟基吡啶功能化螺吡喃探针1A光致变色性能研究
HFS探针1A的溶液在365 nm紫外照射下可发生由无色变成黄色(图3A)的现象。其380 nm处的吸收峰强度大幅下降,并在480 nm处出现新的吸收峰。显然,HFS探针1A在紫外光激发下发生了异构化开环,由SP态转变成MC态。MC态下的HFS探针1A分子呈平面大共轭结构,与SP态结构相比能级差降低,吸收峰红移,因此在低频区产生新吸收峰。除变色以外,经紫外照射开环化的HFS探针1A的荧光光谱也发生了相应的变化(图3B),其380 nm处的特征荧光峰发生了15 nm的红移。综上所述,HFS探针1A具有光致异构化的性能,可在紫外光下发生颜色及荧光特性的改变。利用该特性作可视化指示信号,能有效构建基于异构化响应的检测方法。
考察了HFS探针1A对柠檬酸的响应能力。结果表明,加入柠檬酸后HFS探针1A溶液从无色变为红色,在480 nm处出现新吸收峰(图3C)。除变色外,体系还发生了明显的荧光猝灭现象(图3D),380 nm处的特征荧光峰基本消失。因此,基于HFS探针1A对柠檬酸响应前后的变色及荧光改变特性,可构建对柠檬酸的检测方法。
2.3 柠檬酸测定条件优化
研究了HFS探针1A测定柠檬酸的最佳反应温度、光激发条件和pH值。图4A表明,HFS探针1A对20 μmol/L柠檬酸的荧光变化受温度影响较小,不同温度下反应60 min的各组荧光相对猝灭值ΔIF380nm稳定在180~202.6之间。综合考虑操作难度及性能,选择恒温水浴35 ℃下反应60 min。从图4A还可得知,同温度下HFS探针1A溶液与柠檬酸的反应无需紫外光激发,说明HFS探针1A对柠檬酸有较强的结合及响应能力。HFS探针1A在不同pH值环境下与1 000 μmol/L柠檬酸反应前后的荧光强度及荧光猝灭比例如图4B所示,由图可见,pH≤6.0下响应不明显,溶液的荧光无显著变化;pH 7.0时,HFS探针1A与柠檬酸反应后相对荧光猝灭值达到最大(0.91)。该荧光猝灭响应是柠檬酸根离子与HFS探针MC态螺碳(8号位,图2A)的亲核加成及与羟基吡啶螯合协同作用的结果。值得注意的是,酸性条件下HFS探针1A的MC态更稳定,而柠檬酸根则相反;从实验可知,pH 7.0是两者达到平衡的最佳pH值。因此,HFS探针1A与柠檬酸反应的最佳条件为pH 7.0且无需紫外照射,恒温水浴35 ℃下反应60 min。
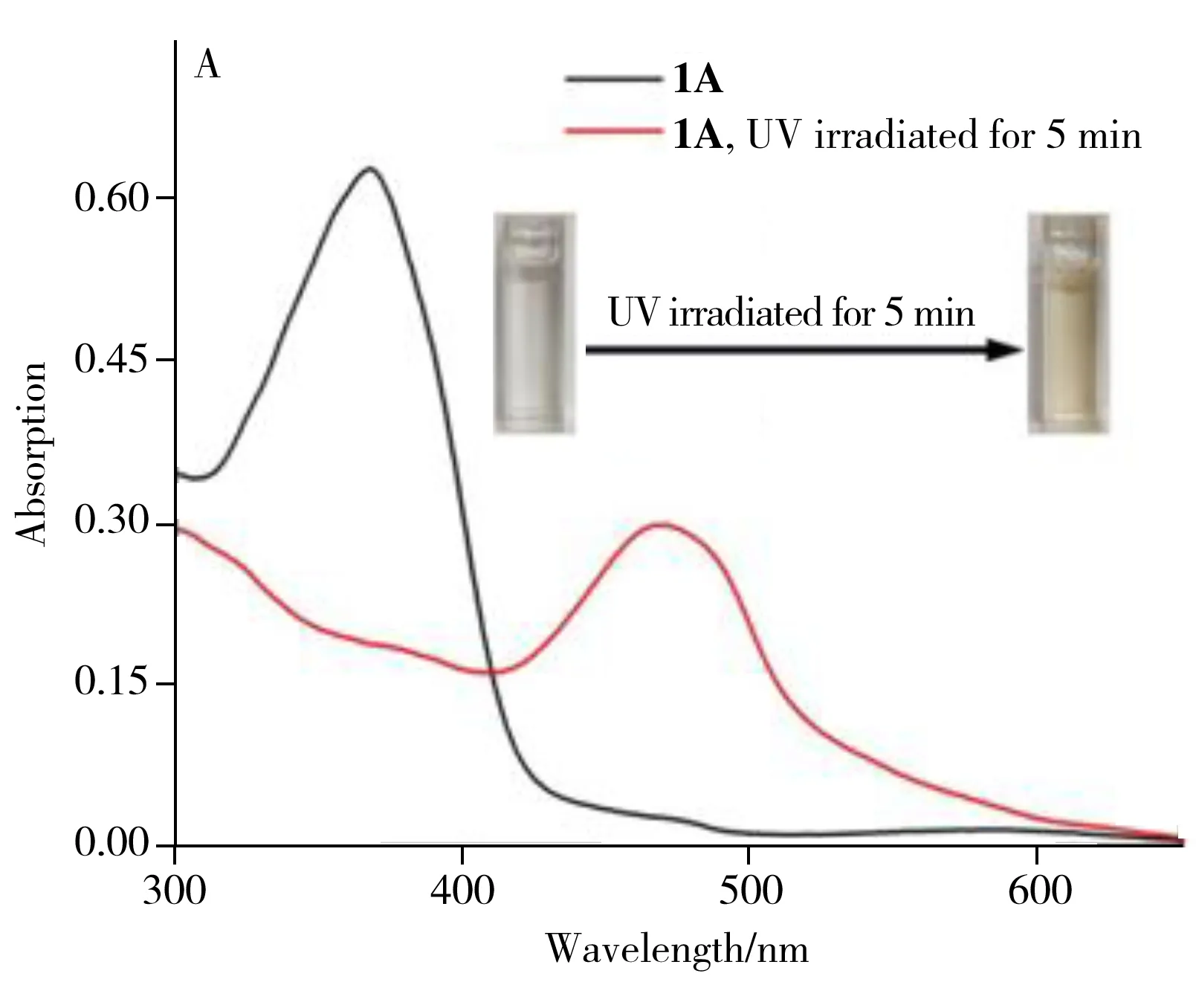
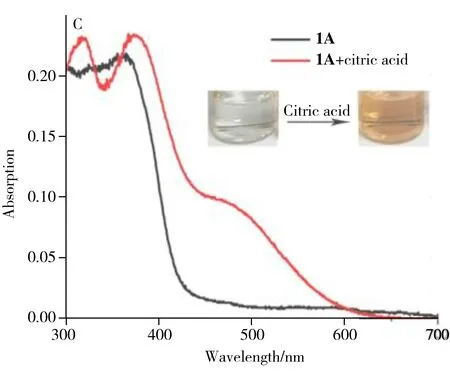
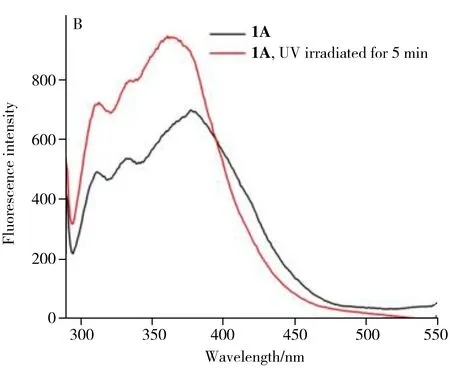

图3 HFS探针1A溶液(40 μmol/L)经365 nm紫外光激发前后的紫外-可见吸收光谱(A)和荧光光谱(B)以及加入2 000 μmol/L柠檬酸前后的紫外-可见吸收光谱(C)和荧光光谱(D)Fig.3 UV-visible absorption spectra(A) and fluorescence spectra(B) of HFS probe 1A solution(40 μmol/L) before and after being excited by 365 nm ultraviolet light,and UV-visible absorption spectra(C) and fluorescence spectra(D) before and after adding citric acid(2 000 μmol/L)insert C:color changes of HFS probe 1A solution before and after adding citric acid
2.4 干扰实验
2.5 人工尿样中柠檬酸含量的检测
在最佳反应条件下,HFS探针1A对柠檬酸有灵敏的响应特性,且伴随着颜色和荧光强度的变化。其中荧光的猝灭特征最为明显,可用于高灵敏的定量分析。据此建立了HFS探针1A对2.5%人工尿液中柠檬酸的荧光检测方法。以380 nm处的荧光猝灭峰为定量依据,HFS探针1A对柠檬酸的响应在20~120 μmol/L范围内呈线性关系,线性方程为y=0.524+0.193lgx,相关系数r2=0.992 9,其中,x=lg[citric acid](μmol/L);y=(IF0-IF)/IF0,IF0和IF分别为与柠檬酸反应前后样品的发射光强度。此外,利用3倍空白值平均偏差与曲线斜率的比值可得检出限为1.0 μmol/L。基于该条件进行了40.0、50.0、60.0 μmol/L的加标人工尿液中柠檬酸含量的测定,回收率为85.7%~92.2%,相对标准偏差为3.0%~9.2%(表1)。该方法满足人工尿液中柠檬酸的定量检测要求,且HFS探针1A具有定量检测尿液中柠檬酸的潜力。
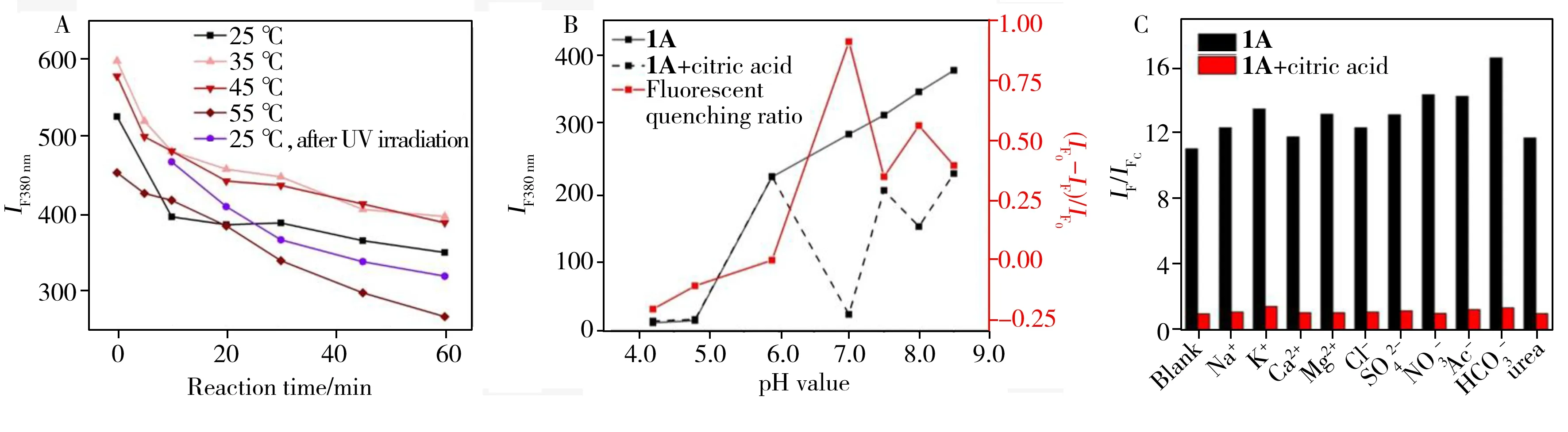
图4 HFS探针1A的温度及光照条件(A), pH值优化(B)及抗干扰实验(C)Fig.4 Optimalization of temperature and UV irradiation(A),pH value(B) and selectivity experiment for HFS probe 1A before and after adding citric acid(C)IFC:fluorescence intensity at 380 nm after addition of citric acid in the blank samples;ccitric acid(A-B):20,1 000 μmol/L;cHFS probe 1A(C):20 μmol/L
2.6 羟基吡啶功能化螺吡喃探针1A对柠檬酸的响应特性及机理探讨

表1 人工尿样中柠檬酸含量测定的回收率实验Table 1 Spiked recovery of citric acid in artificial urine(n=3)
HFS探针1A溶液在480 nm处吸收峰的强度随柠檬酸(CA)浓度的增加而升高(图5A),这是因为HFS探针1A的螺碳(8号位,图2A)在亲核型柠檬酸根的进攻下,自发开环成MC态并与柠檬酸根离子作用形成1A-CA复合物[11]。这也解释了HFS探针1A与柠檬酸反应后发生的荧光猝灭现象: HFS探针1A结合前的SP态在紫外激发下能发出较强荧光,而结合后1A-CA复合物的荧光强度较弱,宏观上表现为加入柠檬酸后其荧光发生猝灭。
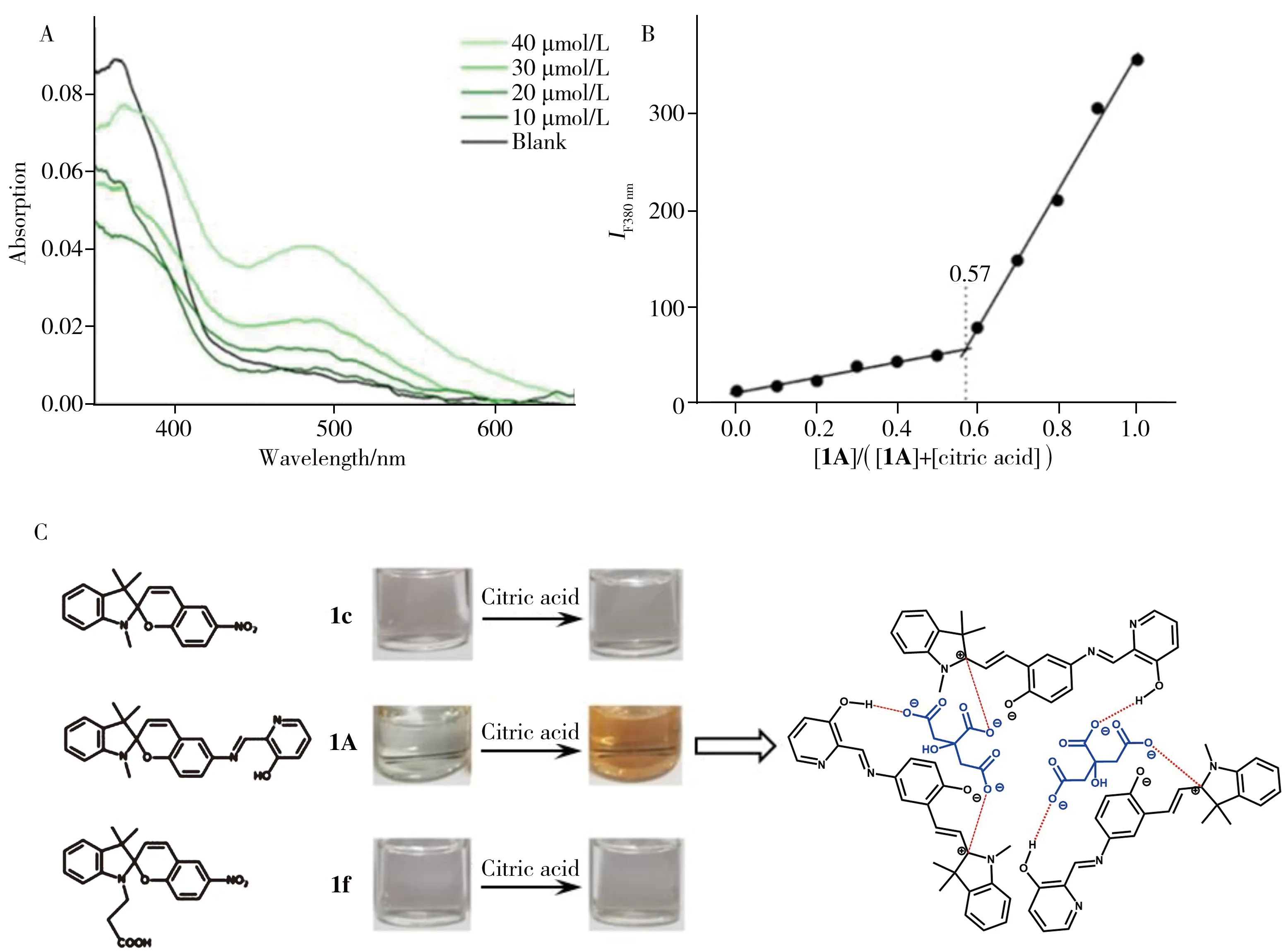
图5 HFS探针1A与不同浓度柠檬酸反应的紫外-可见吸收光谱图(A)、Job's plot曲线(B)及3种不同结构的螺吡喃化合物对柠檬酸的响应对比图(C)Fig.5 UV-visible absorption spectra of HFS probe 1A with different concentrations citric acid(A),Job's curve(B) and probe of 1c,1A and 1f before and after adding citric acid(C)
为了进一步考察HFS探针1A与柠檬酸的反应比例,绘制了HFS探针1A与柠檬酸反应的Job's plot曲线。将HFS探针1A溶液与柠檬酸在室温下反应至平衡,测定其在380 nm处的荧光强度。由图5B可见,加入柠檬酸前,[1A]/([1A]+[citric acid])= 1.0,溶液荧光最强;随着柠檬酸比例增加,该数值减小,HFS探针1A的荧光强度呈线性下降,当[1A]/([1A]+[citric acid])=0.57时达到拐点;而[1A]/([1A]+[citric acid])<0.57时,荧光强度降低的曲线斜率明显减小。实验所得两条Job's plot拟合曲线交点在[1A]/([1A]+[citric acid])=0.57处,即HFS探针1A与柠檬酸的反应比例约3∶2。
从HFS探针1A与柠檬酸形成复合物1A-CA的角度分析,HFS探针1A存在两个与柠檬酸作用的位点,分别是8号缺电子螺碳及30号吡啶的羟基;而一个富电子柠檬酸根离子上有3个可与HFS探针1A相互作用的羧基。由此可见,通过3分子HFS探针1A与2分子富电子柠檬酸根结合(图5C),可有效促使HFS探针1A从SP态向MC态的转变并形成稳定的复合物1A-CA。为进一步证实该结论,制备了两种与HFS探针1A结构相似的螺吡喃探针1c和1f,并在相同反应条件下对比了3种探针与柠檬酸的反应现象。如图5C所示,当40 μmol/L的1c、1f和HFS探针1A分别与2 000 μmol/L的柠檬酸混合加热后,1c和1f由于与柠檬酸根的离子结合能力不足,反应前后溶液颜色基本无变化;而HFS探针1A溶液的颜色发生明显变化。因此,羟基螯合与螺碳亲核加成的协同作用是促进HFS探针1A对柠檬酸根选择性响应的主要原因。
3 结 论
本文制备了具有良好水溶性的HFS探针1A,该探针对柠檬酸根离子有高选择性响应,并伴随着明显的颜色变化和荧光猝灭。基于此机制建立了人工尿样中柠檬酸含量的分析方法,方法线性范围为20~120 μmol/L,检出限为1.0 μmol/L;在2.5%人工尿液中柠檬酸的回收率为85.7%~92.2%,相对标准偏差介于3.0%~9.2%之间。此外,深入探讨了HFS探针1A与柠檬酸的作用机制,发现其高选择性源于探针螺碳的亲核结合力和羟基螯合作用力的协同作用。HFS探针1A在尿样中柠檬酸的可视化检测中具有良好的应用潜力。
