BHK-21 细胞无血清悬浮培养生产新城疫病毒
2020-06-01姬阿美白春丽刘旭平谭文松刘志亮
姬阿美,白春丽,叶 倩,周 燕*,刘旭平,2*,谭文松,2,刘志亮
(1. 华东理工大学生物反应器工程国家重点实验室,上海 200237;2. 上海倍谙基生物科技有限公司,上海 201203;
3.山东信得动物疫苗有限公司,山东 诸城 262204)
新城疫(Newcastle disease,ND)是由ND 病毒(NDV)感染所引起的一种禽类急性、热性、败血性和高度接触性传染病。该传染病分布于世界各地,致死率极高,被国际兽医局定为A 类烈性传染病[1-2],是目前危害养禽业的重要疫病之一。
接种疫苗是防控ND 最有效的策略。但采用传统的鸡胚工艺生产ND 疫苗,存在操作复杂、生产效率低、规模放大受限、SPF 级鸡胚来源有限以及鸡胚残体处理困难等缺点[3]。而以动物细胞作为病毒增殖的基质生产疫苗,具有生产工艺易于放大、生产周期短、疫苗纯度高、稳定性好、抗原特性更接近自然株等优势[4]。近年来,一些原代细胞和细胞系已用于NDV 的增殖,包括鸡胚成纤维细胞(CEF)、鸡胚肝脏(CEL)细胞、DF-1(源自CEF)细胞、非洲绿猴肾(Vero)细胞和乳仓鼠肾细胞(BHK-21)[5-10]。但原代细胞生命周期有限,经数次传代后逐渐衰老,需要重新获取。此外,这些细胞贴壁生长的特点,不但影响生产过程的规模化,而且培养过程常需添加5%~10%血清。由于血清成分复杂,含多种杂蛋白,可能携带病毒及支原体等污染源,导致生产过程不稳定,进而影响疫苗产品质量。因此,建立基于无血清悬浮细胞培养工艺生产ND 疫苗是未来该产业的发展趋势。
工艺参数的合适与否会影响细胞的生长、病毒的产量以及生产过程的经济性。因此,参数优化是病毒生产工艺建立过程中重要的环节。董炳梅等通过优化NDV 在贴壁BHK-21 细胞中的增殖条件,从而建立NDV Lasota 株的贴壁细胞培养工艺,HA 效价达8 log2HAU/25 μL[9]。Shittu 等将悬浮培养的SciPC 细胞(源自鸡胚胎)应用于NDV 增殖,并探究了细胞接种密度、不同维持培养基对病毒产量的影响,最终获得1.02×108EID50/mL 的高病毒效价[11]。在利用PBG.PK2.1 细胞扩增甲型流感病毒的研究中,Gränicher等对MOI 和胰蛋白酶浓度优化,并通过分批补料补充病毒生产期间的营养,使病毒HA 效价提高至3.24 log10HAU/100 μL[12]。
目前,ND 疫苗的生产在很大程度上依赖于鸡胚,主要因为基于细胞生产病毒的工艺不成熟且病毒产量低。为了提高病毒产量,本研究在无血清培养基中悬浮培养BHK-21 细胞来生产NDV,通过单克隆细胞株的筛选、病毒在细胞中的传代适应以及工艺参数(MOI、TPCK-胰酶用量、稀释比例)的优化,以建立基于BHK-21细胞无血清悬浮培养体系中的NDV生产工艺,为ND细胞苗的规模化生产提供实验依据。
1 材料与方法
1.1 病毒和细胞 鸡胚适应的NDV LaSota 株,TCID50值为8.0 log10TCID50/mL,由山东信得动物疫苗有限公司提供。将其在细胞中传代,以获得适应细胞的NDV 后用于后续实验。悬浮培养的BHK-21 单克隆株(BHK-v002、BHK-v015、BHK-v011)及贴壁BHK-21 细胞由本研究室保存。
1.2 主要试剂与仪器 DMEM 培养基购自上海倍谙基生物科技有限公司;SF201 培养基为本研究室自主研发的无血清培养基;胎牛血清(FBS)购自Biosun;0.25%(w/v)胰蛋白酶、TPCK-胰酶及台盼蓝均购自美国Sigma 公司;IC1000 自动细胞计数仪(Counter star)购自上海睿钰生物科技有限公司。
1.3 BHK-21 单克隆细胞株的筛选 将3 株处于对数生长期的BHK-21 单克隆细胞(BHK-v002、BHKv015、BHK-v011)以6.0×106个/mL 的活细胞密度(VCD)离心全换液接种至125 mL 摇瓶中,工作体积为30 mL(下同)。分别按0.1%、0.5%、1.0%的体积比接种鸡胚适应的NDV(8.0 log10TCID50/mL),并添加5 μg/mL TPCK-胰酶,置于37 ℃、5%CO2培养箱中的摇床上,摇床转速为130 r/min,培养96 h。每24 h 取样,检测VCD[13]及HA 效价[14]。其中VCD 通过台盼蓝染色法采用IC1000 自动细胞计数仪进行检测。
1.4 BHK-v002 细胞的培养 BHK-v002 细胞在无血清培养基SF201 中的悬浮批培养,即将BHK-v002细胞以0.8×106个/mL~1.0×106个/mL 的VCD 稀释接种至摇瓶,置于37 ℃、5%CO2培养箱中培养,每24 h取样检测VCD 和活率(Viability),直至细胞活率降至50%以下,结束培养。活率的检测方法同VCD。
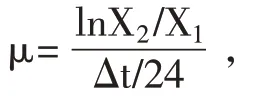
1.5 细胞适应的NDV 的制备及病毒效价的测定结果 将1.3 筛选出来的处于对数生长期的BHK-v002细胞以4.0×106个/mL 的VCD 离心全换液接种至摇瓶中,按0.01%体积比接种鸡胚适应的NDV(8.0 log10TCID50/mL),并添加5 μg/mL TPCK-胰酶,置于37 ℃、5%CO2培养箱中培养72 h,每24 h 取样,检测细胞VCD 和病毒TCID50效价[15]。接毒后48 h(Hours post infection,hpi)收集的病毒液作为第一代(P1),将该病毒液以同样条件接种至细胞中,收集本轮48 hpi 病毒液作为第二代(P2),如此连续传5~6 代,根据每代检测结果确定病毒在细胞中传代所得最高TCID50效价,并重复该代次以制备大批量细胞适应的NDV 用于后续试验。
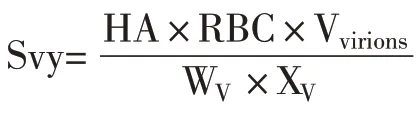
TPCK-胰酶的优化:将处于对数生长期的细胞离心全换液,使VCD 达到6.0×106个/mL 并接种至摇瓶,按MOI为0.005加入病毒液,分别添加0、2.5 μg/mL、5.0 μg/mL、7.5 μg/mL、10.0 μg/mL 的TPCK-胰 酶。其它步骤同1.3。
稀释比例的优化:将处于对数生长期的细胞按VCD 为6.0×106个/mL、工作体积为30 mL 计算需要吸取的体积,离心并收集上清液,按上清液∶新鲜培养基为3∶1、2∶1、1∶1、1∶2的比例稀释,用30 mL稀释好的上清液重悬细胞并转入摇瓶。将离心全换液(ME)组设置为对照组。按MOI为0.005加入病毒液,并添加5.0 μg/mL TPCK-胰酶,其它步骤同1.3。
1.7 统计学分析 本研究数据表示为均值±标准差,采用双尾独立t 检验法进行显著性检验。p>0.05为不显著;* :p<0.05 为显著;**:p<0.01 为极显著;***:p<0.001 为极显著。
2 结 果
2.1 BHK-21 单克隆细胞株的筛选结果 将BHKv002、BHK-v015、BHK-v011 细胞株按照不同体积比接种NDV,检测各个细胞株的VCD 及NDV 的HA效价。结果显示,无论采用哪种体积比,BHK-v015和BHK-v011 细胞在24 hpi 后VCD 均开始下降;而BHK-v002 细胞在该时间仍然维持较高的VCD,48 hpi 后VCD 逐渐下降。当接种病毒体积比为0.1%、0.5%和1.0%时,BHK-v002 细胞接种的NDV 最高HA效价分别为8.3 log2HAU/25μL、8 log2HAU/25μL、8.3 log2HAU/25μL,显著高于其它两株细胞(p<0.05,p<0.01)(图1)。考虑到经济性,采用BHK-v002 细胞以0.1%的体积比接种NDV 进行后续试验。
2.2 BHK-v002 细胞的培养结果 在无血清培养基SF201 中分别利用悬浮批培养和传代培养两种模式培养BHK-v002 细胞,并检测两种培养模式下细胞的VCD 和活率,并计算传代培养细胞的μ。结果显示,当进行悬浮批培养时,细胞接种密度约为1.0×106个/mL,培养至72 h 达到最高VCD,为12.0×106个/mL。此后,VCD 开始下降,培养至96 h 之前,活率均维持在95%以上(图2A)。当进行悬浮传代培养时,按VCD 为0.8×106个/mL~1.0×106个/mL 接种细胞,每48 h 传代一次,连续传8 代,各代次细胞生长最高密度均达到9.5×106个/mL ~9.8×106个/mL,μ维持在1.0 d-1~1.1 d-1(图2B)。可见,BHK-v002 细胞在无血清培养基SF201中连续传代,其生长具有稳定性。
2.3 细胞适应的NDV 的制备及病毒效价的测定结果 将鸡胚适应的NDV 按0.01%体积比在BHK-v002细胞中传代,确定传代代次,并制备适应BHKv002 细胞的NDV。结果显示,前3 代细胞,48 hpi后VCD 开始下降;而P4~P6 代细胞,24 hpi 后VCD即开始下降,且最高VCD 要低于P1~P3 代(图3A)。随着病毒在细胞中的传代,收获的P1~P4 代病毒液的TCID50逐渐提高,至P4 代时病毒液的TCID50为8.6 log10TCID50/mL,极显著高于前3 代(p<0.01),P5代趋于稳定。但从P6 代开始,TCID50效价呈现下降的趋势(图3B)。重复P4 代(Re-P4)制备细胞适应的NDV。将P3 代收获的病毒液接入细胞培养物,48 hpi 收获病毒液200 mL,分装于冻存管中,-80 ℃储存备用。经测定,制备的细胞适应的NDV TCID50为8.8 log10TCID50/mL。
图1 接种不同体积比的NDV 后3 株BHK-21 单克隆细胞的VCD(A)和HA 效价(B)检测结果Fig.1 Result of viable cell density(A)and HA titer(B)of three BHK-21 monoclonal cells after inoculating with different volume ratios of NDV
图2 无血清悬浮培养下BHK-v002 细胞的批培养生长曲线(A)和连续传代生长曲线(B)Fig.2 Batch culture grow curve(A)and continuous passage grow curve(B)of BHK-v002 cells in serum-free suspension culture
2.4 MOI 的优化结果 将NDV 以不同的MOI 接种至BHK-v002 细胞后,检测VCD 和病毒HA 效价,并计算Svy。结果显示,MOI 越低,接种病毒后所能达到的VCD 越高,最高HA 效价(HAmax)出现时间越晚;相反,MOI 越高,HAmax出现时间越早。MOI 为0.0001 和0.005 时,HAmax较高,分别为9.7 log2HAU/25 μL、9.6 log2HAU/25 μL。进一步比较各组的Svy显示,当MOI 为0.0005 和0.005 时,结果较其它组高,分别为2 566.9、2 514.7 病毒颗粒/细胞(图4),但均无统计学上的差异。综合考虑HAmax和Svy 值,选择MOI 0.005 进行后续试验。
2.5 TPCK-胰酶浓度的优化结果 添加不同浓度的TPCK-胰酶,检测接毒后细胞VCD 和病毒HA 效价。结果显示,当不添加TPCK-胰酶时,24 hpi 后VCD 开始下降且检测不到病毒HA 效价;2.5 μg/mL TPCK-胰酶组较5.0 μg/mL~10.0 μg/mL TPCK-胰酶组,细胞生长及产毒均较差;其中5.0 μg/mL TPCK-胰酶组的HAmax为9.2 log2HAU/25 μL,均高于其它组的HAmax,并且显著高于2.5 μg/mL TPCK-胰酶组(p<0.05)(图5)。后续试验将TPCK-胰酶浓度设置为5.0 μg/mL,既能保证病毒具有较强的感染力,也可获得较高的病毒产量。

图4 不同MOI 对NDV 在BHK-v002 细胞中增殖的影响结果Fig.4 Effect of different MOI on proliferation of NDV in BHK-v002 cells

图5 TPCK-胰酶浓度对NDV 在BHK-v002 细胞中增殖的影响结果Fig.5 Effect of TPCK-trypsin concentration on proliferation of NDV in BHK-v002 cells
2.6 稀释比例的优化结果 在基于细胞无血清悬浮培养生产NDV的过程中,随培养时间的延长,培养基中营养物被大量消耗,代谢副产物不断产生,并最终影响细胞生长和病毒生产,因此,培养过程中需要补充新鲜培养基。由于全换液(ME)操作繁琐,所以采用新鲜培养基稀释细胞液的方式补充病毒生产期间所需营养物,并降低代谢副产物浓度。结果显示,补加的新鲜培养基越多,接种病毒后细胞的生长越接近于ME 对照组。培养上清液与新鲜培养基以2∶1~1∶2比例稀释时,病毒HAmax均能达到8.5 log2HAU/25 μL。当培养上清液与新鲜培养基的比例为2∶1 和1∶1 时,二者的Svy 相当,分别为1 724.5 和1 749.3 病毒颗粒/细胞(图6)。考虑到生产的经济性,选择细胞液与培养基的比例为2∶1(20 mL 细胞液+10 mL 培养基),即将细胞从9.0×106个/mL稀释到6.0×106个/mL接种病毒。
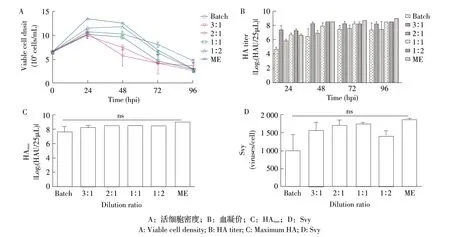
图6 稀释比例对NDV 在BHK-v002 细胞中增殖的影响结果Fig.6 Effect of dilution ratio on proliferation of NDV in BHK-v002 cells
2.7 无血清悬浮培养NDV 工艺的建立 将20 mL 生长至48 h 约9.0×106个/mL 的BHK-v002 细胞接种至摇瓶,补充10 mL 新鲜培养基。按MOI 0.005 加入病毒液,并添加5.0 μg/mL 的TPCK-胰酶,检测接毒后VCD、HA效价及TCID50效价。结果显示,接种病毒后24 h达最高VCD,此后逐渐下降,培养至144 h;接毒后,病毒HA效价逐渐升高,至接种病毒后144 h达最高水平,为8.5 log2HAU/25 μL,TCID50在细胞培养至96 h,即接毒后48 h 达最大值,为7.9 log10TCID50/mL(图7)。通过计算,Svy 为1 685.9 病毒颗粒/细胞。总之,悬浮BHK-v002 细胞在无血清培养基SF201 中具备高密度生长能力以及优异的产毒能力,可能成为ND疫苗工业化生产的优秀候选细胞。
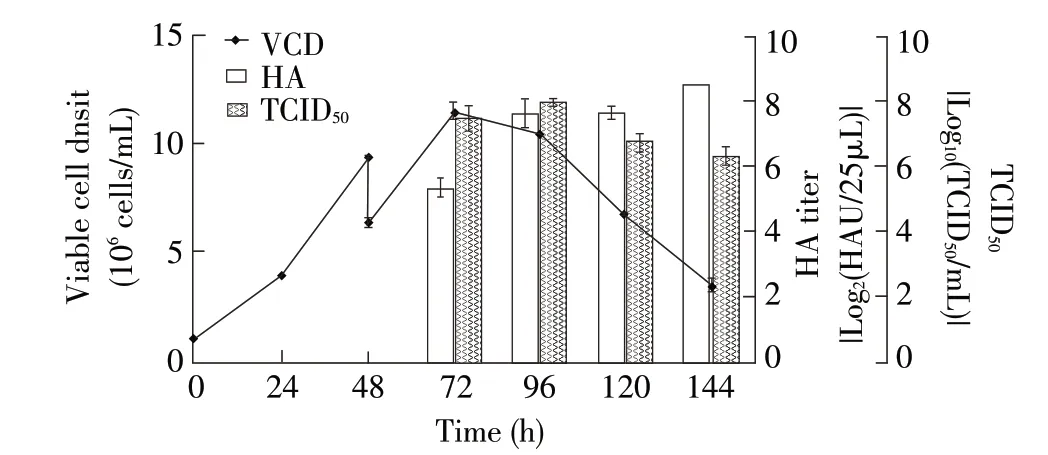
图7 在NDV 最适增殖条件下,BHK-v002 细胞的VCD 及NDV 的效价检测结果Fig.7 Results of VCD and titers of NDV in BHK-v002 cells under optimal proliferation conditions
3 讨 论
在基于细胞培养技术生产NDV 过程中,细胞株、病毒种子来源及工艺参数等诸多因素影响病毒产量。本研究结果显示,NDV 在3 株BHK-21 单克隆细胞株中的增殖存在差异,其中BHK-v002 细胞中NDV 的增殖能力最强。张良艳等从制备的97 株单克隆化MDCK 细胞中,筛选到一株甲型H1N1 流感病毒高度适应性的单克隆细胞株[16]。其中原因,可能是细胞表面病毒受体的类型和数量存在个体差异所致[17],也可能因为不同细胞中病毒复制效率存在差异。
鉴于病毒在细胞中增殖存在适应过程,本研究将NDV 在BHK-v002 细胞中连续传代,传至P4 和P5代,病毒效价逐渐稳定,P6 代病毒效价开始下降;P1~P3 代病毒在48 hpi 达到最高VCD,而P4~P6 代病毒最高VCD 提前24 h,并且低于前3 代。这一结果与Yurchenko 等的研究结果相似,将4 株不同来源的NDV 在贴壁Vero 细胞中传至P7 或P8 代后,病毒效价趋于稳定;传代过程中除了TCID50效价的增加,细胞单层中死细胞的聚集(病毒作用的表现)更明显且出现的时间更早[18]。
MOI 是感染时病毒与细胞数量的比值。MOI 过低,感染细胞的病毒数量不够,易造成大量细胞浪费;而高MOI 意味着需要准备大量的病毒。为了获得足够多的病毒,必然要反复增殖病毒,不仅制备过程繁琐,而且会带来病毒学上的“代次效应”,也就是连续扩增而使病毒活性下降的问题。此外,有研究显示,缺陷干扰病毒颗粒会影响正常病毒的增殖,在高MOI 条件下这种现象尤为明显[19]。因此,MOI 的优化是工艺建立过程中重要的步骤。本研究结果显示,MOI 越高,病毒HAmax出现的时间越早;而MOI 越低,病毒HAmax的延迟期越长。在Shittu[11]和Audsley[19]的研究中同样也观察到这一现象,高MOI 导致病毒同步生长,比低MOI 更早达到病毒效价的峰值。NDV 弱毒株感染细胞时常需添加适量的胰酶,这是因为胰酶能将NDV 的融合蛋白(F)不具活性的前体F0 水解成有活性的F1 和F2,从而介导病毒包膜与细胞膜的融合[20]。本研究结果显示,不添加TPCK-胰酶组检测不到病毒HA 效价。因此,胰酶的添加是NDV 弱毒株感染细胞所必须的。流感病毒的增殖也需要添加胰酶,病毒才能有效的增殖[21]。随着胰酶浓度的提高,5.0 μg/mL 实验组的HA 效价显著高于2.5 μg/mL 实验组,而7.5 μg/mL 和10 μg/mL 实验组的病毒HA 效价出现下降的趋势,这可能是因为高浓度的胰酶会使病毒降解[21]。
本研究筛选了适于NDV 增殖的BHK-21 单克隆细胞株,并将鸡胚适应的NDV 在筛选获得的细胞株(BHK-v002)中传至P4 代,又获得细胞适应的NDV。在确定的最佳病毒增殖条件下,HAmax达到8.5 log2HAU/25 μL,Svy 达1 685.9 病 毒 颗 粒/细 胞,最高TCID50效价为7.9 log10TCID50/mL。在达到相当TCID50效价条件下,本研究利用悬浮培养BHK-v002细胞生产的NDV 比贴壁BHK-21 细胞培养的NDV 高0.5 log2HAU/25 μL[9]。目前关于ND 细胞苗的研究多集中在贴壁细胞培养上,因此,在无血清培养基中具备高密度生长能力和优异的病毒增殖能力的BHK-v002 细胞,有望成为ND 疫苗生产的理想候选细胞。
本研究把悬浮细胞培养技术应用于ND 疫苗的制备,建立了基于BHK-21 细胞无血清悬浮培养体系中的NDV 生产工艺,为ND 细胞苗的工业化生产提供了数据支持,也为不同细胞系中其它病毒疫苗的生产提供方法借鉴。
