猪附红细胞体α-烯醇化酶基因的原核表达及间接ELISA 检测方法的建立
2020-06-01相思宇薛书江关立增
相思宇,薛书江,张 影,关立增
(1. 延边大学 农学院,吉林 延吉 133002;2. 临沂大学 农林科学学院,山东 临沂 276005)
猪附红细胞体(Mycoplasma suis,M.suis)是一种寄生在猪红细胞表面和骨髓中,能够引起猪贫血、黄疸、发热等症状[1]。猪附红细胞体病(Porcine eperythrozoonosis,PE)是一种人畜共患病,在1932 年首次发现,并在世界范围内广泛报道,该病隐性感染率高。巴西[2]、德国[3]检测到猪感染PE 的感染率分别为18.2%和13.9%,中国上海已经有人感染该病原的相关报道[4]。目前,已经有30 多个国家检测出了动物感染PE。该病正严重危害着社会公共卫生安全[5]。
α-烯醇化酶(α-enolase,ENO)是一种多功能蛋白,是原核和真核细胞胞质中的关键糖酵解酶,是许多生物中表达最丰富的胞浆蛋白之一[6]。经鉴定,猪附红细胞体的ENO 不仅是一种表面蛋白,也是结合纤维蛋白溶酶原的表面蛋白,对宿主的侵袭和黏附具有重要作用。ENO 已被证实具有良好的抗原性[7],是一种理想的血清学诊断和免疫学检测靶标。迄今为止,猪附红细胞体仍无较理想的能体外连续培养的方法,只能在动物体内生长和繁殖,这就使猪附红细胞体病的临床诊断受到限制。目前,针对猪附红细胞体的检测以常规PCR 方法为主,而在临床样本的大量检测中常规PCR 检测方法耗时耗力,增加了实验人员的工作量,并不适用于猪附红细胞体临床样本的大量检测。常规ELISA 检测方法往往是以菌体蛋白为包被抗原,这样需要提纯大量猪附红细胞体,难度较大;而猪附红细胞体寄生于红细胞表面,菌体蛋白难免受血液成分的影响而导致检测结果不准确。基于此,本实验将ENO 基因克隆至原核表达载体pGEX-4T-1 中并经诱导表达、纯化及鉴定、初步建立以ENO 为包被抗原的猪附红细胞体间接ELISA 检测方法,旨在为猪附红细胞体病的防控提供技术储备。
1 材料与方法
1.1 主要试剂 原核表达载体pGEX-4T-1、大肠杆菌BL21 及DH5α感受态细胞由延边大学预防兽医学实验室提供;克隆载体pMD18-T Simple、DNA Marker、限制性内切酶、DNA 聚合酶、T4DNA 连接酶、HRP 标记的兔抗猪IgG 等购自TaKaRa 公司;血液基因组DNA 提取试剂盒、小量质粒提取试剂盒、DNA 凝胶回收试剂盒购自OMEGA 生物技术公司;Protein Pure GST Resin 购自上海英俊生物科技有限公司;实验用猪血清样品以及猪附红细胞体阳性抗凝血均采自吉林省延边州某养猪场,猪附红细胞体阳性及阴性标准血清均由延边大学预防兽医学实验室制备,分装并于-20 ℃保存;猪弓形虫、猪大肠杆菌、猪肺炎支原体、猪链球菌等阳性血清均由延边大学预防兽医学实验室提供。
1.2 引物设计与合成 应用Oligo 6.31 和Primer Premier 5.0 软件,根据GenBank 中登录的猪附红细胞体全基因组序列(NC-015153.1),设计扩增ENO 基因的1 对特异性引物,上、下游引物5'端分别加入BamHⅠ和XhoⅠ酶切位点(下划线部分),并由上海生工生物工程有限公司合成。
P1:5'-CGGGATCCGCCACCATGGCTTTTAGTATA GAAAATCTT-3';
P2:5'-CCGCTCGAGTTAGATAATGCATGACCATC CAGCTTTCT-3'。
1.3 重组表达质粒的构建与鉴定 以血液基因组DNA 提取试剂盒提取的猪附红细胞体阳性抗凝血的总DNA 为模板,利用1.2 中的P1/P2 引物PCR 扩增ENO 基因。PCR 产物经纯化回收后克隆至pMD-18T simple 载体,构建重组质粒pMD-18T-ENO,将PCR和双酶切鉴定均为阳性的重组质粒由上海英俊生物技术公司测序鉴定。
用BamHⅠ/XhoⅠ双酶切pMD-18T-ENO 质粒获得ENO 基因片段后克隆至pGEX-4T-1 载体中构建重组质粒pGEX-4T-ENO/BL21。经PCR、双酶切鉴定为阳性的重组质粒由上海英俊生物技术公司测序鉴定。
1.4 猪附红细胞体ENO 重组蛋白的表达及检测将鉴定为阳性的重组菌pGEX-4T-ENO/BL21 培养至OD600nm=0.6 后加入IPTG(终浓度为1 mmol/L),分别在诱导后2 h~6 h 取2 mL 培养物,离心后收集沉淀。以同样处理的pGEX-4T-1/BL21 空载体菌离心后收集沉淀,作为对照。将上述各沉淀超声裂解后,经SDS-PAGE 检测重组蛋白的表达与可溶性。以猪附红细胞体阳性标准血清(1∶100)为一抗,以兔抗猪HRP-IgG(1∶4 000)为二抗,Western blot 检测重组蛋白的反应原性。
1.5 猪附红细胞体ENO 基因间接ELISA 检测方法的建立
1.5.1 间接ELISA检测方法反应条件优化 采用方阵滴定法优化该间接ELISA 方法的反应条件:用包被液将纯化的重组蛋白抗原2 倍倍比稀释(82 μg/mL~0.64 μg/mL),100 μL/孔,置于4 ℃过夜包被;PBST洗净包被液,加封闭液(1%BSA、3%脱脂奶粉)200 μL/孔,37 ℃封闭(30 min、1 h、2 h)。洗净封闭液,用PBS(PH 7.4)将猪附红细胞体阴阳性血清2 倍倍比稀释(1∶20~1∶320),置于37 ℃作用2 h。PBST 洗涤,用PBS(PH 7.4)加入兔抗猪HRP-IgG(1∶1 000、1∶2 000、1∶400)100 μL 孔,置于37 ℃反应(0.5 h、1 h、1.5 h、2 h)。PBST 洗涤,加底物OPD 显色液,100 μl/孔,室温避光显色15 min。加终止液50 μL/孔,用酶标仪检测并记录OD492nm值。选择阳性OD492nm值在1.0 左右,同时阳性/阴性比值最大的一组作为最优反应条件。
1.5.2 临界值的确定 用上述优化的间接ELISA 方法检测30 份猪附红细胞体阴性血清,测定其OD492nm值,并对其进行统计学分析。计算平均值(-x)及标准偏差(SD),根据统计学原理,OD492nm≥-x+3SD 判定为阳性,OD492nm≤-x+2SD 判定为阴性,OD492nm值介于两者之间判定为可疑。
1.5.3 特异性试验 以猪弓形虫病、猪大肠杆菌病、猪链球菌、猪肺炎支原体的阳性血清为反应血清,以猪附红细胞体阳性血清作对照,利用已经确定的最佳反应条件进行间接ELISA 检测,以评估该方法的特异性。
1.5.4 敏感性试验 将猪附红细胞体阳性血清按1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280稀释,利用已经优化的间接ELISA 方法检测,根据检测结果判定阳性血清的最大稀释倍数,评价本实验建立的间接ELISA 方法的敏感性。
1.5.5 重复性试验 取同一批次的重组蛋白包被的酶标板检测7 份阳性血清,每份血清3 个重复,评价所建立间接ELISA 检测方法的批内重复性;取3个不同批次重组蛋白包被的酶标板检测该7 份阳性血清,每份血清3 个重复,评价所建立间接ELISA方法的批间重复性。根据公式CV%=SD/-x,进行数值统计并计算重复性试验的变异系数。
1.5.6 临床样品检测 应用已经建立的间接ELISA检测方法与朱绍辉建立的间接免疫荧光检测方法(IFA)[8]平行检测50 份采自延边地区某猪场的猪血清样本,比较两种方法的检测结果,并计算二者的符合率。
2 结 果
2.1 重组质粒pGEX-4T-ENO/BL21 的构建与鉴定利用P1/P2 引物以猪附红细胞体阳性血液的基因组DNA 为模板,进行PCR 扩增。结果显示,获得约为1 200 bp的目的条带,与预期结果一致(图1)。将该基因克隆至pMD18-T 载体中构建重组质粒pMD-18TENO,经PCR 及BamH I 和Xho I 酶切鉴定,结果显示得到约1 200 bp 片段,测序结果显示获得的猪附红细胞体ENO 基因长为1 200 bp,编码393 个氨基酸,与GenBank 登录的基因序列(NC-015153.1)同源性为100%。将该基因克隆至pGEX-4T-1 中,构建重组质粒pGEX-4T-ENO。经PCR 及双酶切鉴定,结果显示得到约1 200 bp 片段(图2),表明正确构建了重组质粒pGEX-4T-ENO。
2.2 重组蛋白的表达与检测 IPTG 诱导pGEXENO/BL21 2 h 后,经SDS-PAGE 电泳检测。结果显示,表达的重组蛋白为69 ku,而空载体对照组没有相应条带(图3)。表明ENO 重组蛋白正确表达。Western blot 结果显示,获得大小为69 ku 的特异性条带(图4),表明原核表达的重组蛋白具有较好的反应原性。
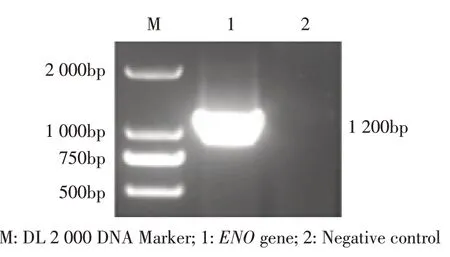
图1 猪附红细胞ENO 基因的PCR 扩增结果Fig.1 PCR amplification of ENO gene of Mycoplasma suis

图2 pGEX-ENO 重组表达质粒的PCR 及双酶切鉴定结果Fig.2 Identification of pGEX-ENO/recombinant expression plasmid by PCR and double-digestion
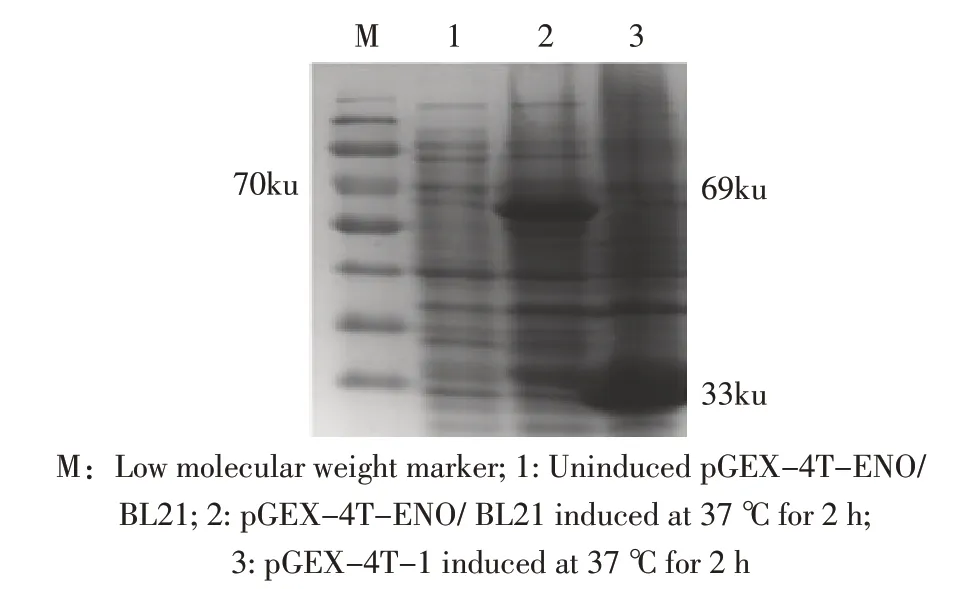
图3 重组蛋白表达的SDS-PAGE 检测Fig.3 Detection of recombinant protein expression by SDS-PAGE
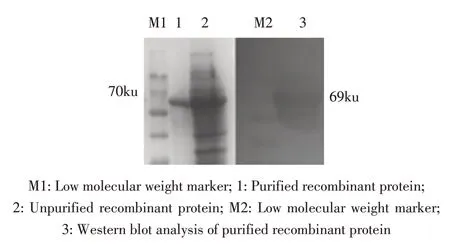
图4 重组蛋白纯化的SDS-PAGE 检测及western blot 鉴定Fig.4 SDS-PAGE and western blot identification of recombinant protein
2.3 间接ELISA 条件的确定
2.3.1 间接ELISA 检测方法反应条件优化 采用方阵滴定法优化该ELISA 方法的反应条件(表1)。结果显示,抗原的最佳包被浓度为20.5 μg/mL,血清的最佳稀释度为1∶80。最佳封闭条件为3%的脱脂乳,37 ℃封闭2 h。酶标二抗HRP-兔抗猪IgG 最佳稀释倍数为1∶1 000。
2.3.2 临界值的确定 应用已经建立的ELISA 方法检测30 份猪附红细胞体阴性血清,并测定其OD492nm值。30 份阴性血清的OD492nm平均值为0.1719±0.0481,根据统计学分析软件计算:OD492nm平均值-x=0.1719,标准偏差SD=0.0481,30 份猪附红细胞体阴性血清样本OD492nm值呈正态分布(图5)。按照公式:确定阳性血清的临界值为-x+3SD=0.1719+3×0.0481=0.316,将-x+2SD=0.1719+2×0.0481=0.2681 定为可疑界限。因此,将OD492nm≥0.32 判定为阳性,OD492nm≤0.27 判 定 为 阴 性,OD492nm值 介 于0.27~0.32 之 间 判 定为可疑区间,需要对该样本重新检测。

表1 间接ELISA 方法反应条件的优化结果Table 1 The optimized conditions of the indirect ELISA
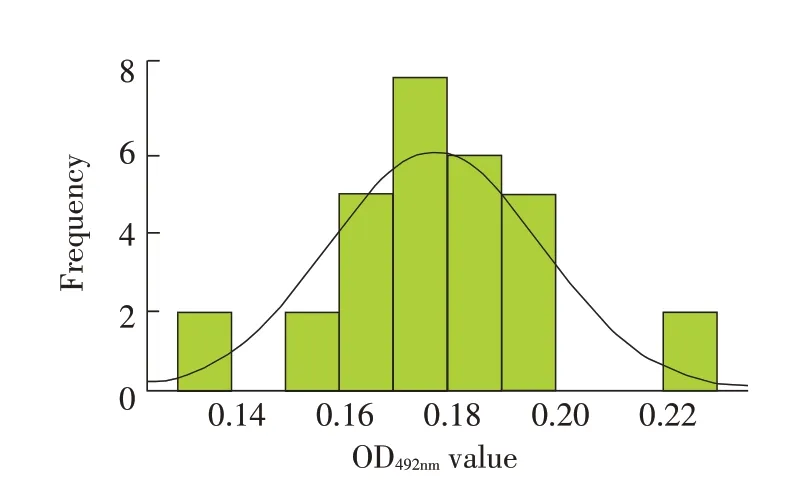
图5 阴性样品结果正态分布图Fig.5 Normal distribution diagram of negative samples
2.3.3 特异性试验 利用已建立的ELISA 方法检测猪弓形虫、猪大肠杆菌、猪肺炎支原体、猪链球菌的阳性血清,结果显示OD492nm值均小于0.32,重组蛋白ENO 不与上述血清发生交叉反应(表2)。表明该方法具有较强的特异性。
2.3.4 敏感性试验 用本试验建立的间接ELISA 方法对不同稀释倍数下的猪附红细胞体阳性血清进行检测,当阳性血清稀释320 倍,OD492nm值仍大于0.32(表3),结果表明,该方法的敏感性较高,能够检测到猪附红细胞体阳性血清的最大稀释倍数为1∶320 倍。
2.3.5 重复性试验 使用同一批次重组蛋白包被的酶标板检测7 份阳性血清,每份血清3 个重复,同一批次相同样品间的变异系数均小于5%;使用3 个不同批次重组蛋白包被的的ELISA 板,分别对该7份猪附红细胞体阳性血清进行ELISA 检测,每个样品不同批次间的变异系数均小于5%(表4),表明该间接ELISA 检测方法具有较好的重复性。

表2 间接ELISA 的特异性试验结果Table 2 The specificity test of the indirect ELISA
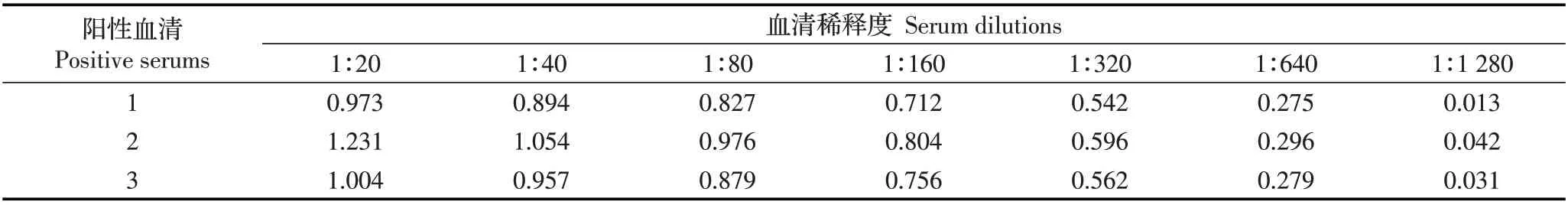
表3 间接ELISA 敏感性试验Table 3 The sensitivity test of the indirect ELISA

表4 间接ELISA 重复性试验结果(n=7)Table 4 The repeatability test of the indirect ELISA(n=7)
2.3.6 临床样品检测 利用所建立的间接ELISA 和IFA 方法对吉林省珲春市50 份猪血清样品进行检测,结果显示,间接ELISA 方法检测的阳性率为30%,比IFA方法检测的阳性率高10%。而且IFA方法检测出阳性的样品,间接ELISA 法同样检测为阳性(表5)。经计算两种方法的总符合率为90%。表明,该方法检测结果的准确性较高,可以用于临床样品的检测。

表5 临床血清样品的检测Table 5 Detection of clinical serum samples by the indirect ELISA and IFA
3 讨 论
猪附红细胞体是一种粘附于大多数脊椎动物血液红细胞中的嗜血性支原体[9-14]。猪附红细胞体病隐性感染率高,是一种对养猪业和社会公共卫生安全威胁较大的人畜共患病[15-16]。目前,对猪附红细胞体病的控制和预防没有行之有效的疫苗,临床上该病也缺少商品化的检测体系[17]。因此,建立一种经济、高效的猪附红细胞体检测方法对该病的防制至关重要。
目前,猪附红细胞体具有诊断意义的蛋白有HspA1、MSG1 以及ENO,其中ENO 是目前发现的猪附红细胞体第三种黏附蛋白[18-21]。ENO 普遍存在于多种细菌表面,并且能够加强细菌对宿主的黏附能力,被认为是具有很好免疫原性的蛋白[6]。本实验选用猪附红细胞体ENO 基因片段的长度为1 200 bp,编码393 个氨基酸,编码的氨基酸序列与其它支原体该基因编码的氨基酸序列的同源性为59.6%~65.1%,比其它支原体该基因编码的氨基酸序列多出了90 个氨基酸的C 末端片段,这些多出的氨基酸片段的作用还需要进一步的研究。因为ENO 具有粘附于猪红细胞上的作用,所以有的科学家预测,这些多出的片段很有可能与猪附红细胞体的粘附作用有关。本实验将表达出的ENO 重组蛋白经western blot 鉴定,表明该重组蛋白具有良好的反应原性。利用用已建立的ELISA 方法检测猪弓形虫、猪大肠杆菌、猪肺炎支原体、猪链球菌的阳性血清,结果显示其OD492nm值均小于0.32,表明重组蛋白不与上述血清发生交叉反应,该方法特异性较强。
猪附红细胞体病血清学诊断技术的发展受限于猪附红细胞体缺乏成熟的体外培养系统[22]。目前,猪附红细胞体血清学检测方法有双抗体夹心ELISA[23]、辣根过氧化物酶标记葡萄球菌A 蛋白的酶联免疫吸附试验(PPA-ELISA)[24]、Dot-ELISA[25],但是这些检测方法使用的均是猪附红细胞体全抗原,需要分离提纯大量的猪附红细胞体,而猪附红细胞体目前不能进行体外的增殖培养,若制备大量的猪附红细胞体,则整个制备过程耗费时间较长,工作量较大。本实验选用猪附红细胞体ENO 基因进行克隆及原核表达,得到大量的重组ENO 蛋白,用于间接ELISA方法的包被抗原,建立猪附红细胞体的间接ELISA检测方法,降低了检测成本并简化了操作步骤。特异性、敏感性及重复性试验结果显示,本实验建立的间接ELISA 方法特异、敏感、稳定,可用于临床检测猪附红细胞体病的流行情况。
利用原核表达纯化的猪附红细胞体重组ENO 蛋白为包被抗原,通过优化反应条件,建立了猪附红细胞体抗体的间接ELISA 检测方法。该方法具有较好的特异性、敏感性和重复性,适用于临床血清样品猪附红细胞体抗体检测和猪附红细胞体感染的血清流行病学调查。
