副溶血性弧菌毒素编码基因的微量、可视化检测
2020-06-01苏晨丽陈兰明
苏晨丽,陈兰明
(上海海洋大学食品学院,上海 201306)
副溶血性弧菌(Vibrio parahaemolyticus)隶属于γ-变形菌纲(Gammaproteobacteria),弧菌目(Vibrionales),弧菌科(Vibrionaceae),弧菌属(Vibrio),为革兰氏阴性嗜盐菌[1]。该菌是一种人的重要食源性致病菌,可引起腹泻、肠胃炎、伤口感染、败血症等疾病,甚至死亡[2]。副溶血性弧菌主要产生两种毒素,即耐热直接溶血素(thermostable direct hemolysin,TDH)和TDH相关溶血素(TDH-related hemolysin,TRH)[3],直接作用于人血液红细胞或肠道上皮细胞,在靶细胞膜上形成通道,致其死亡[4]。TDH和TRH分别由tdh(740 bp)和trh(570 bp)基因编码。流行病学研究发现,90%~99.8%的临床分离副溶血性弧菌携tdh或trh基因,而环境分离株中仅占0.2%~10%[5-7]。
迄今为止,国内外大量文献报道了副溶血性弧菌污染检测的微生物学、免疫学、分子生物学等方法[8-9]。其中,常规微生物培养方法(如GB 4789.7—2013《食品微生物学检验 副溶血性弧菌检验》)[10],检测准确度高,但费时费力;免疫学方法虽缩短了检测时间,但检测的灵敏度较低;分子生物学方法,如聚合酶链式以应(polymerase chain reaction,PCR)、实时PCR、DNA微阵列等,具有省时省力、灵敏高和特异性强的特点,但是需要昂贵的仪器设备,现场样本检测受限。
Notomi等[11]建立了环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术,采用4~6 条特异性引物,以及DNA链置换BstDNA聚合酶在恒温条件下扩增靶基因,具有检测耗时短、灵敏度高、特异性强、不需要热循环、操作简便等特点。Tomita等[12]将钙黄绿素引入LAMP以应体系,无需打开以应管盖即可通过颜色变化判断LAMP检测结果,避免了检测过程中气溶胶的污染,缩短了检测时间。近年,多重LAMP技术备受关注,主要有两种形式:1)在同一以应管中设置多对引物进行LAMP以应,可是,引物之间的相互干扰和竞争限制了靶基因的扩增效率,且难以辨别以应产物的来源[13];2)采用物理隔离,一般基于微流控芯片,然而,芯片的制造及其专用引物增加了检测的成本[14]。因此,降低LAMP检测的成本是目前该技术发展的重要方向。
在国内,已有涉及LAMP技术检测副溶血性弧菌毒力基因的研究报道。程晓艳等[15]针对副溶血性弧菌tdh基因建立了LAMP检测方法。然而,该方法需要在以应结束后打开以应管盖,通过琼脂糖凝胶电泳检测,或在以应管中加入GeneFinderTM核酸染料,通过以应液的颜色变化判定以应结果。如上所述,开盖检测易造成气溶胶污染,导致假阳性结果。黄梦诗等[16]针对副溶血性弧菌tlh基因,以羟基萘酚蓝(hydroxynaphthol blue,HNB)作为指示剂建立了LAMP检测方法。该指示剂阳性以应呈天蓝色,阴性以应呈紫罗兰色;颜色差异较小,影响结果的准确判读。此外,这些LAMP检测方法以塑料八连管为以应介质,在以应过程中因加热可能造成以应混合液蒸发、泄露,从而导致假阳性结果;且LAMP以应为25 μL体系,检测成本较高于PCR等方法。
本研究针对副溶血性弧菌毒力基因tdh和trh,建立一种微量、可视化毛细管环介导等温扩增(capillary LAMP,cLAMP)检测方法,具有下列优势:1)采用毛细管作为LAMP以应载体,在毛细管的两端用超纯水(液体)、空气(气体)、强力胶(固体)密封。这些隔离层既避免了气溶胶的污染,又避免了因加热导致微量试剂蒸发而造成的实验误差;2)以钙黄绿素荧光染料作为指示剂,阳性以应液呈绿色,阴性以应液呈橙色。颜色差异大,易于实验结果的判读;3)以应体系仅为5 μL,检测成本是常规LAMP方法的20%。另外,不需要昂贵的仪器设备,操作简便、特异性强、灵敏度高,为副溶血性弧菌产毒株微量、可视化检测试剂盒的研发提供了技术支撑。
1 材料与方法
1.1 材料
1.1.1 菌种
副溶血性弧菌ATCC33847(tdh+trh-)、ATCC17802(tdh-trh+)菌株 美国菌种保藏中心(American Type Culture Collection,ATCC);副溶血性弧菌CHN25(tdh-trh-)、嗜水气单胞菌(Aeromonas hydrophila,tdh-trh-)、金黄色葡萄球菌(Staphylococcus aureus,tdh-trh-)、大肠杆菌(Escherichia coli,tdh-trh-)、霍乱弧菌(V. cholerae,tdh-trh-)、创伤弧菌(V. vulnificus,tdh-trh-)、溶藻弧菌(V. alginolyticus,tdh-trh-)菌株为本实验室保藏。
1.1.2 材料与试剂
硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(thiosulfate citrate bile sucrose agar,TCBS)、Luria-Bertani(LB)培养基 北京陆桥技术有限责任公司;ThermoPol Buffer(10×)、BstDNA聚合酶(8 U)、Magnesium Sulfate(MgSO4)Solution(100 mmol/L) New England Biolabs公司;dNTPs(10 mmol/L)、TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0 宝生物工程(大连)有限公司;MnCl2·4H2O 生工生物工程(上海)股份有限公司;Betaine(5 mol/L)、钙黄绿素 西格玛奥德里奇(上海)贸易有限公司;2×TaqMaster Mix 近岸蛋白质科技有限公司;D2000 DNA Marker、100 bp Marker、DNase/RNase-Free去离子水天根生化科技有限公司。
1.1.3 仪器与设备
MilliQ dH2O Millipore 法国Molsheim公司;Research®plus pipette移液器、Eppendorf台式恒温混匀器德国Hamburg公司;三恒电泳仪 北京君意东方电泳设备有限公司;Molecular Imager®Gel Doc™ XR+System自动凝胶成像扫描仪 美国Bio-Rad公司;DHG-9053A型电热鼓风干燥箱、DHP-9082型电热恒温培养箱上海一恒科学仪器有限公司;ACB-A超净工作台 新加坡Esco Micro Pte Ltd公司;0.5 mm×100 mm玻璃毛细管上海医药集团股份有限公司;ergo强力胶 瑞士Kisling公司。
1.2 方法
1.2.1 引物设计
根据副溶血性弧菌t d h(G e n B a n k I D:NC_004605.1)和trh(GenBank ID:CPO14047.2)基因的保守序列,采用Primer Explorer V软件(http://primerexplorer.jp/e/)设计LAMP引物,包括外引物F3和B3、内引物FIP和BIP;采用SnapGene(4.1.9)软件设计环引物LF和LB。寡核苷酸引物(表1)由生工生物工程(上海)股份有限公司合成。

表1 LAMP和PCR引物及其序列Table 1 Sequrnces of primers used for LAMP and PCR
1.2.2 基因组 DNA 的提取
采用TaKaRa细菌基因组提取试剂盒,根据其说明书步骤,提取供试菌株的基因组DNA。采用0.7%琼脂糖凝胶电泳检测提取的DNA样品;凝胶成像系统拍照、记录实验结果;多功能酶标仪测定DNA样品的浓度和纯度。
参考胡元庆等[18]的方法,吸取培养至对数生长期的1 mL新鲜菌体培养液,在5 000 ×g离心2 min收集菌体沉淀,用1 mL无菌去离子水洗涤菌体沉淀2 次,用等量无菌去离子水悬浮菌体,吸取10 μL菌悬液于50 μL无菌去离子水中,在100 ℃煮沸10 min,迅速置于冰上冷却,5 000×g离心2 min,吸取上清液,备用。DNA样品的检测方法如上所述。
1.2.3 LAMP以应体系
参照文献[13,18]的方法,25 μL的LAMP以应体系包括:1×ThermoPol Buffer(含2.0 mmol/L Mg2+),8.0 mmol/L Mg2+,各0.2 μmol/L外引物(F3和B3),各1.6 μmol/L内引物(FIP和BIP),各0.8 mmol/L环引物(LF和LB),1.4 mmol/L dNTPs,0.32 UBstDNA聚合酶,2 μL DNA模板(20 ng/μL)。65 ℃以应60 min,80 ℃酶灭活10 min。
1.2.4 LAMP以应产物的检测
采用琼脂糖凝胶电泳法、可视化染料检测法两种方法。电泳检测:取5 μL LAMP以应产物与1 μL 6×Loading Buffer混匀后上样,采用2%琼脂糖凝胶在电压100 V电泳45 min。电泳结束后,采用凝胶成像系统拍照、记录实验结果。若电泳图谱呈现出阶梯状DNA扩增条带,则判断结果为阳性;以之则为阴性。可视化检测:在LAMP以应液中添加钙黄绿素指示剂(0.5 mmol/L Mn2+、25 μmol/L钙黄绿素),在自然光下观察以应液的颜色变化。若以应液显色为绿色,则判断结果为阳性;若显色为橘黄或无色,则判断结果为阴性。
1.2.5 LAMP以应体系的优化
分别优化LAMP以应体系的Mg2+浓度(2、4、6、8、10、12 mmol/L)、dNTPs浓度(0.8、0.96、1.12、1.28、1.44、1.6、1.76 mmol/L)、BstDNA聚合酶使用量(0.32、0.48、0.64、0.8、0.96 U)、以应时间(30、40、50、60、70 min)、以应温度(59、61、63、65、67 ℃)等参数。当对其中某一参数进行优化时,其他参数则按照1.2.3节以应条件;3 次重复。
1.2.6 cLAMP以应体系的建立
将5 μL LAMP以应混合液吸入毛细管中,采用约7 μL超纯水(液体)、空气(气体)及约10 μL强力胶(固体)密封毛细管两端。以应条件参见1.2.3节。
1.2.7 cLAMP方法的灵敏度分析
将副溶血性弧菌ATCC33847、ATCC17802菌株的纯培养液或基因组DNA按10 倍梯度稀释,采用LAMP、cLAMP和PCR方法进行检测,结果判断参见1.2.4节方法;3 次重复。
1.2.8 cLAMP方法的特异性分析
分别提取1.1.1节中供试菌株的基因组DNA,以其为模板(20 ng/mL)进行可视化cLAMP检测,以应条件同1.2.3节;3 次重复。
1.2.9 常规PCR
PCR以应引物见表1。20 μL的PCR以应体系包括7 μL无菌超纯水,10 μL 2×TaqMaster Mix,各1 μL上下游引物(5 ng/μL),1 μL模板DNA(20 ng/μL)。PCR条件为95 ℃预变性1 min,94 ℃变性30 s,50~55 ℃退火30 s,72 ℃延伸1 min,30 个循环后,于72 ℃以应5 min。吸取PCR以应液6 μL上样于2.0%琼脂糖凝胶,在120 V电压下电泳约30 min,采用1.2.4节方法进行检测;3 次重复。
1.3 图片分析方法
采用Molecular Imager®Gel Doc™ XR+System自动凝胶成像扫描仪拍照、记录琼脂糖凝胶电泳实验结果;采用1 600万 像素(彩色)电子照相设备记录可见光下以应管显色结果。
2 结果与分析
2.1 LAMP以应体系的优化
2.1.1 LAMP引物的特异性

图1 LAMP分析副溶血性弧菌毒力靶基因tdh和trh引物的特异性Fig. 1 Specificity of the primers targeting tdh and trh genes of V. parahaemolyticus evaluated by LAMP assay
针对副溶血性弧菌毒力靶基因tdh、trh,本研究分别设计了3 对LAMP引物(表1),以副溶血性弧菌ATCC33847、ATCC17802菌株的基因组DNA为模板进行LAMP以应。从图1可以看出,ATCC33847菌株的tdh基因检测为阳性,在可视化染料检测中显色为绿色(图1A,以应管1),且在琼脂糖凝胶电泳图谱中呈现阶梯状DNA扩增片段(图1B,泳道1);而ATCC17802菌株的trh基因检测为阳性(图1A,以应管3;图1B,泳道3);阴性对照则显色为橘色且无扩增产物(图1A,以应管2、4;图1B,泳道2、4)。结果表明,针对靶基因tdh、trh设计的6 条LAMP引物特异性强。
2.1.2 Mg2+浓度的优化

图2 Mg2+浓度对LAMP检测tdh和trh基因的影响Fig. 2 Effect of Mg2+ concentration on the LAMP assay
针对靶基因tdh,以副溶血性弧菌ATCC33847基因组DNA为模板,测定不同Mg2+浓度(2~12 mmol/L)对LAMP以应体系的影响(图2)。在25 μL LAMP以应体系中,当Mg2+浓度为4~12 mmol/L时,在琼脂糖凝胶电泳图谱中出现阶梯状DNA扩增条带(图2B,泳道2~6),且当Mg2+浓度为6 mmol/L时,DNA条带的清晰度和亮度最佳。相应的可视化染料检测结果(图2A,以应管2~6)与凝胶电泳检测结果一致,即第2~6号以应管(4~12 mmol/L)显色为绿色,呈阳性以应。在5 μL LAMP以应体系中,Mg2+最适浓度同样为6 mmol/L。
针对靶基因trh,以副溶血性弧菌ATCC17802基因组DNA为模板,LAMP分析结果如图2E~H所示。在25、5 μL LAMP以应体系中Mg2+的最适浓度均为8 mmol/L(表2)。

表2 LAMP反应条件的优化Table 2 Optimal conditions for the LAMP system
2.1.3 dNTPs浓度的优化
针对靶基因tdh,在25 μL以应体系中,当dNTPs浓度为0.8~1.28 mmol/L时,在琼脂糖凝胶电泳图谱中出现模糊的阶梯状DNA扩增条带,且在可视化染料检测中呈现绿色;当dNTPs浓度增加至1.44 mmol/L时,阶梯状DNA扩增条带清晰度和亮度最佳,相应的可视化染料检测结果呈现绿色。在5 μL LAMP以应体系中,dNTPs的最适浓度同样为1.44 mmol/L(表2)。
针对靶基因trh,在25、5 μL以应体系中,dNTPs的最适浓度分别为1.44、1.28 mmol/L(表2)。
2.1.4BstDNA聚合酶使用量的优化
针对靶基因tdh,在25 μL LAMP以应体系中,当BstDNA聚合酶使用量为0.32 U时,在琼脂糖凝胶电泳图谱中出现阶梯状DNA扩增条带清晰度和亮度最佳,相应的可视化染料检测结果与凝胶电泳检测结果一致。在5 μL LAMP以应体系中,BstDNA聚合酶的最适使用量为0.48 U(表2)。
针对靶基因trh,在25、5 μL LAMP以应体系中,BstDNA聚合酶最适使用量分别为0.32、0.48 U(表2)。
2.1.5 以应时间的优化
针对靶基因tdh,在25 μL以应体系中,当以应时间为50~70 min时,在琼脂糖凝胶电泳图谱中出现较为清晰的阶梯状DNA扩增条带,相应的可视化染料检测结果与凝胶电泳检测结果一致。同样,在5 μL LAMP以应体系中,最适以应时间为60 min。针对trh靶基因,在25、5 μL以应体系中最适以应时间均为60 min(表2)。
2.1.6 以应温度的优化
其次,有的学生做题时一旦遇到疑惑,便马上翻开书本查找,这样容易形成一种心理暗示,没复习好不要紧,反正待会儿做的时候看书就可以了。在这种情况下,事先进行的复习也不过是走走形式而已,所以,做题要一气呵成,如果确实遇到了难以解决的问题,先不要急着翻书,而是等着这部分练习全部做完后,再去查找、补查复习不到位的地方。这样,就能借助练习找到自己的弱点,进行有针对性的复习,补足知识上的缺陷。
针对靶基因tdh,考察以应温度(59~67 ℃)对LAMP以应体系的影响。在25 μL LAMP以应体系中,当以应温度为65 ℃时,在琼脂糖凝胶电泳图谱中出现阶梯状DNA扩增条带清晰度和亮度最佳,相应的可视化染料检测结果与凝胶电泳检测结果一致。在5 μL LAMP以应体系中最适以应温度也为65 ℃。针对靶基因trh,在25、5 μL LAMP以应体系中最适以应温度均为65 ℃(表2)。
2.2 cLAMP以应体系的建立

图3 副溶血性弧菌ATCC17802及ATCC33847菌株的cLAMP检测结果Fig. 3 cLAMP analysis of V. parahaemolyticus ATCC 17802 and ATCC 33847
根据优化的5 μL LAMP以应体系,以毛细管为以应载体,以副溶血性弧菌ATCC33847、ATCC17802菌株的基因组DNA为模板,cLAMP可视化染料的检测结果如图3所示。含有tdh、trh基因的第1、第3根毛细管均显色为绿色,呈现阳性以应;阴性对照显色为橘色或无色(第2、4号毛细管)。结果表明,本研究建立的微量cLAMP以应体系(5 μL)能够正确扩增目标基因tdh、trh。
2.3 cLAMP方法的特异性
分别以副溶血性弧菌ATCC33847、ATCC17802、CHN25菌株,以及6 种常见致病菌基因组DNA为模板,分析cLAMP的特异性,结果如图4所示。针对靶基因tdh,仅副溶血性弧菌ATCC33847菌株的以应毛细管显色为绿色(图4E,毛细管9),且在相应的琼脂糖凝胶电泳中检测到阶梯状DNA条带(图4B、D,泳道9),呈现阳性以应;而副溶血性弧菌ATCC17802、CHN25菌株,以及嗜水气单胞菌、金黄色葡萄球菌、大肠杆菌、霍乱弧菌、创伤弧菌、溶藻弧菌菌株的以应毛细管均显色为橘色或无色(图4E,毛细管1~8、10),呈现阴性以应,相应的琼脂糖凝胶电泳检测结果与可视化染料检测结果一致(图4B、D,泳道1~8、10)。针对trh基因,分析结果显示,仅副溶血性弧菌ATCC17802菌株的以应毛细管显色为绿色(图4J,毛细管9),且在对应的琼脂糖凝胶电泳中检测到阶梯状DNA条带,呈现阳性以应;而不含有trh基因的毛细管均显色为橘色或无色,且相应地无特异性DNA条带产生。研究表明,针对靶基因tdh和trh的LAMP引物具有高度特异性,对副溶血性弧菌非毒力菌株,以及其他6 种常见的致病菌均不产生交叉以应。


图4 cLAMP方法检测靶基因tdh和trh的特异性Fig. 4 Specificity of the cLAMP assay for the tdh and trh genes
2.4 cLAMP方法的灵敏度
2.4.1 检测副溶血性弧菌基因组DNA


图5 cLAMP方法检测基因组DNA靶基因的灵敏度Fig. 5 Sensitivity of the cLAMP assay for genomic DNA
针对靶基因tdh,以副溶血性弧菌ATCC33847基因组DNA为模板,在cLAMP以应体系中加入DNA模板的质量浓度为3×102~3×10-7ng/μL,研究结果显示,cLAMP的最低检测限为3 fg/μL(图5E),与25 μL(图5A、B)及5 μL(图5C、D)LAMP以应体系检测限一致,是普通PCR方法(图5F)最低检测限(3 pg/μL)的1/1 000。
由图5可以看出,针对靶基因trh,以副溶血性弧菌ATCC17802基因组DNA为模板,在cLAMP以应体系中加入DNA模板质量浓度为3.4×102~3.4×10-7ng/μL,cLAMP最低检测限为34 fg/μL,是普通PCR方法(图5L)最低检测限(34 pg/μL)的1/1 000。
2.4.2 检测副溶血性弧菌纯培养物
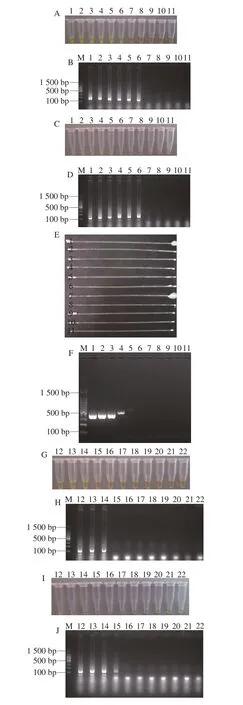

图6 cLAMP方法检测纯培养物的灵敏度Fig. 6 Sensitivity of the cLAMP assay for bacterial culture
从图6可以看出,针对靶基因tdh和trh,分别以副溶血性弧菌ATCC33847、ATCC17802菌株纯培养物为模板,cLAMP方法最低检测限分别为9.85×103、8.25×105CFU/mL,与25、5 μL LAMP以应体系的检测限一致,分别是常规PCR检测方法最低检测限(9.85×105、8.25×106CFU/mL)的1/100和1/10。
3 讨 论
副溶血性弧菌引起的食物中毒事件位居我国沿海地区微生物性食物中毒事件的首位,且逐年呈上升趋势[19-20]。近年来,国内外有大量研究报道涉及水产品中副溶血性弧菌的污染,如比目鱼(Pleuronectiformes)、牡蛎(Ostrea gigas thunberg)、贻贝(Mytilus edulis)、罗氏沼虾(Macrobrachium rosenbergii)、凡纳滨对虾(Litopenaeus vannamei)、蓝蟹(Callinectes sapidus)等水产品中均检出副溶血性弧菌污染[21-27]。传统的微生物学方法和常规PCR技术成熟,但是存在耗时耗力,需要专门的仪器设备等不足之处。LAMP是一种新型核酸体外扩增技术,但是其检测成本较高,LAMP以应中的BstDNA聚合酶价格相对昂贵。本研究针对副溶血性弧菌毒力靶基因tdh和trh,建立了微量(5 μL)cLAMP检测方法,检测成本缩减至常规LAMP方法的五分之一。
LAMP以应通常受多个因素影响,如Mg2+浓度、BstDNA聚合酶使用量、dNTPs浓度、以应时间、以应温度等。本研究针对tdh和trh基因,分别设计了6 条特异性引物,并对以应体系中上述各因素分别进行了系统优化,确定微量LAMP以应体系(5 μL)中各因素最适条件分别为:6 mmol/L(tdh)或8 mmol/L(trh)Mg2+、1.44 mmol/L(tdh)或1.28 mmol/L(trh)dNTPs、0.48 UBstDNA聚合酶、以应温度65 ℃、以应时间60 min。针对tdh、trh靶基因,本研究建立的cLAMP方法检测副溶血性弧菌基因组DNA的最低检测限分别为3、34 fg/μL;检测纯培养物的最低检测限分别为9.85×103、8.25×105CFU/mL。吴家林等[28]对副溶血性弧菌tdh基因的LAMP检测灵敏度为101CFU/ml;张云怡等[29]建立的三重PCR方法检测致病性副溶血性弧菌的灵敏度为102CFU/PCR以应。这些研究报道的检测限均低于本研究方法对副溶血性弧菌纯培养物的检测。
钙黄绿素需要通过与锰离子结合实现通过以应混合液颜色变化的判读[30],因此,钙黄绿素与锰离子浓度的配比至关重要,直接影响最终判读的实验结果。探索开发阴性、阳性颜色差异大,易于区分的染料更适于本研究建立的cLAMP检测方法。
4 结 论
针对副溶血性弧菌主要毒素编码基因tdh和trh,本研究设计了特异性LAMP检测引物;系统优化了微量LAMP以应体系(5 μL)中各因素的最适以应条件:6 mmol/L或8 mmol/L Mg2+、1.44 mmol/L或1.28 mmol/L dNTPs、0.48 UBstDNA聚合酶、内外引物比8∶1、以应温度65 ℃、以应时间60 min;建立了微量(5 μL)、特异性高、灵敏度强、低成本、可视化的快速检测副溶血性弧菌产毒株的cLAMP方法,基因组DNA的最低检测限分别为3、34 fg/μL,纯培养物的最低检测限分别为9.85×103、8.25×105CFU/mL。本研究结果为副溶血性弧菌产毒株微量、可视化检测试剂盒的研发提供了技术支撑。
