酸胁迫对S-腺苷甲硫氨酸和谷胱甘肽生物合成的影响及其生理机制
2020-06-01王大慧徐若烊黎德超卫功元
王大慧,徐若烊,黎德超,卫功元
(苏州大学基础医学与生物科学学院,江苏 苏州 215123)
S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)和谷胱甘肽(glutathione,GSH)均为广泛存在于细胞内的重要活性含硫小分子化合物,在生物体内发挥重要的生理功能。SAM具有转甲基、转氨丙基、转硫基等作用,参与体内基因调控、神经传导以及解毒等多种生理过程[1-2],GSH具有提高机体免疫力和抗氧化等功能,在临床医药、运动保健和食品加工等领域都有广泛的应用前景[3-4]。
酵母发酵法是合成SAM和GSH最常用的方法[5-6]。在酵母细胞中,SAM由L-甲硫氨酸和ATP经SAM合成酶催化合成[7];而GSH由L-谷氨酸、L-半胱氨酸和甘氨酸经γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)和谷胱甘肽合成酶催化的序贯以应合成[8]。同时,SAM和GSH的生物合成均需要ATP参与,胞内ATP的供给水平是决定SAM和GSH能否过量合成的重要因素[9]。本实验组分别通过诱变育种[10]、添加前体氨基酸[11]和能量辅助物质[12]、过量表达外源基因[13]和敲除线粒体膜相关基因[14],提高了胞内SAM和GSH的含量,实现了分批发酵过程中SAM和GSH的联合高产。SAM和GSH均属于胞内物质,细胞密度的增加将有助于二者联产产量的提高。因此,有必要考察高密度培养条件下的SAM和GSH生物合成情况及其影响因素。
在食品发酵工业中,许多微生物在代谢过程中会遭遇到酸胁迫环境,对酸胁迫也有一定的抵抗和适应能力[15-16]。不同微生物对外界酸胁迫环境的响应情况不尽相同,导致不同代谢产物在生物合成中所需的最适pH值也会有很大的差异[17]。近年来,随着微生物抗逆性相关的生理机制被逐渐解析,酸胁迫处理也开始应用于微生物代谢产物的过量合成[18]。在以往针对产朊假丝酵母分批发酵的研究中,发现pH 5.0有利于细胞生长和SAM合成[19],弱酸胁迫(pH 3.5)有助于胞内GSH含量的提升[20],而强酸胁迫(pH 1.5)则明显抑制了细胞的正常代谢[21]。然而,目前还不清楚酸胁迫对高密度培养条件下的产朊假丝酵母生物合成SAM和GSH过程将产生的影响。为此,本研究比较不同pH值条件下的产朊假丝酵母高密度培养过程,重点考察酸胁迫环境对酵母细胞合成SAM和GSH能力的影响,并对酸胁迫的作用机制进行解析,以期为深入理解产朊假丝酵母生理特性以及提高SAM和GSH生物合成能力拓展思路。
1 材料与方法
1.1 材料与试剂
产朊假丝酵母(Candida utilis Δpor1),由苏州大学微生物生理与代谢调控研究室筛选并保藏[14]。
种子培养基:葡萄糖20 g/L,酵母粉10 g/L,蛋白胨10 g/L;pH 6.0。发酵培养基:葡萄糖35 g/L,(NH4)2SO410 g/L,KH2PO412.3 g/L,L-甲硫氨酸4.6 g/L,CaCl20.05 g/L,MgSO40.05 g/L;pH值根据实验要求确定。流加培养基:葡萄糖600 g/L,(NH4)2SO4100 g/L,KH2PO4123 g/L,L-甲硫氨酸46 g/L,CaCl20.5 g/L,MgSO40.5 g/L;葡萄糖单独灭菌后与其他成分混合。
1.2 仪器与设备
1525型高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司;BIOTECH-5BGZ搅拌式发酵罐 上海保兴生物设备工程有限公司;HZ-2010KA恒温摇瓶柜 太仓市华利达实验仪器设备有限公司;J6-MI型冷冻离心机 美国Beckman公司;UV2300 II双光束紫外-可见分光光度计 上海天美科学仪器有限公司。
1.3 方法
1.3.1 种子培养
将在-70 ℃超低温冰箱中保藏的菌种(1 mL)接种至装有50 mL种子培养基的500 mL三角瓶中,于30 ℃、200 r/min摇床中培养24 h。
1.3.2 高密度培养
将种子液接种到装有3 L发酵培养基的发酵罐中,接种量10%(V/V),起始转速350 r/min,通气量3.0 L/min。为实现高密度培养,自第12小时起以多项式流加方式补加流加培养基至总糖质量浓度为200 g/L(至约28 h),具体流加操作方法见文献[22]。通过手动调节搅拌转速(300~900 r/min)将溶氧水平控制在不低于30%。pH值采用梅特勒电极在位监测,并通过流加3 mol/L H2SO4溶液或3 mol/L NaOH溶液将pH值控制在实验要求的范围内。
1.3.3 无细胞提取物的制备
取5 mL发酵液,4 ℃、12 000 r/min离心10 min,得到的酵母细胞经生理盐水洗涤2 次后,再重新悬浮在5 mL 0.2 mol/L磷酸缓冲溶液(pH 7.0)中,超声破碎10 min(破碎10 s,间隔10 s),4 ℃、12 000 r/min离心20 min,收集上清液(即无细胞提取物),用于测定胞内物质的质量浓度和关键酶活性。
1.3.4 指标测定
细胞干质量和葡萄糖质量浓度的测定参考文献[4]。
胞内SAM的提取和测定[10]:取10 mL新鲜发酵液,3 500 r/min离心10 min,湿细胞用0.35 mol/L稀硫酸溶液萃取2 h,离心,上清液经0.22 μm微孔滤膜过滤,获得的样品采用HPLC法测定SAM质量浓度。
GSH的提取和测定[23]:取10 mL新鲜发酵液,3 500 r/min离心10 min,湿细胞在30 ℃用体积分数40%乙醇溶液萃取2 h,离心,取上清液采用DTNB-谷胱甘肽还原酶循环法定量测定GSH质量浓度。
胞内NADH、NAD+、ATP和ADP质量浓度的测定采用HPLC法[11]。
1.3.5 酶活性测定
SAM合成酶(蛋氨酸腺苷转移酶(methionine adenosyltransferase,MAT))活性的测定方法参见文献[12]。
γ-GCS、己糖激酶(hexose kinase,HK)、ATP合成酶、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)的活性以及丙二醛(malondialdehyde,MDA)含量均采用南京建成生物科技有限公司的相关试剂盒进行测定,具体操作步骤参照试剂盒说明书执行。
异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)活性采用上海酶联生物科技有限公司的试剂盒进行测定,具体操作步骤参照试剂盒说明书执行。
1.3.6 发酵过程参数计算
胞内SAM和GSH含量、细胞得率、SAM和GSH得率、细胞生产强度、SAM和GSH生产强度等发酵过程参数的计算方法见文献[14]。
1.4 数据统计分析
所有实验数据均以3 组平行样品检测结果的 ±s表示,差异显著性检验以pH 5.0组作为对照组,用t检验双尾检验分析。Excel 2010软件作图。
2 结果与分析
2.1 不同pH值条件下的SAM和GSH联产发酵过程分析

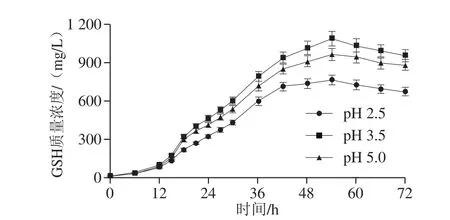
图1 不同pH值条件下的SAM和GSH联产发酵过程Fig. 1 Time courses of high cell culture for the co-production of SAM and GSH under different pH conditions
在前期分批发酵研究[18-21]的基础上,重点考察酸胁迫环境对高密度培养条件下产朊假丝酵母生物合成SAM和GSH的影响。为此,将发酵培养基的pH值分别控制在2.5(强酸胁迫)、3.5(弱酸胁迫),并以pH 5.0(适合生长)作为对照。不同pH值条件下的葡萄糖消耗、细胞生长、SAM和GSH合成情况见图1,SAM和GSH产量、含量、得率和生产强度等发酵过程参数的最大值见表1。可以看出,酵母细胞能在较宽的pH值范围内利用葡萄糖进行生长并达到较高的细胞密度,但是在pH 2.5和pH 3.5条件下的最大细胞干质量分别比pH 5.0时的水平下降10.1%和8.1%。综合细胞得率和生产强度等过程参数的结果可以发现,酵母细胞在酸胁迫环境下的生长代谢明显受到了一定程度的抑制。

表1 不同pH值条件下的SAM和GSH联产发酵过程参数Table 1 Parameters involved in high cell culture for the co-production of SAM and GSH under different pH conditions
与细胞生长情况不同,pH 3.5有利于SAM和GSH的生物合成(图1),胞内SAM和GSH含量分别比pH 5.0时的结果高出17.1%和20.9%,最终SAM和GSH联产量也提高了10.4%。表1中SAM、GSH得率和生产强度等结果也证明了pH 3.5可以促进SAM和GSH在酵母细胞内的合成和积累。然而,在pH 2.5条件下,酵母细胞的SAM和GSH合成能力明显下降,SAM和GSH的联产量、得率、生产强度等指标均低于pH 5.0条件下的结果。由此可见,弱酸胁迫可以提高SAM和GSH的合成能力,而强酸胁迫则对酵母细胞的代谢过程产生了不利的影响。以下将对酸胁迫在高密度联产发酵中的作用机制进行解析。
2.2 SAM和GSH合成关键酶活性
MAT和γ-GCS分别是SAM和GSH生物合成途径中的关键酶[7-8],图2结果表明,在同一pH值条件下,细胞生长期间(前36 h)的MAT活性均维持在相对稳定的水平,而在高密度培养后期(48、60 h)MAT的活性有所提高,但幅度不大。与此同时,γ-GCS活性在细胞生长期逐渐增加,至36 h达到最大值,之后逐渐降低。图2还表明,在任一培养阶段,pH 3.5时的MAT和γ-GCS活性均高于pH 2.5和pH 5.0时的活性,表明弱酸胁迫环境有利于将SAM和GSH生物合成关键酶的活性维持在较高水平。
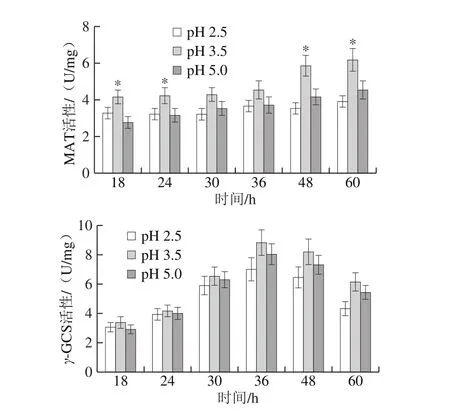
图2 不同pH值条件下的MAT和γ-GCS活性Fig. 2 Activities of MAT and γ-GCS under different pH conditions
2.3 能量代谢物质合成关键酶活性
HK和IDH分别是糖酵解途径和三羧酸循环的关键酶之一,在好氧发酵中,其活性的大小对胞内葡萄糖消耗和NADH形成速率均能产生重要的影响[9]。由图3可以看出,不同pH值环境下的酵母胞内HK活性均在18 h达到较高的水平,此时pH 3.5和pH 5.0条件下的HK活性相差不大。此外,在葡萄糖流加期间,IDH基本不受pH值环境和培养时间的影响,其活性一直维持在较为稳定的水平;至第30小时,IDH活性虽然有所提高,但不同pH值条件下的结果没有明显差异。综合30 h前的HK和IDH活性结果可以发现,pH 3.5和pH 5.0环境比pH 2.5更加有利于底物的消耗,并促进NADH的合成与供给。
为研究酵母胞内ATP的合成是否受pH值的影响,检测不同培养阶段ATP合成酶的活性,结果如图4所示。可以看出,pH 2.5条件下的ATP合成酶活性一直维持在较低水平,且不同培养时间下的酶活性没有明显差异,而在pH 3.5和pH 5.0时,流加结束后的ATP合成酶活性均明显提高,其中pH 3.5更有利于将ATP合成酶活性提高到较高水平。因此,在NADH供给充足的前提下,细胞在pH 3.5条件下可以合成更多ATP,以满足生长和代谢的需要。

图3 不同pH值条件下的HK和IDH活性Fig. 3 Activities of HK and IDH under different pH conditions

图4 不同pH值条件下的ATP合成酶活性Fig. 4 Activity of ATP synthase under different pH conditions
2.4 胞内能量代谢物质水平及比率


图5 不同pH值条件下的胞内能量代谢物质含量及比率Fig. 5 Intracellular levels and ratios of energy metabolism substances under different pH conditions
为了考察pH值对酵母能量代谢的影响,对胞内与能量代谢有关的辅因子物质(NADH、NAD+、ATP和ADP)含量进行测定。图5结果表明,不同pH值条件下的胞内NADH和ATP含量均在第30小时达到最高水平,且pH 3.5比pH 2.5和pH 5.0的水平更高。与此同时,NADH/NAD+和ATP/ADP比率在30 h后均处于较为稳定的水平,其中pH 3.5时的比率更高,体现出弱酸胁迫环境下NADH和ATP具有更强的再生能力,为胞内能量物质的充足供给提供有力保障。
2.5 胞内氧化还原环境
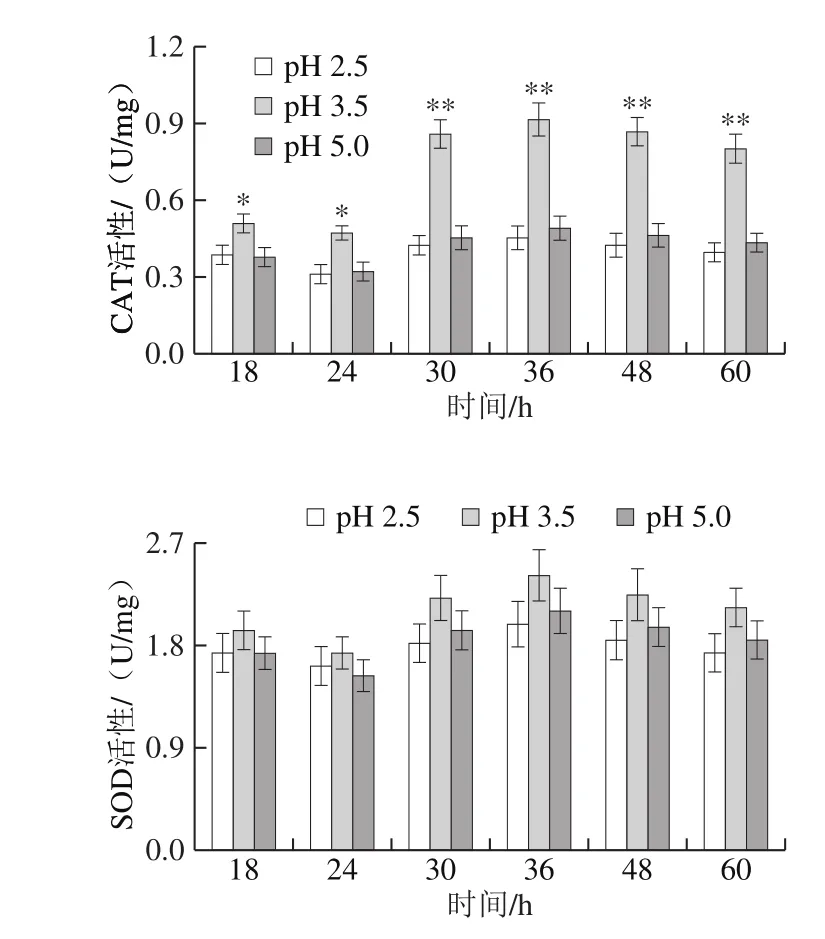
图6 不同pH值条件下的CAT和SOD活性Fig. 6 Activities of CAT and SOD under different pH conditions

图7 不同pH值条件下的胞内MDA含量Fig. 7 Intracellular contents of MDA under different pH conditions
为考察pH值对酵母胞内氧化还原环境的影响,测定CAT、SOD活性以及MDA含量,结果见图6、7。可以发现,当pH 2.5时的不同培养时间下CAT、SOD活性和MDA含量与对照(pH 5.0)相比没有显著差异;而pH 3.5时的CAT活性明显高于对照,SOD活性变化不大,而胞内MDA含量则相应下降。以上结果表明,弱酸胁迫有利于CAT活性的提高,同时也有助于保护细胞和细胞膜免受氧化应激损伤。
3 讨 论
酸胁迫常见于食品发酵工业中。一般认为,环境中较低的pH值将促使H+通过细胞膜渗漏进入胞内,导致微生物胞内pH值下降,进而影响胞内的一系列生化以应和细胞的正常生长与代谢[17,24]。为适应酸胁迫环境,维持胞内pH值的相对稳定,微生物细胞已经进化出多种调节机制,主要包括:消耗ATP将H+泵出胞外[25]、通过激活特定酶系消耗胞内的H+[26]、诱导细胞合成伴侣蛋白以修复损伤[27]、改变细胞膜结构以保护细胞免受伤害[28]等。此外,有研究结果表明,GSH在微生物抵抗酸胁迫过程中也具有积极作用,GSH可以通过作为“自杀式”消耗的底物阻止胞内pH值的快速下降[29-30]。本研究利用GSH的这种生理特性,通过对产朊假丝酵母进行弱酸胁迫处理,实现了高密度培养条件下的GSH过量合成,酵母细胞的SAM合成能力也有明显提高。在此基础上,对弱酸胁迫在SAM和GSH联合高产中的作用及其生理机制进行了解析。
在酵母细胞内,SAM和GSH均属于甲硫氨酸代谢途径中的关键节点物质[31]。在甲硫氨酸供给充足的前提下,关键酶MAT和γ-GCS活性的提高将有利于SAM和GSH的过量合成。本研究结果表明,强酸胁迫条件下的MAT和γ-GCS活性均受到部分抑制,而弱酸胁迫则有助于将关键酶活性维持在更高的水平。因此,弱酸胁迫提高了产朊假丝酵母合成SAM和GSH的能力,从而进一步提升了高密度培养下SAM和GSH的联产量。
除物质代谢以外,能量代谢物质ATP的供给与消耗也是决定SAM和GSH能否过量合成的重要因素[13]。产朊假丝酵母利用葡萄糖进行好氧生长和代谢时,中心代谢途径中HK和IDH以及ATP合成酶的活性将影响到葡萄糖的消耗、NADH和ATP的形成[9]。通过对不同pH值条件下HK和IDH活性进行比较,发现弱酸胁迫虽然对IDH活性影响不大,但提高了HK活性,加速了葡萄糖的利用,有利于NADH的形成。同时,ATP合成酶活性在弱酸胁迫条件下也有明显的提高,从而加快了从NADH到ATP代谢的进程。结合胞内NADH和ATP水平、NADH/NAD+和ATP/ADP比率结果可以得出,弱酸胁迫促进了能量代谢物质的合成和再生,为SAM和GSH过量合成所需ATP提供了充足的保障。
微生物细胞在遭遇胁迫环境时,容易产生自由基而影响到胞内氧化还原环境[32-33]。胞内消除自由基损伤的机制主要包括具有抗氧化能力的酶类和还原性物质[34]。本研究的CAT和SOD活性结果表明,产朊假丝酵母抵抗弱酸胁迫可能主要依赖于CAT活性的提高,而在强酸胁迫条件下的抵抗机制应该更多地来自于还原性物质的保护。MDA是生物体内脂质与自由基发生过氧化以应的产物,其含量的高低通常体现出细胞膜脂质的过氧化程度和细胞损伤程度[35]。本研究弱酸胁迫下的MDA含量低于强酸胁迫和pH 5.0时的结果,表明该条件下的胞内氧化还原环境更加有利于细胞维持正常的结构和功能,这一方面得益于胞内更高的CAT活性,另一方面也要归功于胞内更高的GSH含量。
综上,本实验考察并比较了不同pH值条件下的产朊假丝酵母高密度培养过程,发现弱酸胁迫有利于提升SAM和GSH的合成能力,进而提高了SAM和GSH的联产量。在分析发酵动力学参数的基础上,结合SAM和GSH生物合成关键酶活性、能量代谢物质的水平与比率,以及胞内氧化还原水平,部分解析了弱酸胁迫促进SAM和GSH联合高产的生理机制。研究结果有助于深入理解酵母细胞响应酸胁迫的生理机制,同时也为提高SAM和GSH联产发酵产量提供了一种可行的思路。
