进展期直肠癌新辅助放化疗研究进展
2020-06-01高倩闽陈昕涛姚厚山胡志前
高倩闽 陈昕涛 姚厚山 胡志前
根据2014 年中国恶性肿瘤发病和死亡分析统计,我国结直肠癌发病率(27.08%)位于第三,死亡率(13.13%)位于第五[1]。直肠癌发病率约占结直肠癌总发病率的1/2,且以中低位直肠癌为主,中晚期直肠癌居多[2]。由于直肠癌早期症状不明显,多数患者初诊时即为中晚期直肠癌。一项基于SEER(Surveillance,Epidemiology,and End Results,SEER)数据库的研究表明,进展期直肠癌(T3/T4N0 及TxN +)患者占TN 可评估直肠癌的72.2%[3]。在我国,由于筛查与诊断的普及率与准确率尚与国外先进水平存在一定差距,所以进展期比率更高。
直肠癌手术的技术难点在于:中低位直肠癌处在狭窄的骨盆中,必须完全切除多余的脂肪和直肠系膜。此外,还需充分保留排便、泌尿和性功能,以保证患者的生活质量[4]。由于直肠解剖结构及淋巴回流的特性,直肠癌患者术后局部复发率(local recurrence rate,LRR)通常高于结肠癌,预后差[5]。目前,直肠癌的治疗模式已由过去单一的手术切除发展成为多学科综合治疗模式,其中新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)已成为Ⅱ/Ⅲ期直肠癌的多学科治疗方法之一[6]。
一、nCRT 作为直肠癌标准治疗的证据
在许多国家,已针对Ⅱ/Ⅲ期直肠癌的治疗进行了标准化[7]。该方法包括以5-氟尿嘧啶(5-Fluorouracil,5-FU)为基础的nCRT,根治性直肠全系膜切除术(total mesorectal excision,TME)和辅助化疗(adjuvant chemotherapy,aCT)。新辅助化疗多与放疗联合使用,新辅助化疗可与放疗形成协同效应进一步改善直肠癌患者的预后。
20 世纪90 年代,欧洲国家普遍认为术前放疗是Ⅱ/Ⅲ期直肠癌的标准治疗方法。而后,欧洲癌症研究和治疗组织(EORTC)启动了一项四臂随机试验(EORTC 22921),法国针对没有远处转移的Ⅱ/Ⅲ期直肠癌患者启动FFCD 9203 试验,比较了术前同步放化疗和单纯术前放疗对于直肠癌的疗效、总体生存率(overall survival,OS)和无进展生存期(progression-freesurvival,PFS)。多篇系统回顾[8-11]的结论是,术前同步放化疗较术前单纯放疗能够获得更高的局部控制率、病理完全缓解(pathologic complete remission rate,pCR)率和R0-R1 切除术的可行性,但对于OS 和PFS 并无影响。
也有试验比较了术前放化疗和术后放化疗的疗效。德国的一项随机对照试验(CAO/ARO/AIO-94)纳入了799 位临床分期为Ⅱ/Ⅲ期直肠癌患者,将其分为术前同步放化疗组和术后同步放化疗组。研究结果显示术前组和术后组的10年OS(59.6%vs.59.9%,P=0.85),10年累积LRR(7.1%vs.10.1%,P<0.05),远处转移的10 年累积发病率(29.8%vs.29.6%,P=0.9),无病生存率(disease-free survival,DFS)没有检测到显著差异,但术前放化疗组LRR 较术后放化疗组低(6%vs.13%,P=0.006),提高了保肛率(19%vs.39%,P=0.004),降低了治疗相关毒副反应(27%vs.49%,P=0.001)。该临床试验为直肠癌采用新辅助放化疗提供了有力的证据[12]。
二、新辅助化放疗的适应证
中国结直肠癌诊疗规范指南(2015 版),推荐临床诊断为Ⅱ/Ⅲ期(cT3-4b 和/或N1-2M0)直肠癌行术前放疗或术前同步放化疗;对于不可手术切除的晚期直肠癌,建议行新辅助同步放化疗,再予以评估肿瘤情况,争取根治性手术[13]。
2013 年ESMO 指南推荐对直肠癌应根据复发风险进行分层治疗,分层指标包括肿瘤浸润深度(T 分期)、淋巴结转移数目(N 分期)、距肛缘距离、直肠系膜筋膜(mesorectal fascia,MRF)和肠壁外脉管(extramural vascular invasion,EMVI)侵犯情况等。
使用磁共振成像(MRI)进行术前局部成像对于分期是必不可少的。有研究表明,DTI-MRI 可以帮助更准确地确定直肠癌的肿瘤范围[14]。例如,根据固有肌层以外的直肠系膜浸润深度,cT3 直肠癌可进一步分为亚组(T3a <1 mm;T3b 1~5 mm;T3c 5~15 mm 和T3d >15 mm)。MRI 还可以精确评估MRF 的状态,例如从肿瘤到MRF 的距离(周缘:CRM)和肠壁外血管侵犯(EMVI)等等。而在无转移的直肠癌风险类别的综合评估中,除T 和N 分期、EMVI,MRF 受累外,还考虑患者特征和患者偏好。
依靠MRI 最终可以将患者分为极低危组、低危组、中危组和高危组。中危组直肠癌患者,即“cT3a/b 在极低位直肠,未侵犯肛提肌,未侵犯MRF;cT3a/b 在中或高位直肠;cN1-2(非结外侵犯),无EVMI”,能从术前同步化放疗中获益[15],对其进行短期新辅助放疗或nCRT 有助于维持外科手术中的TME 平面。
另外,磁共振肿瘤消退分级(MRI tumor regression grading,mrTRG)被广泛应用于直肠癌术前临床诊断和治疗反应检测。肿瘤消退在MRI 上表现为纤维间质信号填充[mrTRG4~5,纤维化程度低,肿瘤消退少;mrTRG1~3,纤维化程度高,退缩明显;mrTRG4~5 组与mrTRG1~3 组生存差异有统计学意义,DFS分别为31%和64%(P=0.007),5 年OS 分别为27%和72% (P=0.001)][16]。但有Meta分析表明mrTRG 和病理肿瘤消退分级(pTRG)相关度低,只能术前与常规病理因素相结合以改善预后[17]。
三、从新辅助放化疗结束到手术的最佳间隔
目前,从新辅助放疗结束到手术的间隔时间大多参考Lyon R 90-01 试验[18]。该随机试验证明,新辅助放疗可以使pCR 或接近pCR 的比例提高[短间隔(2 周)10.3%vs.长间隔(6~8 周)26%(P=0.0054)]。2018 年,一篇综述分析了13 项涉及19 652 名患者的研究,以阐明nCRT与手术之间的间隔如何影响pCR 率[19]。分析发现,与间隔≤8 周相比,在nCRT 结束后≥8 周进行手术对于直肠癌患者是安全有效的,并且能显著提高pCR 率而不增加手术时间或术后并发症。所以到目前为止,最佳间隔被认为是6~8 周。
2013 年荷兰的一项回顾性分析,提出nCRT 后10~11 周是降低pCR 率的最佳时期,这是至今最长的手术间隔[20]。2016 年,一项随机对照III 期试验(GRECCAR-6)比较了nCRT 结束与手术之间的间隔(7 周vs.11 周)对pCR 率的影响。结果两组的pCR 率没有差异(15.0%vs.17.4%,5.7%vs.17.2%;P=0.5983),而11 周组的所有术后并发症均显著高于7 周组(7 周组32%vs.11 周组44.5%;P=0.04)。其中包括腹部会阴切除术(APR)后的手术并发症和会阴伤口的延迟愈合[21]。这项研究提出了新的证据,即nCRT和手术之间较长的间隔不会提高pCR 率,且可能会增加术后并发症的发生率。
四、新辅助治疗模式
(一)诱导化疗的应用
诱导化疗是指在同步放化疗之前进行化疗。现有的临床试验已验证了诱导化疗在直肠癌新辅助治疗中的作用[22-24]。在西班牙的GCR-3 临床试验中,将108 位直肠癌患者随机分为试验组(四周期CAPOX 诱导化疗+CAPOX 同步放化疗+TME)和常规组(CAPOX 同步放化疗+TME +四周期CAPOX 辅助化疗),结果显示试验组的pCR 率较常规组差异并无统计学意义(13%vs.14%,P=0.94),两组间的R0 切除率也没有差异(87%vs.86%,P=0.40),但是试验组化疗的Ⅲ~Ⅳ不良反应事件发生率明显少于常规组(54%vs.19%,P=0.0004)[24]。MSKCC 回顾性分析了61 位接受FOLFOX 方案诱导化疗的局部进展期直肠癌患者,结果显示获得cCR 或者pCR 率为36%(22/61),47%(23/61)的患者有较好的癌细胞反应率[23]。以上研究表明,诱导化疗能减少患者化疗毒性反应,提高化疗耐受性的同时获得较好的肿瘤反应,而且诱导化疗并不影响同步放化疗和手术的实施。目前,诱导化疗已成为NCCN指南推荐的治疗选择。但对于诱导化疗的方案及疗程尚需更多的大样本Ⅲ期临床试验进行研究。
(二)巩固化疗的应用
巩固化疗是指在同步放化疗和手术之间的间隔进行化疗。通常情况下,同步放化疗治疗后需要休息6~8 周才能接受手术。在这段时间内如果缺乏治疗可能存在肿瘤进展的风险。那么,在此期间进行化疗减少肿瘤进展的风险及进一步根除放疗后残余肿瘤细胞,能否达到更好的肿瘤客观缓解率? MSKCC 的一项多中心临床试验,将局部进展期直肠癌接受同步放化疗后手术和同步放化疗后分别给予FOLFOX6 方案2 次、4 次、6 次化疗再行手术的患者进行比较,结果表明巩固化疗能够增加肿瘤病理缓解率,但是毒性反应随着巩固化疗疗程的增加而增加[25]。复旦大学附属肿瘤医院进行的一项Ⅱ期临床试验,在新辅助放化疗后行一周期XELOX 化疗,结果显示pCR 率为23.7%[26]。以上研究表明,巩固化疗能够提高肿瘤客观缓解率,但目前研究多为Ⅱ期临床试验且样本量较小,缺少高级别的循征医学证据支持。
(三)诱导化疗+同步放化疗+巩固化疗的应用
“类三明治”新辅助治疗方案(诱导化疗+同步放化疗+巩固化疗)将同步放化疗对肿瘤退缩的效果和诱导化疗及巩固化疗能够增强放化疗敏感性、控制全身微转移灶等优点结合以达到进一步提高肿瘤客观缓解率、减少肿瘤复发率的目的[6]。中山大学附属肿瘤医院进行的一项Ⅱ期临床试验,采用XELOX +XELOX/RT +XELOX 新辅助方案治疗局部进展期直肠癌。共有49 例患者入组,1 例患者因毒性反应未能完成巩固化疗,其余患者均完成计划好的治疗方案;4 位患者因cCR(临床病理缓解)放弃手术治疗,该研究的pCR 率为42.2% (19/45),11.1%(5/45)的患者出现术后并发症[27]。另外一项单臂Ⅱ期临床试验评估FOLFOX/Bev +Bev/5-FU/RT +FOLFOX 新辅助方案治疗直肠癌的疗效[28],pCR 率为36%(9/25),3 年为95%,3 年DFS 为72.5%。本中心近年来启动了一项临床试验,评估局部进展期直肠癌接受XELOX +Cap/RT +XELOX 新辅助方案的安全性及疗效,结果显示pCR 率为28.9%(11/38),所有患者均按计划完成新辅助治疗,3 级不良反应事件发生率为18.4%(7/38)。详见表1。以上研究显示诱导化疗+同步放化疗+巩固化疗的新辅助治疗方案具有较好的应用前景,但仍需更多的大样本RCT 研究来进行验证。
五、nCRT 方案的改进
目前,nCRT 方案是以氟尿嘧啶类药物为基础的方案。5-FU 为胸苷酸合成酶抑制药,需静脉用药。卡培他滨作为一种口服的氟尿嘧啶衍生物,能够模拟5-FU 持续灌注给药。两者都可作为新辅助放疗同步化疗的药物选择。在过去十年中,针对转移性CRC(mCRC)的某些患者特征,已经研发了近十二种靶向治疗和免疫治疗的药物。检查点抑制剂如派姆单抗(pembrolizumab)已被证明可有效延长错配修复(MMR)缺陷和高微卫星不稳定性(MSI-H)mCRC 患者的存活率。抗血管生成的贝伐单抗[抗血管内皮生长因子(抗VEGF)]与一线和二线治疗中的化学疗法组合可增加mCRC 存活率。西妥昔单抗联合化疗延长了KRAS 和所有RAS 野生型mCRC 患者的生存期。此外,正在研究的免疫疗法,RTK,单克隆抗体和细胞毒性药物的组合同时靶向攻击肿瘤标志物以减少复发。尽管需要更大的临床试验来获得FDA 的批准,人类表皮生长因子受体2(HER2)治疗给HER2 阳性mCRC 患者带来了希望[29]。
近年来,多项前瞻性临床随机对照试验评估5-FU 同步放化疗的基础上联合使用奥沙利铂(oxaliplatin,OX)新辅助治疗方案的疗效及预后,详见表2。
西妥昔单抗的地位日益上升,目前,NCCN 指南推荐西妥昔单抗联合标准方案化疗或单药维持在KRAS 野生型的晚期或转移性结直肠癌患者中作为一线方案使用。
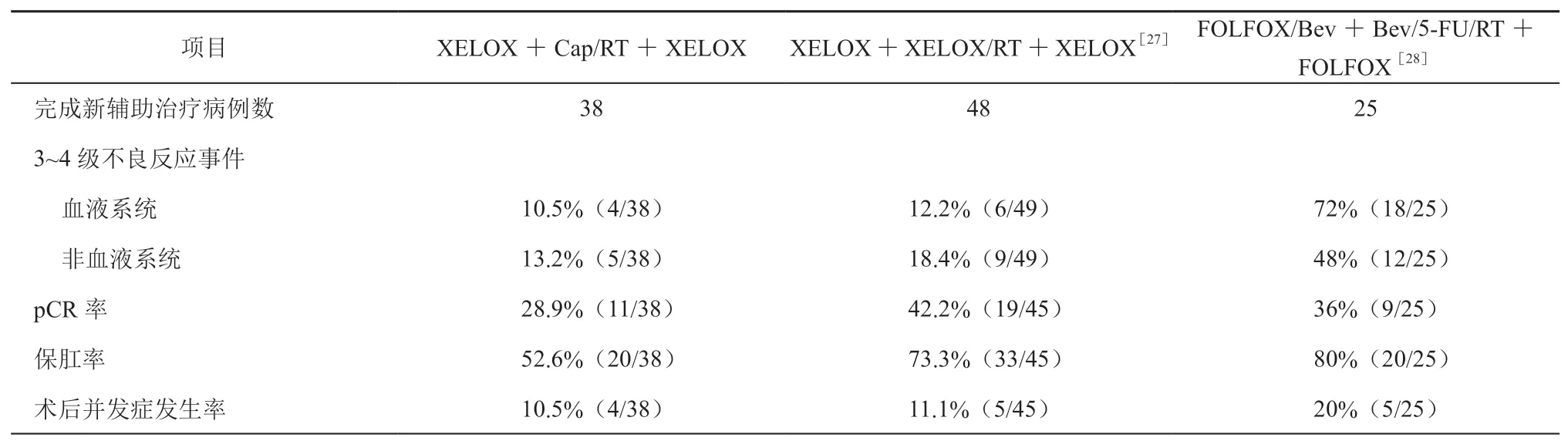
表1 “类三明治”新辅助治疗模式临床研究汇总
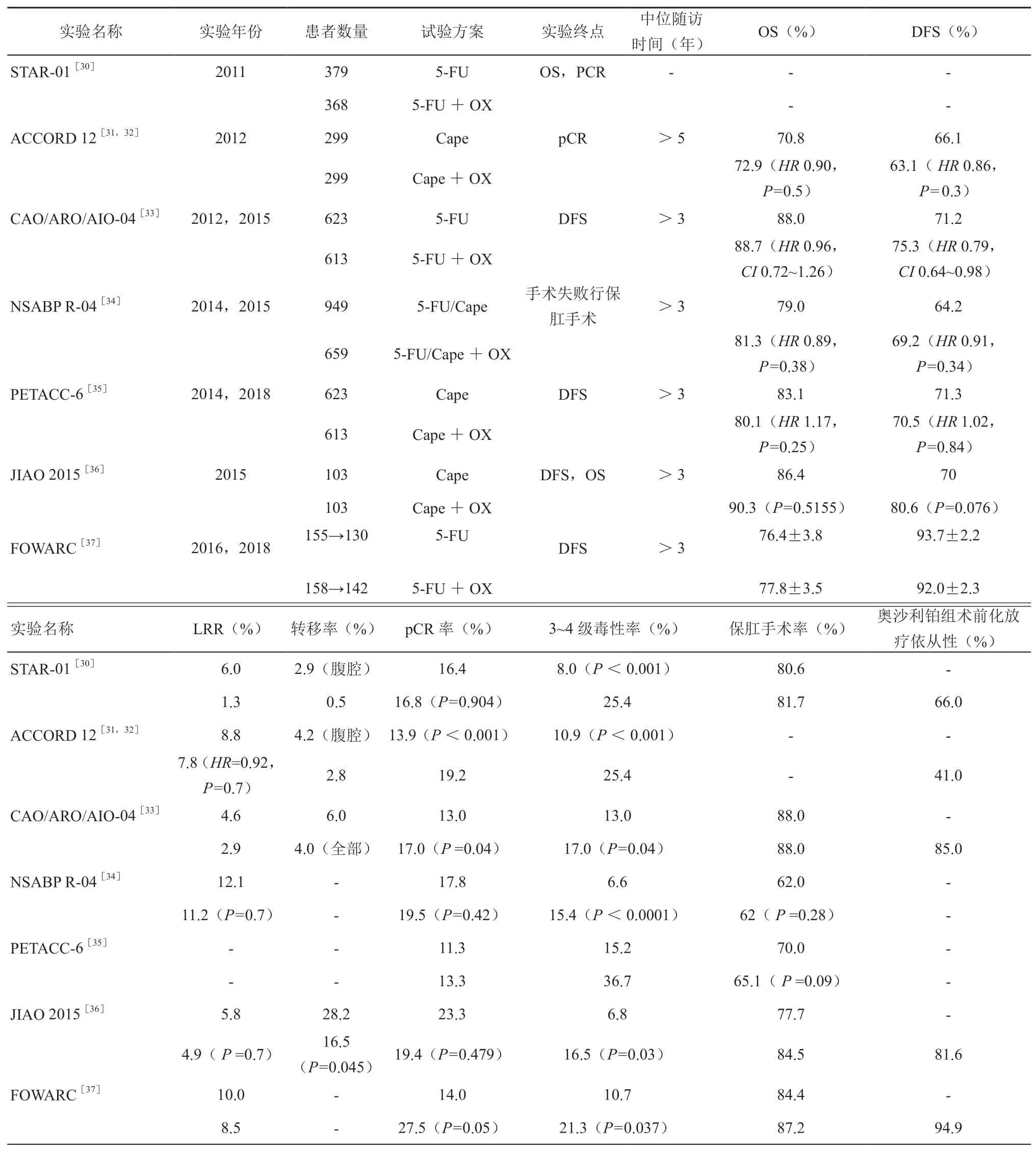
表2 新辅助治疗中添加奥沙利铂的临床试验
六、nCRT 的局限性
对于T3N0 期(ⅡA 期)直肠癌患者是否应该行新辅助治疗存在较大的争议。T3 期是指肿瘤穿透固有肌层到达浆膜下层,或侵犯无腹膜覆盖的结直肠旁组织;但该期肿瘤侵犯的距离差异很大。既往研究发现T3 期直肠癌的浸润深度与预后存在密切关系[50-51]。
目前的影像学技术尚不能对直肠癌患者进行精确评估[17],导致部分患者分期不准确,进行了过度治疗或者未得到及时治疗。此外,目前文献报道的新辅助治疗局部进展期直肠癌的pCR 率大都在5%~25%,也就是说有一大部分进展期直肠癌患者不能从新辅助治疗中获益。
目前没有一项直肠癌治疗的随机试验,即使是在进行了超过10 年随访的CAO/ARO/AIO-94 试验和荷兰TME 试验中,使用短程新辅助放疗的治疗方案或新辅助放疗联合5-FU 的直肠癌治疗方案也没有显示出对远期疗效和OS 的积极作用[52-53]。
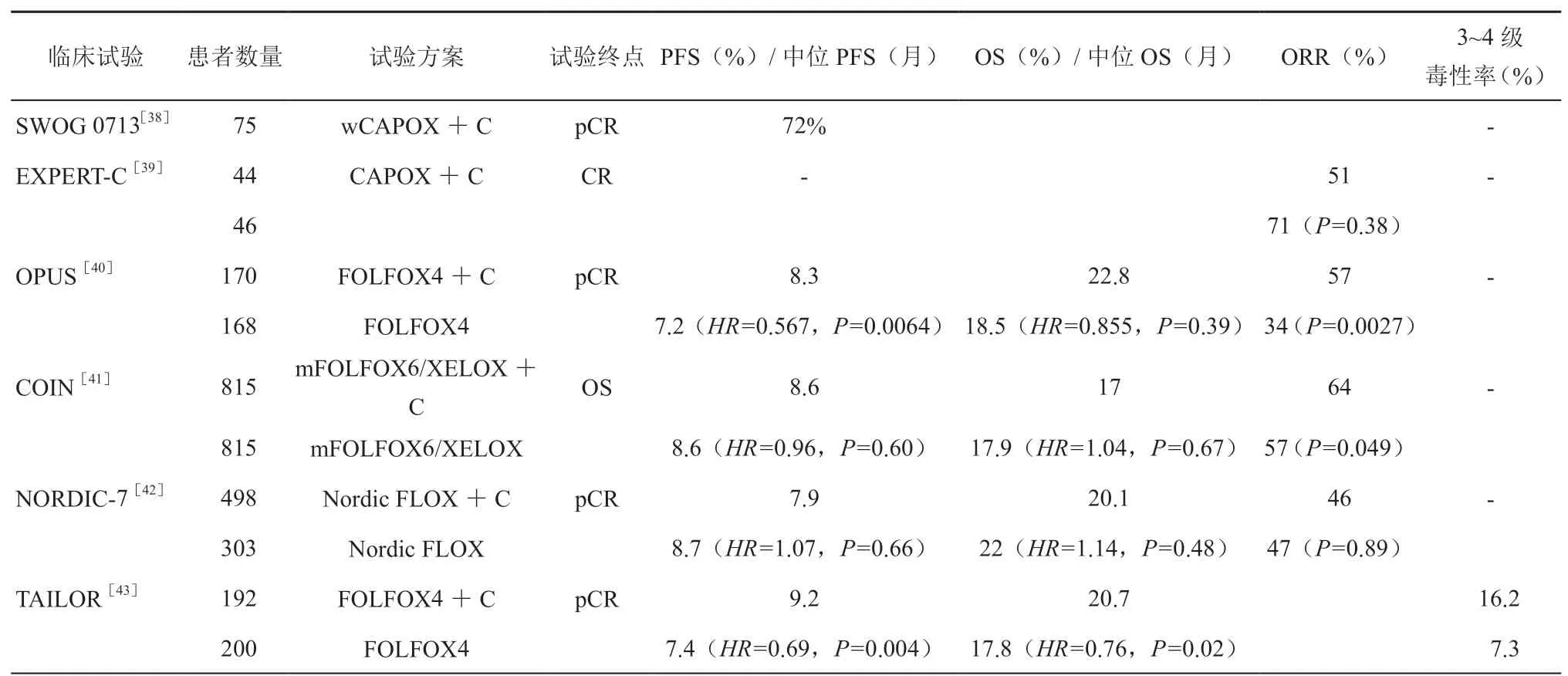
表3 直肠癌新辅助治疗中在奥沙利铂的基础上添加西妥昔单抗的临床试验
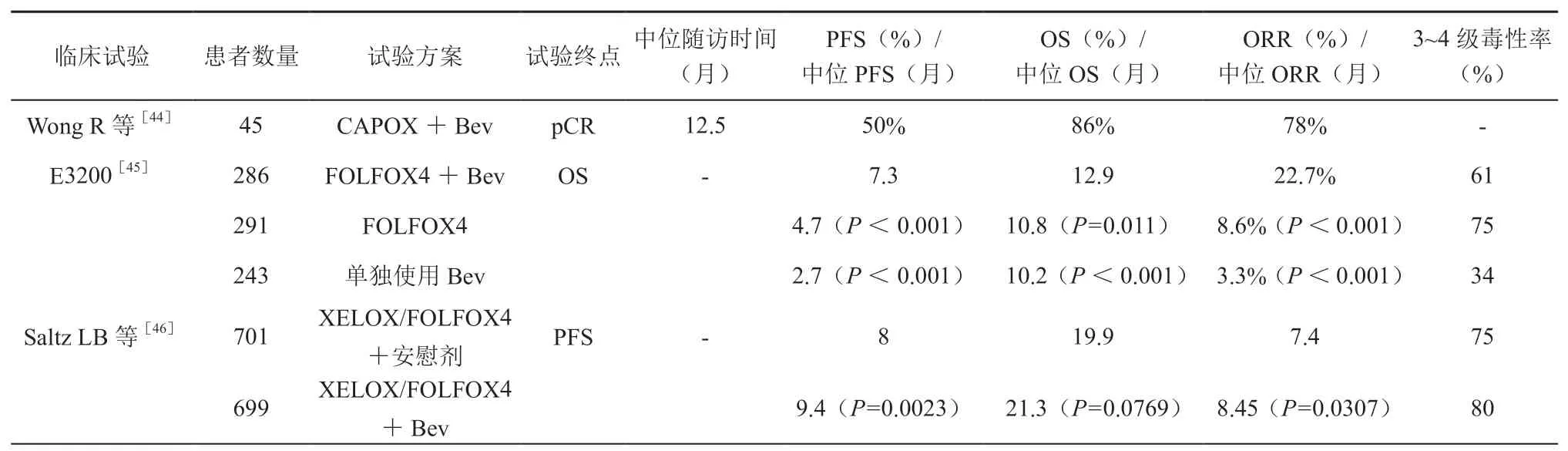
表4 直肠癌新辅助治疗中在奥沙利铂的基础上添加贝伐单抗的临床试验

表5 直肠癌新辅助治疗中在奥沙利铂的基础上添加伊立替康的临床试验
七、总结与展望
nCRT 是目前治疗局部进展期直肠癌的重要手段,它能够使局部进展期直肠癌降级降期,缩小原发病灶,增加手术机会,提高肿瘤根治率,降低局部复发风险及增加保肛率。但直肠癌在个体化治疗方面仍存在瓶颈:第一,如何防止分期失误导致错选治疗方案;第二,如何及早了解患者对化放疗的敏感度,以采取措施防止肿瘤进展;第三,如何提高患者对放化疗的耐受度,减少毒性反应;第四,如何预计nCRT 后的肿瘤情况。
尽管通过改进手术和放化疗技术显著降低了LRR,远端转移仍然是局部晚期直肠癌患者死亡的最重要原因。Yamashita 等[54]在综述中表示,基于基因组学(KRAS 和TP53 的突变、microRNAs、循环肿瘤DNA)、代谢组学(血清癌胚抗原水平)、全身炎症反应(高度改良的格拉斯哥预后评分),建立精准医学的预测模型可能是解决方案。希望未来有更多的研究投入到直肠癌新辅助放化疗的研究中,来解决以上问题,给直肠癌患者带来福音。
