lncRNA ZBED3-AS1通过吸附miR-512-5p调控DACH1抑制前列腺癌细胞的增殖和迁移
2020-05-29周毅彬薛波新
向 涵,刘 铮,周毅彬,姚 裘,金 露,薛波新
前列腺癌是男性常见的恶性肿瘤之一,其病因、发病机制尚不清楚,前列腺癌的治疗方式主要以手术切除为主,然而对于晚期前列腺癌尚无有效的治疗方式[1]。探讨前列腺癌的病因、发病机制,对治疗前列腺癌靶向药物的研发具有重要的临床意义。长链非编码RNA(long-chain non-coding RNA, lncRNA)是非编码RNA领域的重要组成部分,其核苷酸的长度超过200个,在细胞生命活动中发挥广泛的调节作用[2-3]。近年研究显示,lncRNA参与恶性肿瘤的发生、发展,与肿瘤细胞的恶性生物学行为,如增殖、迁移、侵袭等密切相关[4]。ZBED3-AS1是一种新发现的lncRNA,由582个核苷酸构成。有研究表明,ZBED3-AS1可诱导人滑膜间充质干细胞的软骨形成[5]。然而,ZBED3-AS1在肿瘤特别是前列腺癌细胞中的作用机制尚未见文献报道。本文现对前列腺癌组织及前列腺癌细胞中ZBED3-AS1的表达水平及高表达ZBED3-AS1对前列腺癌细胞增殖、迁移的影响进行分析,探讨ZBED3-AS1是否通过吸附miR-512-5p调控细胞命运决定因子(DACH1)参与前列腺癌的发生、发展。
1 材料与方法
1.1 材料收集2017年9月~2018年12月苏州大学附属第二医院泌尿外科送检的67例前列腺癌手术标本及相应癌旁组织标本,术后标本立即投入液氮罐中冷冻并保持,67例患者年龄(62.16±13.42)岁,所有标本均经病理确诊。患者均签署知情同意书,研究经医院伦理委员会批准;表达ZBED3-AS1的质粒和阴性对照质粒购于上海吉玛公司;人前列腺癌细胞株(LNCap、PC-3、DU-145、C4-2B)及永生化前列腺上皮细胞(RWPE-1)购于上海生命科学院细胞所;WST-1细胞增殖试剂盒和荧光定量PCR试剂盒购自美国Sigma公司;Lipofectamine 2000转染试剂购于美国Invitrogen公司;PCR引物购于上海生工公司;KSFM培养基、RPMI 1640培养基和胎牛血清购于美国Gibco公司;Transwell小室购于美国Corning公司;一抗β-Tubulin、DACH1、Cyclin B、CDK1、Twist2和EDIL-3购于英国Abcam公司。
1.2 方法
1.2.1细胞培养和转染 将购买的前列腺癌细胞株(LNCap、PC-3、DU-145、C4-2B)采用含10%胎牛血清的RPMI 1640培养基培养,将永生化前列腺上皮细胞(RWPE-1)采用含10%胎牛血清的KSFM培养基培养,培养条件为37 ℃、5%CO2饱和湿度。将DU-145细胞传代后,取生长状态良好的第3代细胞,依据随机数字法分为阴性对照组和ZBED3-AS1组,各组细胞铺板在6孔板中,待融合度达40%,采用Lipofectamine 2000参照说明书步骤进行DU-145细胞转染。阴性对照组DU-145细胞转染阴性对照质粒,ZBED3-AS1组DU-145细胞转染表达ZBED3-AS1的质粒。
1.2.2qRT-PCR 采用Trizol法提取总RNA,紫外分光光度计分析RNA的浓度和纯度,逆转录获取cDNA后,采用qRT-PCR扩增目的基因,以GAPDH为内参分析ZBED3-AS1和DACH1 mRNA的表达,以U6为内参分析miR-512-5p的表达,反应条件:95 ℃ 50 s,95 ℃ 15 s、60 ℃ 40 s,合计40个循环。ZBED3-AS1、miR-512-5p和DACH1 mRNA相对表达量以2-ΔΔCt表示。ZBED3-AS1引物序列:上游5′-GCTCCTGCCTATGTCATCCT-3′;下游5′-CTCTCTTC CCGCCCTCTT-3′。GAPDH引物序列:上游5′-TCC CATCACCATCTTCCA-3′,下游5′-CATCACGCCAC AGTTTCC-3′。miR-512-5p引物序列:上游5′-CACT CAGCCTTGAGGGC-3′;下游5′-CAGTGCGTGTCGTG GAGT-3′。DACH1引物序列:上游5′-GGGGCTTGC ATACGGTCTAC-3′;下游5′-CGAACTTGTTCCACA TTGCACA-3′。每组设4个复孔。
1.2.3WST-1法 采用WST-1法检测各组DU-145细胞的增殖能力。收集转染48 h的两组对数生长期DU-145细胞,完全培养基重悬细胞后,接种于96孔板,浓度为每孔4×103个,培养箱中培养。分别于培养第1、2、3、4、5天,在每孔中加WST-1试剂,孵育3 h后使用酶标仪分析两组细胞每孔在波长450 nm处的吸光度(OD)值,绘制细胞生长曲线。每组设4个复孔。
1.2.4Transwell法 采用Transwell法检测细胞迁移能力。收集转染48 h的两组对数生长期细胞,无血清培养液重悬细胞后,调整细胞浓度为每毫升8×104个细胞。将200 μL细胞悬液加至Transwell上室,下室加500 μL完全培养基,培养箱中培养24 h。取出上室,采用4%多聚甲醛固定,棉签擦去上室膜未迁移细胞,结晶紫溶液染色,流水洗涤,晾干后在镜下观察并拍照,计数细胞迁移数。每组设4个复孔。
1.2.5生物信息学 使用生物信息学网站starBase v3.0预测ZBED3-AS1可互补结合的miRNA。使用生物信息学网站miRTarBase预测可互补结合的mRNA。
1.2.6Western blot法 采用Westen blot法检测各组DU-145细胞靶基因的表达。收集转染48 h的两组对数生长期细胞,采用细胞裂解液提取总蛋白。测定蛋白浓度,以50 μg上样量进行SDS-PAGE胶电泳,采用硝酸纤维膜转膜,采用5%脱脂牛奶在室温下封闭,分别与一抗β-Tubulin(稀释比1 ∶1 000)、DACH1(稀释比1 ∶3 000)、Cyclin B(稀释比1 ∶3 000)、CDK1(稀释比1 ∶1 000)、Twist2(稀释比1 ∶1 000)和EDIL-3(稀释比1 ∶2 000)在4 ℃下孵育并过夜;二抗在室温下孵育,均匀滴加ECL发光液,在成像系统显影并观察,比较组间蛋白的表达差异。

2 结果
2.1 前列腺癌组织中ZBED3-AS1的表达qRT-PCR检测结果显示,与癌旁组织相比,ZBED3-AS1在前列腺癌组织中的表达明显降低(4.33±0.88vs0.85±0.26,t=18.79,P<0.01,图1),表明ZBED3-AS1可能参与前列腺癌的发生、发展。

图1 前列腺癌组织和相应癌旁组织中ZBED3-AS1的表达与癌旁组织相比,**P<0.01
2.2 前列腺癌细胞株中ZBED3-AS1的表达qRT-PCR检测显示,与永生化前列腺上皮细胞RWPE-1相比(1.00±0.05),ZBED3-AS1在前列腺癌细胞株LNCap、PC-3、DU-145、C4-2B中表达量明显降低(0.35±0.03、0.80±0.03、0.11±0.03、0.63±0.06)(P均<0.05,图2)。以DU-145细胞下降最为显著(P<0.01),选择DU-145细胞行后续实验。
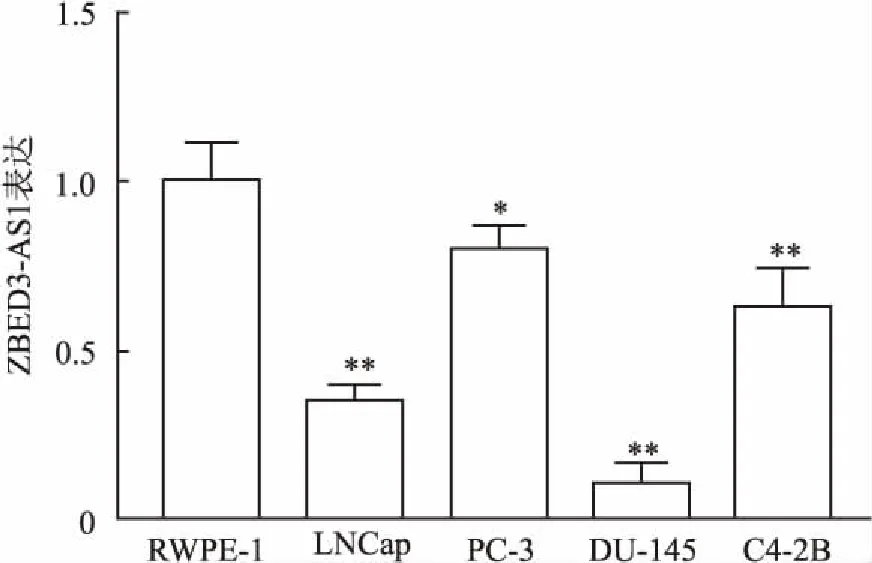
图2 永生化前列腺上皮细胞和前列腺癌细胞中ZBED3-AS1的表达与RWPE-1细胞相比,*P<0.05,**P<0.01
2.3 qRT-PCR检测转染效率与阴性对照组相比,ZBED3-AS1组DU-145细胞中ZBED3-AS1表达明显增加(1.00±0.01vs10.54±1.01,P<0.01),表明转染成功。
2.4 WST-1法检测转染后细胞的增殖能力与阴性对照组相比,转染ZBED3-AS1后在第3天DU-145细胞增殖能力开始下降,表明ZBED3-AS1具有抑制前列腺癌DU-145细胞的增殖能力(P<0.05,图3)。

图3 WST-1法检测ZBED3-AS1组和阴性对照组中DU-145细胞的增殖能力与阴性对照组相比,*P<0.05,**P<0.01
2.5 Transwell法检测转染后细胞的迁移能力与阴性对照组相比,ZBED3-AS1组穿膜明显减少(189.80±23.07vs93.28±13.16,P<0.01),表明前列腺癌细胞迁移能力下降,ZBED3-AS1具有抑制前列腺癌DU-145细胞迁移的作用(图4)。

图4 Transwell法检测ZBED3-AS1组和阴性对照组中DU-145细胞的迁移能力与阴性对照组相比,**P<0.01
2.6 生物信息学预测ZBED3-AS1的靶基因使用生物信息学网站starBase v3.0预测,ZBED3-AS1可互补结合miR-512-5p。使用生物信息学网站miRTarBase预测,miR-512-5p可互补结合DACH1 mRNA(图5)。

图5 生物信息学预测ZBED3-AS1的靶基因
2.7 qRT-PCR检测转染后细胞miR-512-5p和DACH1 mRNA的表达miR-512-5p和DACH1 mRNA的表达与阴性对照组相比,ZBED3-AS1组DU-145细胞中miR-512-5p的表达明显降低(1.00±0.01vs0.23±0.03,P<0.01)。与阴性对照组相比,ZBED3-AS1组DU-145细胞中DACH1 mRNA的表达较阴性对照组明显增加(1.00±0.05vs5.69±0.57,P<0.01)。
2.8 Western blot法检测各组DU-145细胞靶基因的表达Western blot法检测结果显示,与阴性对照组相比,ZBED3-AS1组DACH1蛋白表达明显增加,细胞增殖相关蛋白CDK1和Cyclin B表达明显降低,细胞迁移相关蛋白Twist2和EDIL-3表达明显降低(图6)。

图6 Western blot法检测ZBED3-AS1组和阴性对照组中DU-145细胞靶基因的表达
3 讨论
lncRNA在人类基因组转录产物中占主要部分,可发挥表观遗传调控、基因转录水平及转录后水平调控、剂量补偿效应等作用机制[6-7]。lncRNA在恶性肿瘤发病中的调控作用有助于了解肿瘤的发生、发展机制,lncRNA已成为寻找诊断肿瘤的标志物和治疗靶点的重要方向[8]。近年lncRNA在前列腺癌发生、发展中的作用及机制研究倍受关注。lncRNA如SChLAP1、PART1、NEAT1、ANRIL、MYU等被发现参与调控前列腺癌细胞的生物学功能,与前列腺癌的TNM分期和预后相关,对前列腺癌分子靶向药物的研发具有重要意义[9-13]。ZBED3-AS1是一种新发现的lncRNA,仅在滑膜间充质干细胞中被报道研究,其在肿瘤尤其是前列腺癌中的作用尚不明确。本实验对前列腺癌组织和前列腺癌细胞中ZBED3-AS1水平进行研究,发现前列腺癌组织和前列腺癌细胞中ZBED3-AS1水平降低,表明ZBED3-AS1可能参与前列腺癌的发生、发展。
本实验通过脂质体转染技术将表达ZBED3-AS1的质粒转染DU-145细胞后,ZBED3-AS1的表达呈高表达,细胞增殖和迁移能力被明显抑制,表明高表达ZBED3-AS1可抑制DU-145细胞的增殖和迁移能力。有研究发现,部分lncRNA携带特定miRNA的“种子序列”,发挥“海绵作用”吸附miRNA[14]。miRNA是一类长度为20~25个核苷酸组成的内源性非编码RNA,通过与靶基因mRNA 3′端非编码区结合,导致其降解或者直接抑制其翻译,下调靶基因的表达[15]。lncRNA通过结合miRNA,进而阻止miRNA与靶基因mRNA的结合[16]。本实验使用生物信息学网站starBase v3.0预测,ZBED3-AS1可互补结合miR-512-5p。使用生物信息学网站miRTarBase预测,miR-512-5p可互补结合DACH1 mRNA。qRT-PCR检测表明,高表达ZBED3-AS1后,miR-512-5p表达降低,ZBED3-AS1可能具有吸附miR-512-5p的作用。miR-512-5p表达降低后,DACH1 mRNA的表达增加,表明ZBED3-AS1可能通过吸附miR-512-5p,促进DACH1基因的表达。DACH1基因位于染色体13q22,DACH1参与调控细胞增殖、迁移、分化、黏附等细胞活动,是一种新发现的抑癌基因[17]。DACH1在大多数正常组织中均表达,然而在很多恶性肿瘤如乳腺癌、肺癌、结直肠癌中表达降低或缺失[18-20]。Western blot法检测结果表明,DACH1蛋白表达增加后,细胞增殖相关蛋白CDK1和Cyclin B的表达降低,细胞迁移相关蛋白Twist2和EDIL-3表达明显下降。上述结果表明,ZBED3-AS1可能通过下调miR-512-5p的表达,上调DACH1基因的表达,发挥抑癌作用。本实验下一步将构建ZBED3-AS1慢病毒载体,通过动物实验观察ZBED3-AS1在体内的抑癌作用,进一步探讨ZBED3-AS1作用机制。
综上所述,lncRNA ZBED3-AS1在前列腺癌组织和细胞中表达降低,高表达lncRNA ZBED3-AS1可通过吸附miR-512-5p,促进DACH1的表达,抑制前列腺癌细胞的增殖和迁移能力。lncRNA ZBED3-AS1有望成为前列腺癌诊断标志物和分子治疗靶标。
