环状RNA-circEPSTI1在子宫颈癌生长与侵袭中的作用及机制
2020-05-29丁向东周扬帆王贵明陈艳宇
彭 芳,丁向东,周扬帆,王贵明,陈艳宇
子宫颈癌是女性第三大常见恶性肿瘤,占所有癌症的12%。每年有超过20万女性死于子宫颈癌[1]。在中国,子宫颈癌的发病率约为其他发达国家的6倍,且每年约有13万人死于子宫颈癌[2]。因此,鉴定新的有效预后生物标志物是子宫颈癌研究的重要目标。
环状RNA(circRNAs)是内源性非编码RNA的一类,其结构为共价环状闭合的单链RNA。越来越多的证据表明,circRNA与多种人类疾病相关,如动脉粥样硬化[3]、阿尔茨海默病[4]、糖尿病[5],尤其是肿瘤[6]。大量研究表明,circRNAs在肿瘤进展中起着至关重要的作用,在食管癌中,circ0043898作为肿瘤抑制因子可抑制癌细胞增殖、迁移和侵袭,并能诱导癌细胞凋亡和死亡[7]。在非小细胞肺癌中,circRNAF-circEA-2a作为肿瘤促进因子可促进癌细胞的迁移和侵袭[8]。但大多数circRNAs在子宫颈癌中的功能仍然未知。采用qRT-PCR技术检测子宫颈癌细胞系及组织、正常子宫颈上皮细胞及正常子宫颈组织中circEPSTI1的表达,探讨circRNA-circEPSTI1在子宫颈癌生长与侵袭中的作用及机制,以期为子宫颈癌的治疗提供一定的理论参考。
1 材料与方法
1.1 标本收集2016年4月~2018年9月广东省第二人民医院手术切除的新鲜子宫颈癌组织92例。患者年龄范围31~65岁,中位年龄51.4岁,≤50岁者42例,>50岁者50例;肿瘤组织≤4 cm者38例,>4 cm者54例;FIGO分期:Ⅰ期35例,Ⅱ期30例,Ⅲ期27例;组织学分级:Ⅰ期30例,Ⅱ期37例,Ⅲ期25例;病理类型:鳞癌64例,腺癌28例;有淋巴结转移者69例,无淋巴结转移者23例;HPV阳性59例,HPV阴性33例。60例正常子宫颈组织来源于本院同期因子宫良性病变行全子宫切除术患者,年龄范围32~58岁,中位年龄50.2岁。标本置DEPC水处理后的EP管中,液氮里速冻30 min后转入-80 ℃冰箱保存备用。本实验获广东省第二人民医院卫生委员会伦理委员会批准收集和使用标本组织。
1.2 细胞及组织SiHa和HeLa人子宫颈癌细胞株以及End1/E6E7人正常子宫颈上皮细胞株购于中国科学院细胞库,用10%胎牛血清的RPMI 1640培养液,置37 ℃、5%CO2的细胞培养箱中培养。
1.3 方法
1.3.1qRT-PCR 采用qRT-PCR技术检测circEPSTI1的表达。用RNA抽提试剂盒(RNeasy Mini Kit,Qiagen公司)分别抽提三种细胞株中的总RNA,再经逆转录试剂盒(Biorad公司)合成cDNA于-70 ℃储存备用。冷冻保存的子宫颈癌及正常子宫颈组织标本放入研钵中,加入少量液氮充分研磨标本呈粉末,于研钵中加入0.6 mL Trizol,继续研磨标本成匀浆后,加入Tube管中,采用Trizol法抽提组织中的总RNA,再经逆转录试剂盒合成cDNA存于-70 ℃。具体操作方法依据文献[9]。PCR扩增反应体系包括2x QuantiTect SYBR Green PCRMaster Mix 10 μL,10x miScript Universal Primer 2 μL,10x miScript Primer Assay 2 μL,Template cDNA 1 μg,RNase-free water加至共20 μL。循环体系为:Cycle 1:37 ℃ 15 min,3个循环;Cycle 2:94 ℃ 5 s,55 ℃ 5 s,70 ℃ 5 s,合计40个循环;Cycle 3:4 ℃ 5 s,在CFX96 qRT-PCR系统上检测。以β-actin为内参,所测定的circEPSTI1相对表达量采用2-ΔΔCT法分析。
1.3.2细胞转染与鉴定 si-circEPSTI1、si-NC质粒以及Lipofectamine 2000均购于美国Invitrogen公司,CCK-8粉购于美国Sigma公司。常规培养SiHa和HeLa细胞至90%汇合度后收集细胞,制成每毫升1×105个细胞的悬液,按每孔2 mL铺至6孔板内,放置于37 ℃、5%CO2的细胞培养箱中培养,待细胞汇合度达50%时用于细胞转染。将si-circEPSTI1与si-NC转染质粒按转染说明分别转染于SiHa和HeLa细胞中。置于37 ℃、5%CO2培养箱中继续培养48 h后收集细胞。细胞分为si-circEPSTI1组与si-NC组,其中si-NC组为si-circEPSTI1组的对照组,采用qRT-PCR验证转染效率。
1.3.3CCK-8 分别取上述两组转染后的SiHa和HeLa细胞悬液100 μL(约1×103细胞)接种到96孔板中,设复孔6个;细胞接种后培养,在监测点时(第1、2、3、4、5天),向每孔中加入10 μL CCK-8溶液,轻轻敲击培养板混匀,避免气泡产生影响OD值的读数;37 ℃孵育2 h,使用Bio-Tek EPOCH2测量450 nm的OD值;重复实验3次。
1.3.4裸鼠皮下成瘤实验 4周龄雌性BALB/c裸鼠(上海斯莱克实验动物有限公司),6只,质量(20±2) g。随机分为si-circEPSTI1组和si-NC组,每组3只。取HeLa细胞悬液1 mL(约5×107细胞)接种于裸鼠一侧腋部皮下,每组3只裸鼠;记录观察裸鼠的一般情况、移植瘤形成的时间及大小;si-circEPSTI1组以40 μL si-circEPSTI1进行瘤内原位多点注射,si-NC组以40 μL si-NC进行瘤内原位多点注射,每4天1次;实验结束后,将肿瘤完整剥离并进行大体照相,测量肿瘤体积及重量。所有动物实验部分遵循标准动物护理和实验室指南并获得广东省第二人民医院伦理批准。
1.3.5Transwell侵袭实验 在Transwell小室(美国Invitrogen公司)中铺加8 μL稀释好的基质胶,过夜形成基质膜。在Transwell小室上层分别接种转染si-circEPSTI1或si-NC转染质粒的SiHa或HeLa细胞悬液,细胞悬液浓度为每毫升1×105个细胞,接种量100 μL。下腔加500 μL含20%FBS的培养液。置37 ℃温箱中孵育36 h,取出,用棉签擦弃小室上层未迁移的细胞,PBS液轻洗,4%多聚甲醛固定、结晶祡染色下层穿出细胞,PBS液洗,倒置,晾干。光镜下观察拍照,随机选取4个高倍视野进行细胞计数,取平均值,实验重复3次。
1.3.6Western blot法 采用Western blot法检测circEPSTI1对EPSTI1、Twist、Slug蛋白的表达。HeLa细胞转染后继续培养48 h,收获细胞。RIPA裂解细胞并提取细胞总蛋白,用BCA法测定细胞的蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加入EPSTI1、Twist、Slug抗体或β-actin抗体(美国Santa Cruz公司),4 ℃过夜,TBST洗膜,加二抗孵育1 h,洗膜,ECL发光,X片曝光、显影、定影,扫描图片,并计算结果。

2 结果
2.1 人子宫颈癌细胞及组织中circEPSTI1的表达qRT-PCR检测结果显示,人子宫颈癌细胞株SiHa和HeLa细胞中circEPSTI1的表达水平分别为1.726±0.046、1.589±0.039,与正常子宫颈上皮细胞株End1/E6E7细胞的表达水平(0.638±0.058)相比,差异有统计学意义(P<0.01)(图1A)。子宫颈癌组织中circEPSTI1的表达水平为1.718±0.036,与正常子宫颈组织中的表达水平(0.613±0.023)相比,差异有统计学意义(P<0.01)(图1B)。

图1 qRT-PCR检测circEPSTI1在人子宫颈癌SiHa细胞、HeLa细胞、正常子宫颈上皮细胞End1/E6E7和子宫颈癌组织、正常子宫颈组织中的表达
与正常子宫颈上皮细胞和正常子宫颈组织相比,**P<0.01
2.2 子宫颈癌组织中circEPSTI1的表达与临床病理特征的关系circEPSTI1的表达水平与FIGO分期、组织学分级和淋巴结转移有关,在FIGO分期为I期的患者中的表达明显低于FIGO分期为Ⅱ~Ⅲ期的患者,差异有统计学意义(P=0.025);在组织学分级为I期的患者中circEPSTI1的表达明显低于组织学分级为Ⅱ+Ⅲ期的患者,差异有统计学意义(P=0.002);在有淋巴结转移的组织中circEPSTI1的表达明显高于无淋巴结转移的组织,差异有统计学意义(P=0.038);circEPSTI1的表达与患者年龄(50岁分界)、肿瘤大小、病理类型、HPV感染无关(P>0.05,表1)。
2.3 敲减circRNA-circEPSTI1对子宫颈癌细胞生物学性状的影响为进一步评估circEPSTI1在子宫颈癌细胞中所发挥的生物学功能,通过转染si-circEPSTI1的方式敲减子宫颈癌细胞系(SiHa和HeLa细胞)中circEPSTI1的表达。qRT-PCR实验发现,在转染si-circEPSTI1后,子宫颈癌细胞系(SiHa和HeLa细胞)中circEPSTI1的表达水平均显著下调(P<0.01)(图2)。
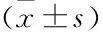
表1 子宫颈癌中circEPSTI1的表达与临床病理特征的关系
*P<0.05
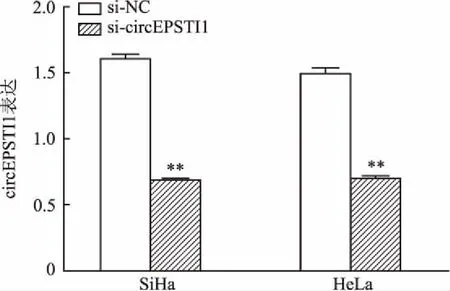
图2 qRT-PCR检测转染si-circEPSTI1后SiHa和HeLa细胞中circEPSTI1的表达与si-NC组相比,**P<0.01
为探讨circEPSTI1在体外对子宫颈癌细胞的增殖作用,采用CCK-8细胞增殖实验进行检测,结果显示,在子宫颈癌细胞系(SiHa和HeLa细胞)中,与si-NC组相比,si-circEPSTI1组细胞在450 nm处的OD值明显降低,差异有统计学意义(P<0.01)(图3)。提示通过抑制circEPSTI1的表达水平,能够显著抑制子宫颈癌细胞系的增殖。

图3 CCK-8法检测si-circEPSTI1对SiHa(A)和HeLa(B)细胞增殖能力的影响与si-NC组相比,**P<0.01
为了探讨circEPSTI1在体内对子宫颈癌细胞的生长作用,进行了裸鼠成瘤实验。在皮下注射裸鼠成瘤实验中,通过连续28天的观察发现,si-circEPSTI1组的裸鼠肿瘤质量明显低于si-NC组(P<0.05)(图4)。此结果表明,敲低circEPSTI1表达水平,在体内能够显著抑制子宫颈癌细胞的生长。
为进一步检测circEPSTI1在体外对子宫颈癌细胞侵袭能力的影响,采用Transwell侵袭实验检测,结果显示在子宫颈癌细胞系(SiHa和HeLa细胞)中,与si-NC组相比,si-circEPSTI1组的子宫颈癌细胞穿过基质膜的数目明显减少(P<0.01)(图5)。提示敲低circEPSTI1表达水平,能够抑制子宫颈癌细胞的侵袭能力。
2.4 Western blot法检测si-circEPSTI1对EPSTI1、Twist、Slug蛋白表达的影响Western blot法检测结果显示,在子宫颈癌HeLa细胞中,si-circEPSTI1组EPSTI1、Twist、Slug蛋白表达水平明显低于si-NC组(图6),差异有统计学意义(P<0.01)。提示敲低circEPSTI1表达水平能显著抑制EPSTI1、Twist、Slug的表达。

图4 裸鼠移植瘤实验检测si-circEPSTI1对肿瘤生长的影响与si-NC组相比,*P<0.05

图5 Transwell侵袭实验检测si-circEPSTI1对SiHa和HeLa细胞侵袭能力的影响

图6 Western blot法检测si-circEPSTI1对EPSTI1、Twist、Slug蛋白表达的影响
3 讨论
circRNA具有丰富的跨物种保守特征,在唾液、血液和外泌体中稳定表达,且具有组织/发育阶段特异性,满足有希望的癌症生物标志物的要求。此外,因circRNA数量相对较少,故比miRNA更容易被检测到。越来越多的研究报道,circRNAs参与肿瘤的进展。在胃癌中circ_002059表达下调,并与远处转移、TNM分期相关[10]。circ_100855在喉鳞状细胞癌组织中显著上调和circ_104912显著下调,并且两者的表达与肿瘤分期和颈部淋巴结转移显著相关,提示circ_100855与circ_104912是喉鳞状细胞癌潜在的新的生物标志物[11]。Yao等[12]发现非小细胞肺癌中circRNA_100876上调,且其上调与淋巴结转移、肿瘤分期及预后密切相关,提示circRNA_100876可能作为非小细胞肺癌预后判断的分子标志物和治疗新靶点。circBRAF在高级别(Ⅲ和Ⅳ)胶质瘤中的表达显著低于低级别(I和II),circBRAF可能是胶质瘤患者病理分级和预后的预测生物标志物[13]。circRNA_000479来自于EPSTI1基因,位于染色体13q14上,因此将circRNA_000479命名为“circEPSTI1”。研究发现circEPSTI1在骨肉瘤、卵巢癌及三阴型乳腺癌中的表达均增高[9,14-15],circEPSTI1的表达增高与三阴型乳腺癌的肿瘤大小、淋巴结转移以及TNM分期呈正相关,并且亦与患者总生存期和无瘤生存期相关[9]。目前,只有少数报道有关子宫颈癌circRNAs的研究。本实验发现circEPSTI1在子宫颈癌细胞与组织中高表达,并且circEPSTI1的表达水平与FIGO分期、肿瘤分级以及淋巴结转移明显相关,与上述研究相符。提示circEPSTI1在子宫颈癌的发生、发展过程中可能发挥重要的功能。
研究报道,circRNA以miRNA海绵或竞争性内源性RNAs(ceRNAs)的形式调节基因表达。研究显示,不同的circRNA在肿瘤中功能各异。有些充当肿瘤抑制因子,而有些充当肿瘤促进因子样作用。如在非小细胞肺癌中,hsa_circ_0033155可作为肿瘤抑制因子调节细胞增殖、集落形成和迁移[16]。在膀胱癌中,过表达circTCF25通过circTCF25-miR-103a-3p/CDK6途径促进肿瘤细胞增殖和迁移[17]。在三阴型乳腺癌中,circEPSTI1通过吸附miR-4753和miR-6809调节BCL11A表达,从而影响细胞的增殖和凋亡[9]。在骨肉瘤中,circEPSTI1通过miR-892b-MCL1轴调节肿瘤细胞的增殖与迁移[14]。本实验结果显示,在子宫颈癌细胞中减少circEPSTI1表达,抑制体外培养癌细胞的增殖和侵袭,同时抑制异种移植瘤的生长,提示circEPSTI1可能促进子宫颈癌的进展。EPSTI1是定位于13q13.3染色体的干扰素应答基因,研究发现EPSTI1在浸润性乳腺癌中高度表达并参与乳腺癌细胞的增殖、侵袭和凋亡[18]。研究还发现,EPSTI1可以调节肿瘤细胞的上皮-间质转化[19]。EPSTI1的表达对上皮-间质转化有促进作用[18]。因此,EPSTI1是一个重要的上皮-间质转化调节因子。本实验在敲减circEPSTI1表达后,发现子宫颈癌细胞中的EPSTI1、Twist、Slug蛋白表达水平均明显下调,提示circEPSTI1促进子宫颈癌中细胞的生长与侵袭可能是通过调控EPSTI1、Twist、Slug信号通路而实现的。
综上所述,circEPSTI1在子宫颈癌细胞系与组织中高表达并与子宫颈癌的高级别FIGO分期、高组织学以及淋巴结转移密切相关。敲减circEPSTI1表达,能够抑制子宫颈癌细胞生长与侵袭,其机制可能与调控EPSTI1、Twist、Slug信号通路有关。因此,circEPSTI1可能有望成为子宫颈癌潜在的生物标志物和治疗靶点。