铜绿假单胞菌群体感应相关sRNA的筛选及突变株的构建
2020-05-29李虹霖刘宇阳张社彬蔡依玫曾建明
李虹霖,鲁 洋,刘宇阳,张社彬,蔡依玫,曾建明,黄 彬, 陈 茶
0 引 言
铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa)是造成人类感染的机会性病原体,包括受伤、严重烧伤患者的急性感染,以及囊性纤维化患者的慢性肺部感染等[1-2]。P.aeruginosa的致病性主要与大量的细胞内和细胞外毒力因子相关,其中许多毒力因子会受酰基高丝氨酸内酯(acylated homoserine lactones,AHL)的las和rhl群体感应系统调节[3]。调控小RNA (small regulatory RNA,sRNA)是细菌中基因表达的中心调节因子,通过与其靶mRNA的有限碱基互补配对在转录后控制靶mRNA,因此对转录物稳定性和(或)翻译产生负面或正面影响,发挥多种生物学功能[4-5]。研究发现,sRNA能够调节多种蛋白编码基因,这些蛋白参与许多细胞过程和发病机制,包括生物膜形成、耐药性、毒力以及群体感应系统等[6-7]。基于此,sRNA可作为新型抗菌靶点。然而,目前针对P.aeruginosa相关sRNA的研究主要为通过生物信息学模型预测其存在和可能的靶点,停留在新sRNA鉴定方面,仅有少部分sRNA的功能被阐明。本研究利用基因转录组测序及qPCR技术,筛选出5条群体感应系统相关sRNA,并通过无缝克隆与同源重组的方式成功构建了相关sRNA的过表达与敲除株。
1 材料与方法
1.1 菌株和质粒铜绿假单胞菌野生株PAO1(重庆医科大学附属儿童医院),PAO1-ΔlasI株和PAO1-ΔrhlI株(实验室保存);大肠埃希氏菌E. coliSM10λπ(中国疾病预防控制中心),E. coliDH5α(实验室保存);过表达质粒pROp200(GmR,中国科学院武汉病毒研究所);自杀性质粒pGSM-MR(GmR,实验室构建)。
1.2 培养基Luria-Bertani(LB)培养基:1%胰蛋白胨、0.5%酵母提取物、0.5%NaCl;10%蔗糖培养基:1%胰蛋白胨、0.5%酵母提取物、10%蔗糖;若为固体培养基,则添加1.5%琼脂糖;若含抗生素,则添加相应浓度抗生素:氨苄西林(AMP, 100 μg/mL),庆大霉素(Gm, 30 μg/mL),氯霉素(Cm,16 μg/mL)。
1.3 主要试剂与仪器培养基成分购自英国Oxoid公司;细菌总RNA提取试剂盒购自广州东盛生物科技有限公司;EcoRI、SacI、XbaI限制性核酸内切酶、DNA聚合酶、质粒提取试剂盒、DNA凝胶回收试剂盒、PrimeScript RT试剂盒、荧光染料SYBR Premix Ex TaqⅡ等购自大连TaKaRa公司;无缝连接试剂盒购自BBI公司;抗生素AMP和Gm购自生工生物工程(上海)股份有限公司;其余化学试剂均购自广州化学试剂厂;恒温培养箱(SHEL-LAB2300)、温控摇床(Thermo)、冷冻高速离心机(Eppendorf)、PCR仪(Applied Biosystems)、凝胶图像成像仪(Bio-Rad)、超微量紫外/可见光分光光度计(Thermo/NanoDrop2000C)、ABI ViiATM7 实时荧光定量PCR 仪、Tecan Infinite M1000 PRO多功能酶标仪(Tecan)。实验引物的合成与目的基因测序均由生工生物工程(上海)股份有限公司完成,实验所用全部引物序列见表1。
表1 引物序列
Table 1 Sequences of RNA and DNA oligonucleotides

引物名称引物序列(5'→3')目的过表达引物 In200-AmiL-FATCGGCTCGTATAATGAATTCATCAGGTCGTGCGCATCA In200-AmiL-RCGAATTTTAACAAAAGAATTCGGATATCACCTCTTGTTGTTpROp200-AmiL In200-P30-FATCGGCTCGTATAATGAATTCAAGCTACTGGGGGAGCCGAA In200-P30-RCGAATTTTAACAAAAGAATTCAACTGCCTTGAGGCAGCGCApROp200-P30 In200-P34-FATCGGCTCGTATAATGAATTCGCCGACGACCGAACCCAAC In200-P34-RCGAATTTTAACAAAAGAATTCGGAAAAGGCCACGGGCGACpROp200-P34敲除引物 AmiL-P1ACGGCCAGTGAATTCGAGCTCAAAGCGCCAGTTTGTAGCAG AmiL-P2CATGGATATCACCTCCTTATAAGCCCCGTCGGAAGAmiL侧翼片段A AmiL-P3GACGGGGCTTATAAGGAGGTGATATCCATGCGTCA AmiL-P4GGCTGGATCCCAAGCTCTAGATCCTTCTCCAGTCCCTCGTAAmiL侧翼片段B AmiL-M1CGGCATCTTGTAGTTGACCA AmiL-M2CAGACCGACAGGAGGAAGAGAmiL敲除验证 P30-P1ACGGCCAGTGAATTCGAGCTCCACCGGGTCTTCCAGATAAC P30-P2TCGGAAGAAGAATAAGTTTTCCCCGTTTTTCCTTCP30侧翼片段A P30-P3AAAAACGGGGAAAACTTATTCTTCTTCCGACTGGC P30-P4GGCTGGATCCCAAGCTCTAGACTGATCGAATCCGAGCTGTTP30侧翼片段B P30-M1GCACGGCATCTGCTTATGTA P30-M2TCTAGCATTGGATGGGGAAAP30敲除验证 P34-P1ACGGCCAGTGAATTCGAGCTCAATCGTCAACCTGCAACTCC P34-P2CGAACCCAACACCTTCATGGGCTTCAGATAATGCP34侧翼片段A P34-P3TCTGAAGCCCATGAAGGTGTTGGGTTCGGTCGT P34-P4GGCTGGATCCCAAGCTCTAGAAAGGCTGACGAACGGTAGAAP34侧翼片段B P34-M1ACCCGGAAACCAATCCCCTGG P34-M2GCCGCTTCGGTCTTGTTGCCqPCR引物 RT-rpoD-FCTGAAGATCGCCAAAGAGCC RT-rpoD-RGTGTGGTCGGTGTTCATGTCqPCR RT-AmiL-FGCATCAGCGTCGATGT RT-AmiL-RAGCCCATTTGCTCTGTqPCR RT-P30-FCGGGCTTGTTGTTTTTGTTT RT-P30-RCATCAGCGACCAAAGCAATqPCR RT-P34-FGACCAGACTCAGGGACAA RT-P34-RTACGACCGCCTCTACTTqPCR RT-P26-FGACCTTGCGTCTACAGCC RT-P26-RAAGCCACCAGCCATCAqPCR RT-P5316.1-FGCCTCAGCCCTCTATAA RT-P5316.1-RAAGCAGCCAACCCATGqPCR RT-P15-FCGTGCCGCGTATTTCTTC RT-P15-RAGGGTAGGCGTCCCGTATqPCR RT-P34-FGACCAGACTCAGGGACAA RT-P34-RTACGACCGCCTCTACTTqPCR
下划线代表限制性酶切位点,下划线之前序列代表引物与载体的同源序列
1.4 方法
1.4.1 菌液准备挑取各菌株的单克隆菌落于含或不含抗生素(根据是否有抗性质粒确定)的3 mL LB中,37 ℃过夜摇菌;收集1 mL菌液于EP管中,使用等渗盐水洗涤2次,并使用等量新鲜LB重悬菌液;将过夜菌液接种于新鲜LB中,37 ℃,200 r/min,摇至对数生长期备用。
1.4.2 qPCR使用PrimeScript RT试剂盒对1 μg RNA进行逆转录。使用SYBR Premix Ex TaqⅡ,在ABI ViiATM7 实时荧光定量PCR仪上对cDNA进行qPCR。使用相对定量法(2-ΔΔCt)计算sRNA基因相对表达量,以rpoD作为内参。进行qPCR时,反应体系:SYBR Premix Ex TaqⅡ (2×) 10 μL,ROX Reference Dye(50×)0.4 μL,上下游引物各0.4 μL,模板2 μL,ddH2O 6.8 μL;上机反应条件:第一步,预变性95 ℃ 30 s;第二步,变性95 ℃ 5 s,退火60 ℃ 34 s,共40个循环;第三步, 95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.4.3 PCR使用普通PCR扩增过表达载体的目的片段及A、B同源片段,反应体系:PrimeSTAR Max Premix(2×) 25 μL,上下游引物各1.5 μL,模板3 μL,ddH2O 19 μL;反应条件:预变性98 ℃ 5 min,变性98 ℃ 10 s、退火55 ℃ 15 s、延伸72 ℃ 40 s,共35个循环,再延伸72 ℃ 5 min。融合PCR连接A、B同源片段:①第一次PCR,反应体系为PrimeSTAR Max Premix(2×) 25 μL,A和B片段按1∶1的摩尔比混合,添加ddH2O至50 μL;反应条件为预变性95 ℃ 5 min,变性 94 ℃ 20 s、退火60 ℃ 20 s、延伸72 ℃ 40 s,12个循环,再延伸 72 ℃ 5 min;②第二次PCR,以第一次PCR产物为模板,添加引物sRNA-P1、sRNA-P4各2 μL,重复第一步PCR反应。
1.5 群体感应系统相关sRNA的筛选分别吸取处于对数生长期的PAO1、PAO1ΔlasI、PAO1ΔrhlI菌液100 μL至4 mL LB,200 r/min,PAO1株分别于2、4、6 h收菌,PAO1ΔlasI、PAO1ΔrhlI株于6 h收菌,使用细菌总RNA提取试剂盒提取RNA,将提取好的RNA置于-80 ℃备用。操作重复3次,将提取的RNA送广州瑞科基因科技有限公司进行转录组测序分析。根据转录组测序结果,利用qPCR验证,重复3次。
1.6 突变株的构建
1.6.1 pROp200-sRNA及pGSM-ΔsRNA载体构建以野生株PAO1菌液为模板扩增目的片段。分别以EcoRI、SacI/XbaI对pROp200、pGSM-MR进行单酶切和双酶切,反应条件为37 ℃,2 h。PCR扩增及酶切后的目的基因、载体经琼脂糖凝胶电泳,并使用DNA凝胶回收试剂盒进行回收。使用无缝连接试剂盒将线性化载体与目的片段按照1∶10摩尔比进行连接,50 ℃,2 h。分别将pROp200-sRNA和pGSM-ΔsRNA的连接反应液转化入E. coliDH5α和SM10λπ感受态细胞中,置冰上孵育30 min;42 ℃热激90 s后快速放入冰上5 min;加入800 μL LB液体培养基,37 ℃ 200 r/mim孵育2 h;12 000 r/min离心1 min收集菌体,并分别将含pROp200-sRNA和pGSM-ΔsRNA的菌体均匀的涂布在含Gm和含Gm+AMP抗生素的LB平板上,37 ℃培养16 h。挑取平板上的3个转化子于1 mL LB液体培养基中增菌,以此作为模板进行PCR验证(pROp200-sRNA验证引物同目的基因扩增引物,pGSM-ΔsRNA验证引物为sRNA-M1、sRNA-M2)。将PCR阳性的菌液再次增菌12 h,以提取质粒送测序鉴定。最终将测序结果正确的过表达质粒pROp200-sRNA转化入PAO1野生株感受态细胞,获得PAO1-sRNA过表达株。
1.6.2 sRNA基因敲除株的构建将SM10λπ(pGSM-ΔsRNA)与PAO1在0.45 μmol/L微孔滤膜上进行接合,使用含AMP、Gm和Cm抗生素的LB平板筛选含pGSM-ΔsRNA质粒的PAO1[8]。挑单克隆接合子接种于10%蔗糖固体培养基,37 ℃孵育16 h,以发生第2次同源重组去除筛选标记。挑取对蔗糖耐药的菌落进行PCR,引物为sRNA-M1、sRNA-M2。PCR扩增产物送测序进行鉴定。
1.7 sRNA基因过表达株及敲除株验证对处于对数生长期的PAO1野生株、PAO1-sRNA过表达株、PAO1ΔsRNA敲除株及PAO1ΔsRNA/sRNA过表达株提取RNA,逆转录,以rpoD作为内参,进行qPCR检测sRNA基因相对表达量。实验重复3次。
1.8 生长曲线绘制分别将过夜菌液浓度调节至A600为0.07左右。分装200 μL培养液至96孔板,37 ℃孵育14 h,每2 h检测A600。以测定时间为横轴,菌液A值为纵轴,绘制菌株生长曲线。实验重复3次。
1.9 绿脓素检测各挑取平板上单克隆菌落于含3 mL相应的LB培养基中,37 ℃,120 r/min,12 h。将60 μL过夜菌液转移至6 mL相应LB培养基中,37 ℃,200 r/min,摇24 h。取200 μL菌液至96孔板,检测A600。将菌液收至离心管中,离心半径10 cm,2300 r/min,10 min,取5 mL上清液加入3 mL氯仿抽提,离心半径10 cm,2300 r/min,5min。将氯仿层转移到干净离心管中并加入1 mL 0.2NHCL,生成粉红到深红色的溶液,离心半径10 cm,2300 r/min,5 min,取200 μL上层至96孔板,检测A520。每毫升培养上清液产生的绿脓菌素毫克等于消光系数乘以17.072(A520/A600×17.072)[9]。

2 结 果
2.1 QS系统相关sRNA的筛选测序结果显示,与群体感应系统激活过程呈负相关的sRNA为P26、P5316.1、P15、P34、AmiL;与群体感应系统激活过程呈正相关的sRNA为P30。qPCR验证显示,与培养2 h比较,lasI、rhlI 培养4 h基因相对表达量明显升高(P<0.05);P5316.1、P34培养4 h及6 h明显降低(P<0.05)、P30、AmiL培养4 h及6 h明显升高(P<0.05)。P5316.1、P34培养 6 h较4 h明显降低(P<0.05),见表2。敲除lasI、rhlI后,ΔlasI、ΔrhlI菌株的lasI、rhlI、P26、P5316.1、P30、AmiL与PAO1菌株比较差异有统计学意义(P<0.05),见表3。综合转录组测序及qPCR结果,成功筛选出5条与群体感应系统相关的sRNA为 P26、P5316.1、P30、P34、AmiL。选择与群体感应系统相关性较明显的3条sRNA AmiL、P30及P34进行过表达及敲除株的构建。
表2 QS系统激活过程的基因相对表达量(2-ΔΔCt)
Table 2 Relative expression of genes during the activation of QS system(2-ΔΔCt)
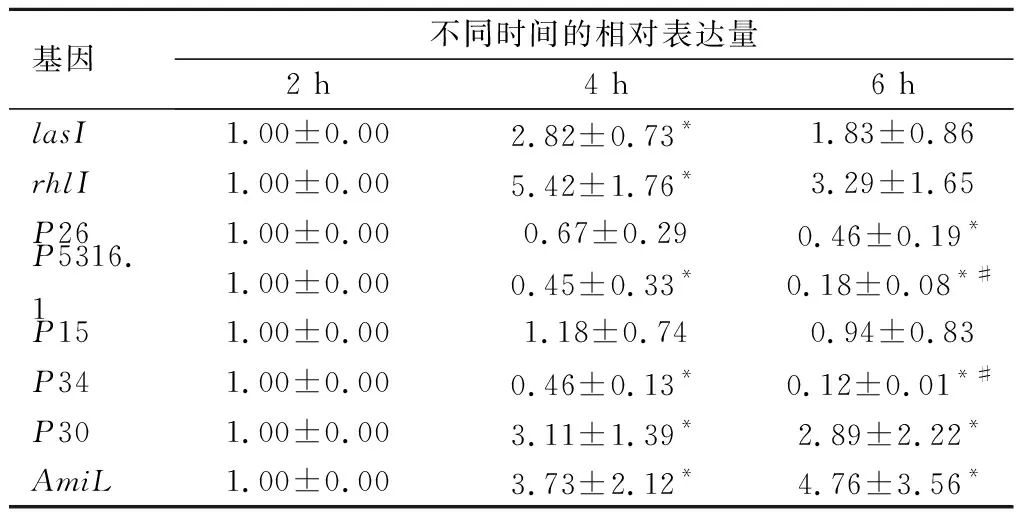
基因不同时间的相对表达量2 h4 h6 hlasI1.00±0.002.82±0.73*1.83±0.86rhlI1.00±0.005.42±1.76*3.29±1.65P261.00±0.000.67±0.290.46±0.19*P5316.11.00±0.000.45±0.33*0.18±0.08*#P151.00±0.001.18±0.740.94±0.83P341.00±0.000.46±0.13*0.12±0.01*#P301.00±0.003.11±1.39*2.89±2.22*AmiL1.00±0.003.73±2.12*4.76±3.56*
与同一基因2 h比较,*P<0.05;与4 h比较,#P<0.05
表3 群体感应系统敲除lasI、rhlI后各菌株的基因相对表达量比较(2-ΔΔCt)
Table 3 Relative expression of genes after QS system knockout(2-ΔΔCt)

基因敲除不同菌株后的基因相对表达量PAO1ΔlasIΔrhlIlasI1.00±0.000.00±0.00*2.379±0.61*rhlI1.00±0.000.14±0.07*0.00±0.00*P261.00±0.001.632±0.31*1.65±0.11*P5316.11.00±0.001.91±0.55*2.18±0.82*P151.00±0.001.13±0.181.11±0.32P341.00±0.001.26±0.041.00±0.25P301.00±0.003.58±0.74*3.82±0.83*AmiL1.00±0.002.31±0.64*2.5±0.52*
与PAO1比较,*P<0.05
2.2 突变株的构建
2.2.1 目的基因扩增过表达载体目的片段AmiL、P30、P34经PCR后,分别得到长度为176 bp、264 bp、508 bp的产物,这与预测基因长度(分别为176 bp、264 bp、508 bp)一致,见图1a。成功通过融合PCR形成缺乏sRNA的AB目的片段,见图1b。

M:DNA Maker2000;1、2:AmiL;3、4:P30;5、6:P34
a:PCR扩增sRNA过表达; b:融合PCR扩增缺乏sRNA
图 1 目的基因的PCR
Figure 1 PCR amplification of sRNA overexpression gene
2.2.2 pROp200-sRNA及pGSM-ΔsRNA载体的构建pROp200经过EcoRI酶切后,质粒由超螺旋结构变为线性结构,pGSM-MR经SacI、XbaI双酶切后,产生长度分别为1898bp和7509bp的片段,见图2。同源重组质粒pGSM-ΔsRNA的PCR产物长度比以PAO1作为模板的PCR产物短。鉴定结果显示,6号样本无扩增产物,而其余重组质粒pGSM-ΔsRNA的PCR结果均与预期一致,即pGSM-ΔAmiL(256bp)、pGSM-ΔP30(230bp)、pGSM-ΔP34(252bp),见图3。以上结果说明过表达质粒及同源重组质粒均构建成功。
2.3 qPCR检测sRNA基因表达情况qPCR检测结果显示,与PAO1野生株比较,相应PAO1-sRNA过表达株的sRNA基因表达量均较PAO1野生株显著上调(P<0.05);相应PAO1ΔsRNA敲除株的sRNA基因表达量均较PAO1野生株明显降低(P<0.05);PAO1ΔsRNA/sRNA过表达株的sRNA基因表达量均较PAO1ΔsRNA敲除株明显升高(P<0.05)。见表4。以上结果说明PAO1-sRNA过表达株以及敲除株构建成功。
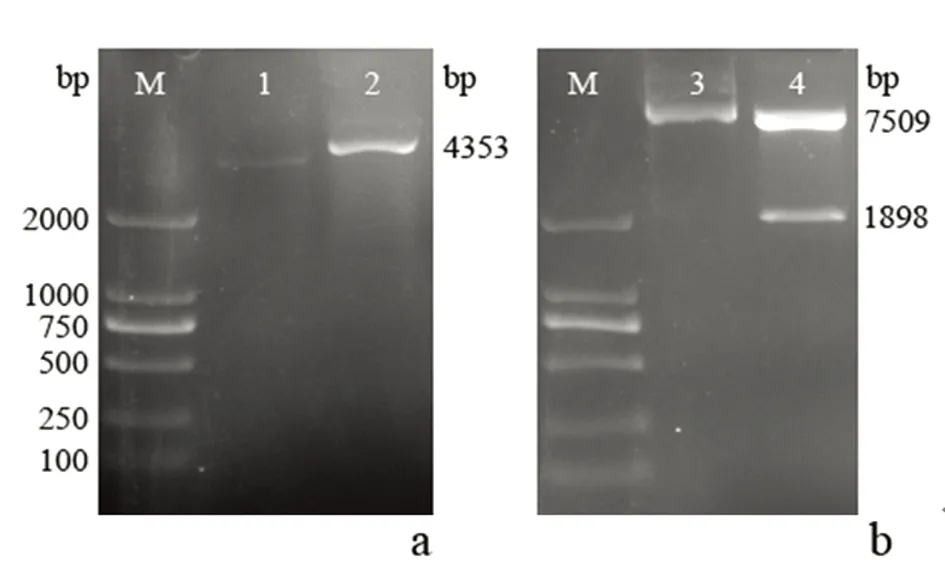
M:DNA Maker2000;1、3:酶切前;2:EcoRI单酶切后;4:SacI、XbaI双酶切后
a:pROp200质粒;b:pGSM-MR质粒
图 2 pROp200与pGSM-MR质粒酶切
Figure 2 Enzymes restriction of pROp200 and pGSM-MR plasmids

M: DNA Maker2000; 1:AmiL;2-4:pGSM-ΔAmiL;5:P30;6-8:pGSM-ΔP30;9:P34;10-12:pGSM-ΔP34
图 3 PCR筛选pGSM-ΔsRNA重组质粒
Figure 3 PCR identification of the pGSM-ΔsRNA recombinant plasmid
表4 qPCR检测PAO1菌株sRNA基因相对表达量(2-ΔΔCt)
Table 4 The relative expression level of sRNA gene was detected by qPCR(2-ΔΔCt)

菌株不同菌株的基因相对表达量AmiLP30P34PAO1野生株1.00±0.001.00±0.001.00±0.00PAO1-sRNA过表达株21.53±3.68*2.53±0.33*1036±352.7*PAO1ΔsRNA敲除株0.01±0.01*0±0*0.01±0.01*PAO1ΔsRNA/sRNA过表达株46.95±12.12#24.00±5.57#967.8±68.95#
与PAO1野生株比较,*P<0.05;与PAO1ΔsRNA敲除株比较,#P<0.05
2.4 生长曲线测定结果显示PAO1野生株、PAO1-sRNA过表达株以及PAO1ΔsRNA敲除株的生长差异无统计学意义(P>0.05),见图4。
2.5 绿脓素检测PAO1-sRNA过表达株AmiL绿脓素浓度低于PAO1野生株(P<0.05);PAO1ΔsRNA/sRNA过表达株AmiL绿脓素浓度较PAO1ΔsRNA敲除株降低(P<0.05),P30绿脓素浓度较PAO1ΔsRNA敲除株升高(P<0.05)。见表5。

图4 各菌株生长曲线测定
Figure 4 Determination of growth curves of the strains



菌株sRNAAmiLP30P34PAO1野生株2.83±0.092.83±0.092.83±0.09PAO1-sRNA过表达株1.73±0.03*2.67±0.132.86±0.21PAO1ΔsRNA敲除株2.83±0.200.75±0.05*2.65±0.23PAO1ΔsRNA/sRNA过表达株1.52±0.07*#2.88±0.42#2.72±0.13
与PAO1野生株比较,*P<0.05;与PAO1ΔsRNA敲除株比较,#P<0.05
3 讨 论
细菌通过群体感应系统可以调控P.aeruginosa的运动、毒力产生、生物被膜形成及抗生素耐药等多种生理过程。细菌sRNA是一类长度在50~500nt的调控小RNA,类似于真核生物中的长链非编码RNA (long non-coding RNA, lncRNA)和microRNAs(miRNAs)[10-11],基本不编码蛋白。其主要作用方式是通过碱基互补配对与靶基因或靶标蛋白质结合,影响mRNA的稳定,从而参与基因的转录后表达调控,发挥多种生物学功能[12-14]。例如,在致病菌的新陈代谢、脂多糖修饰、生物膜形成、外膜蛋白合成、毒力产生、耐药性和群体感应等多个方面发挥重要调控作用[15-18]。为探讨群体感应系统是否通过调控sRNA从而发挥多种生物学功能,本研究利用基因转录组测序技术筛选出5条群体感应系统相关sRNA。为进一步明确筛选出的其中3条sRNA的功能,本研究使用无缝克隆与同源重组技术成功构建了AmiL、P30和P34过表达与敲除株。
由于群体感应系统具有细胞密度依耐性[19],为系统筛选群体感应相关sRNA,本研究采用2种模型进行转录组测序,即群体感应激活过程中表达变化的sRNA:PAO1-2h、PAO1-4h、PAO1-6h,群体感应相关基因lasI或rhlI敲除后表达变化的sRNA:PAO1-6h、PAO1ΔlasI-6h、PAO1ΔrhlI-6h。同时结合qPCR验证,初步筛选出与群体感应系统呈负相关的P26和P5316.1,它们可能受群体感应系统调控或调控群体感应系统;正调控群体感应系统并受群体感应系统负反馈的AmiL和P30;而P34在群体感应激活过程中与群体感应系统呈负相关,但lasI或rhlI敲除后P34表达变化不明显,说明P34可能是一种调控群体感应系统的sRNA,而不受群体感应系统调控,但具体机制还需进一步探索。
对于pROp200-sRNA过表达载体及同源重组载体pGSM-ΔsRNA的构建,本研究使用新型、快速、简单的无缝克隆技术。对于PAO1 sRNA基因的敲除,本研究采用不引入外源基因,且目的基因能被彻底敲除的同源重组技术[20]。值得一提的是,当在野生株中过表达P30时,基因表达量升高倍数不高,出现这种结果是因为P30在PAO1中的表达量丰度很高,所以在PAO1中过表达P30时检测到的基因表达量升高不明显。
sRNA的敲除及过表达对细菌的生长无明显影响,这将有利于对进一步研究sRNA的功能时可能出现的结果进行解释,如菌株之间的差异,不是因为生长周期的不同而形成,而是由于基因的缺失或过表达导致的结果。
由于P.aeruginosa分泌一种受群体感应系统调控的绿脓素, 它与感染性和致病性密切相关,所以减少其生成有助于铜绿假单胞菌感染的防治[21-24]。本课题组前期发现sRNA PrrH能够与群体感应系统相互作用,从而调控绿脓素的合成[25]。基于此,我们猜测群体感应系统会通过新筛选的sRNA调控绿脓素合成。通过检测绿脓素,发现AmiL抑制、P30促进,而P34对绿脓素合成无明显影响。由于绿脓素的合成受多种基因的调控,所以群体感应对绿脓素的调控可能不会通过P34发挥作用;由于amiE编码脂肪酰胺酶AmiE,AmiE过量产生能降低绿脓素的水平[26],而amiL是amiE基因非翻译前导序列,所以AmiL可能通过amiE而调控绿脓素的合成;在PAO1中,碳分解代谢阻遏物Crc通过与CrcZ结合抑制绿脓素的合成,而P30与sRNA CrcZ的转录方向相反[27],所以P30与CrcZ可能存在一定的调控关系。然而这些sRNAs对绿脓素的调控机制仍需进一步功能验证实验确认。
综上所述,P.aeruginosa群体感应系统相关sRNA成功筛选以及过表达与敲除株的成功构建对sRNA后续进一步的功能验证实验奠定了扎实的基础。
