辣木叶醇提物不同极性部位抑菌活性研究
2020-05-29王丽虹刘阳姜圆圆刘枭张志豪
王丽虹,刘阳,*,姜圆圆,刘枭,张志豪
(1.武昌理工学院生命科学学院,生物多肽糖尿病药物湖北省协同创新中心,湖北省生物多肽糖尿病药物工程技术研究中心,湖北武汉430223;2.武汉工程大学环境生态与生物工程学院,湖北武汉430073)
为了延长产品的有效期,食品、化妆品、医药等行业都会添加一定量的防腐剂,目前市场上使用的防腐剂大多数是人工合成。有研究发现,一些合成防腐剂有诱癌性[1]和致畸性[2],同时有害微生物的泛滥还会引起人类产生各种疾病,对人类健康构成巨大威胁[3]。有研究显示天然植物中所含的黄酮类物质具有抗菌功能[4],因此科研工作者致力于从天然植物中寻找既安全又有效的天然防腐剂。
辣木(Moringa oleifera Lam)又名鼓槌树、洋椿树,属于辣木科(Moringaceae)辣木属(Moringa Adans)多年生深根性落叶乔木[5],为药食两用植物。现已有研究报道[6-8]辣木叶提取物对大肠埃希菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)和产气肠杆菌(Enterobacter aerogenes)这4种供试菌具有均抗菌活性,且最小抑制浓度(minimum inhibitory concentration,MIC)值都在2.0 mg/mL~4.0 mg/mL之间,研究还发现抗菌活性与其含有的单宁、黄酮类化合物、酚类化合物有关,辣木叶中含有的辣木素能够分解成两个异硫氰酸苄酯分子,而这种物质被证明是有抗菌活性的,因而辣木叶具有开发为天然防腐剂的潜力。树脂天青是一种细胞繁殖与毒性定量检测的常用试剂,因活细胞中含有多种还原酶(如乳酸脱氢酶),可将树脂天青由蓝色还原成粉红色,而死细胞因没有代谢能力,不能将树脂天青还原而继续保持蓝色[9]。因此,树脂天青可用来检测有无活细菌,根据其颜色变化来判断药物的MIC。本文拟采用树脂天青法,测定辣木叶醇提物不同极性部位的MIC,进而测定各极性部位对供试菌的最小杀菌浓度(minimum bactericidal concentration,MBC),以筛选其抗菌活性较强的极性部位,为进一步开发辣木叶资源提供科学依据。
1 材料与方法
1.1 材料试剂与仪器
1.1.1 材料与试剂
辣木叶:产地云南保山,云南大药山商贸有限公司提供;鲍曼不动杆菌(Acinetobacter baumannii)、铜绿假单胞菌(Pseudomonas aeruginosa)、大肠埃希氏菌(Escherichia coli)、肺炎克雷伯菌(Klebsiella pneumoniae)、金黄色葡萄球菌(Staphylococcus aureus)、粪肠球菌(Enterococcus faecalis)、苏云金杆菌(Bacillus thuringiensis)、枯草芽孢杆菌(Bacillus subtilis):武昌理工学院生命科学学院细胞室提供;96孔板:美国康宁公司;90 mm一次性无菌培养皿:海门市卡迈勒实验器材经营部;接种棒:姜堰区康达实验器材厂;纤维素酶(酶活力:10万 U/g)/果胶酶(酶活力:5万 U/g):宁夏和氏璧生物技术有限公司;芦丁标准品(纯度≥98%):上海源叶生物科技有限公司;树脂天青:上海阿拉丁生化科技有限公司;链霉素:合肥新恩源生物技术有限公司。其他试剂均为国产分析纯。试验用水为超纯水。
1.1.2 主要仪器
紫外分光光度计(UV-1800):日本岛津公司;电子分析天平(BS 224S):赛多利斯科学仪器北京有限公司;旋转蒸发仪(SY-500):上海亚荣生化仪器厂;高压灭菌锅(BMX-30R):上海博迅实业有限公司医疗设备厂;生化培养箱(OHG-9073BS-Ⅲ):上海新苗医疗器械制造有限公司;超净工作台(ME104E/02):上海尚道仪器制造有限公司;超纯水仪(UPT-11-10T):成都超纯科技有限公司。
1.2 方法
1.2.1 辣木叶不同极性部位的制备
称取干燥辣木叶粉,按照最佳工艺路线:1 g辣木叶粉对应纤维素酶20 mg、果胶酶40 mg,加入浓度为88%的乙醇,料液比为 1∶22(g/mL),超声 45 min后置于60℃的水浴锅酶解25 min提取辣木叶总黄酮→总醇提液(M)→依次用石油醚、乙酸乙酯、正丁醇萃取→收集萃取液→旋转蒸发除去有机溶剂→置60℃烘箱干燥、粉碎,分别制得辣木叶石油醚部位(M1),乙酸乙酯部位(M2),正丁醇部位(M3)和水溶性部位(M4)备用。
1.2.2 总黄酮含量的测定
标准曲线的绘制:参考谢琼等[10]的方法,配制系列标准溶液后于510 nm处测定吸光度A。以A为纵坐标、芦丁浓度c(mg/mL)为横坐标制作标准曲线,建立回归线方程。
样品总黄酮含量测定:精密称取适量样品,依照绘制标准曲线相同的方法配制供试液、测定A值,并代入回归方程计算各极性部位中总黄酮含量。每个样品测定3次,取平均值。
1.2.3 抗菌活性的测定
采用树脂天青法检测辣木叶各极性部位对A.baumannii、P.aeruginosa、E.coli、K.pneumoniae、S.au -reus、E.faecalis、B.thuringiensis、B.subtilis 8 种供试菌的MIC,之后进一步测定不同极性部位对8种供试菌的MBC。
1.2.3.1 菌种的活化及菌悬液的配制
将固体培养基加热溶化并在培养皿中铺好,待其凝固分别移取不同菌的菌液100 μL于表面,后用涂布棒使菌液涂布均匀,倒置于37℃恒温培养箱中24 h后,用无菌接种棒挑取单个菌落于装有液体培养基的锥形瓶中,于37℃恒温摇床中继续培养过夜,转速为100 r/min[11]。第2天,移取100 μL菌悬液于10 mL灭菌的离心管中,再加900 μL的液体培养基摇匀编号为1,利用十倍稀释法从1号管中移取100 μL菌悬液,再加900 μL液体培养基编号为2,以此类推,共稀释10次。最后分别移取1~10号离心管中的菌液100 μL于固体培养基的上,每个浓度平行3组,涂布均匀,继续培养24 h后观察菌落生长情况并根据计菌落数判断编号几的离心管中菌悬液密度大约为1×108CFU/mL,确定稀释倍数后配置好各供试菌的菌悬液(1×108CFU/mL),放于4℃冷藏。所有操作均在无菌条件下进行。
1.2.3.2 MIC的测定
采用二倍稀释法对20 mg/mL的样品用无菌水进行稀释[12],外加一个 15 mg/mL 的浓度,分别是:20、15、10、5、2.5、1.25、0.625、0.312 5 mg/mL。使用 96 孔板进行MIC的测定,第1~8列为样品组,第9列、第10列分别为阳性对照组和阴性对照组,每个样品设置3个复孔。先在96孔板上每孔加100 μL的液体培养基,样品孔加50 μL的样品液,阴性对照组加50 μL的溶剂,阳性对照组加50 μL 0.1 mg/mL链霉素,最后每个孔添加 50 μL 的菌液(5×105CFU/mL)[13],在摇床摇匀后置于37℃恒温培养箱培养24 h。然后每个孔加入40 μL 0.2 mg/mL树脂天青,置于37℃恒温摇床培养2 h,树脂天青由蓝色变为粉红色的孔所对应的浓度就是样品的MIC。所有操作均在无菌条件下进行。
1.2.3.3 MBC的测定
从1.2.3.3的96孔板蓝色的孔中吸取50 μL于固体培养基上,涂布均匀后于37℃恒温培养箱培养24 h,以培养基表面出现的菌落小于5个的最低浓度判断为MBC[14]。所有操作均在无菌条件下进行。
2 结果与分析
2.1 样品含量的测定
2.1.1 标准曲线的建立
按照1.2.2的方法,得到芦丁标准曲线如图1所示。
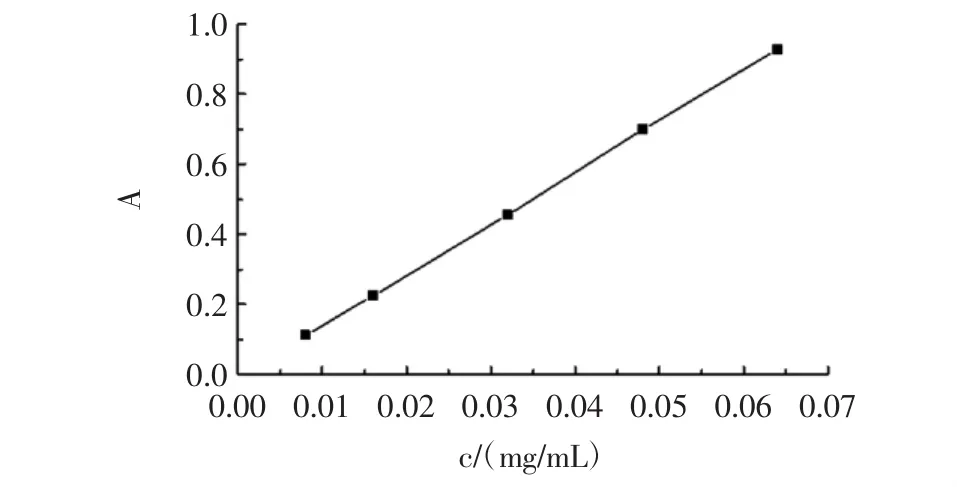
图1 芦丁标准曲线Fig.1 Calibration curve of rutin
回归方程为:A=14.634c-0.0087,其中 R2为0.9998,说明浓度与吸光度的线性关系较好,可用于黄酮含量的测定。
2.1.2 辣木叶醇提物不同极性部位总黄酮含量的测定结果
辣木叶醇提物不同极性部位总黄酮含量见表1。

表1 辣木叶醇提物不同极性部位总黄酮含量Table 1 Total flavonoids content in different different polar extracts of alcohol extract of Moringa oleifera leaves
在试验中,M1加入显色剂与不加显色剂的颜色一致,后经检测在510 nm附近没有吸收峰。查阅相关文献得知,黄酮类物质一般不溶于石油醚,且本试验中得到的石油醚部位为黑色油状物,其中可能存在着大量的色素和油脂[15],故将石油醚部位略去。
从表1可知,辣木叶醇提物中的总黄酮通过不同极性溶剂萃取得到了初步分离,乙酸乙酯中总黄酮含量最高,水相中最少。从M总黄酮含量100.56 mg/g到M2中的326.19 mg/g,总黄酮含量提高了3倍以上,实现了有效富集,说明本试验提取物中的黄酮类物质较易溶于乙酸乙酯。
2.2 MIC的测定结果
辣木叶醇提物及不同极性部位对供试菌的MIC值如表2所示。
由表2可知,4个样品除了M4对8种菌均没有抑菌效果外,其余部位对8种菌都有抑菌效果,其中M2对8种菌的抑菌效果比M3、M要强的多,其对A.baumannii、E.coli的 MIC为1.25 mg/mL,对P.aeruginosa、B.subtilis的 MIC为2.5 mg/mL,对K.pneumoniae、S.aureus、E.faecalis、B.thuringiensis的MIC均为0.625 mg/mL,说明这4种菌对M2更加敏感、更易受到M2抑制。
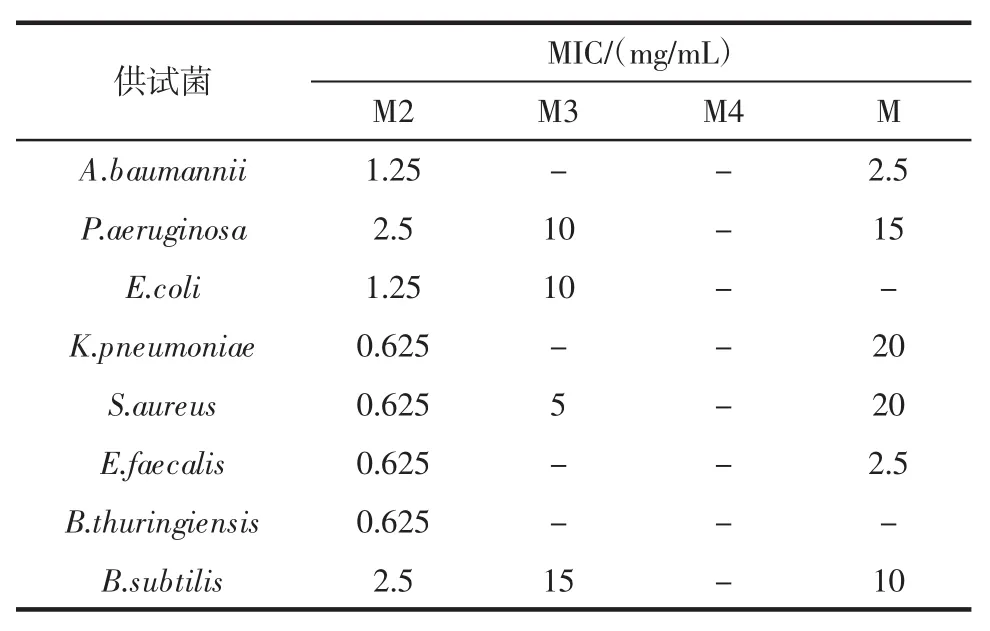
表2 辣木叶醇提物及不同极性部位部位对供试菌的MIC值Table 2 MIC values of ethanol extracts of Moringa oleifera leaves and different polar extracts to the tested bacteria
2.3 MBC的测定结果
辣木叶醇提物及不同极性部位对供试菌的MBC值如表3所示。
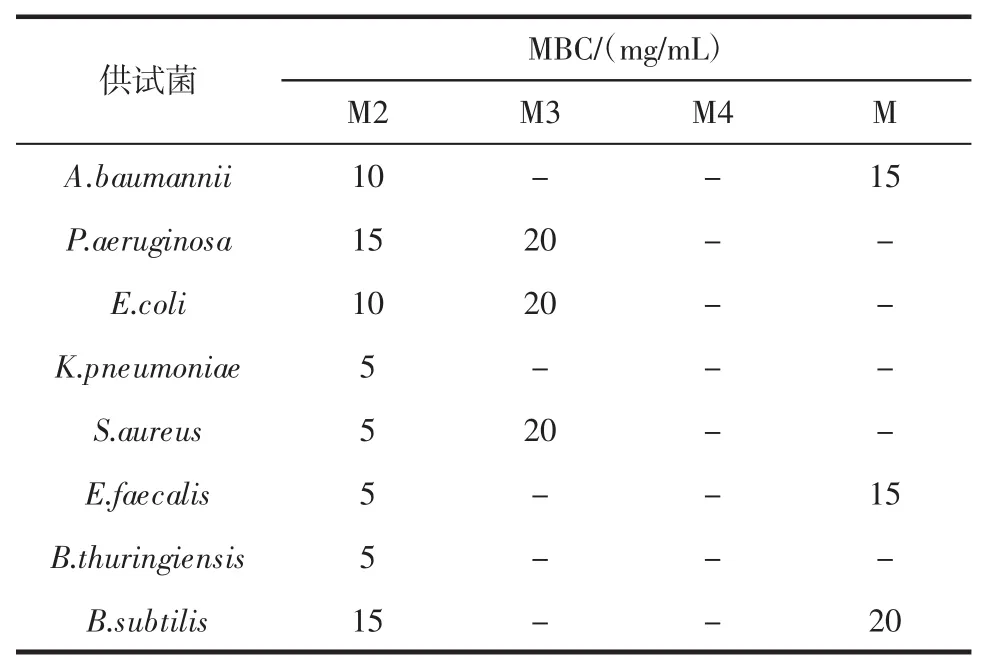
表3 辣木叶醇提物及不同极性部位对供试菌的MBC值Table 3 MBC values of ethanol extracts of Moringa oleifera leaves and different polar extracts to the tested bacteria
由表3可知,M2对8种菌的杀菌效果最强,其中M2 对 K.pneumoniae、S.aureus、E.faecalis、B.thuringiensis的 MBC 均为 5 mg/mL,M3 对 P.aeruginosa、E.coli、S.aureus的MBC均为20 mg/mL,M部位对A.baumannii、E.faecalis有较好的杀菌作用,MBC均为15 mg/mL,水溶性部位则对上述8种菌均没有杀菌效果。
2.4 讨论
本试验对辣木叶醇提物及不同极性部位进行了抑菌活性研究。由表2、表3可知,除水溶性部位对各试验菌均无抑菌活性,其余部位都有不同程度的抑菌活性,与文献报道的结果一致。郭研[16]的研究结果显示,在试验范围内(5 μg/mL~500 μg/mL)辣木叶提取物对S.aureus有抗菌活性,并具有浓度依赖性,但对E.coli没有抑制活性。Abalaka等[17]研究显示,辣木叶氯仿粗提取物对P.aeruginosa、E.coli和伤寒沙门氏菌(Salmonella typhimurium)有显著的抑制作用,MIC分别为 20、10、10 mg/mL;辣木叶水提物对 P.aeruginosa没有抑制作用,对E.coli和S.typhimurium的MIC均为10 mg/mL。Busani等[18]的结果显示,当辣木叶水提物浓度为5 mg/mL时,对各试验菌均无抑菌活性;而5 mg/mL 的丙酮提取物,对 E.coli、S.aureus、阴沟肠杆菌(Enterobacter cloacae)、克里斯汀微球菌(Micrococcus kristinae)和普通变形杆菌(Proteus vulgaris)有抑制作用,但对 P.aeruginosa、K.pneumonia、S.faecalis、短小芽孢杆菌(Bacillus pumilus)和蜡状芽孢杆菌(Bacillus cereus)则没有抑制活性;研究还发现,辣木叶提取物对试验真菌均无抑制作用。王远[19]的研究结果显示,辣木叶总黄酮纯化后的抗菌活性显著增强,对E.coli、B.subtilis、藤黄微球菌(Micrococcus luteus)、S.aureus均有显著的抑制活性,MIC值分别为 1.25、0.625、1.25、2.5 mg/mL,但对P.aeruginosa则没有抗菌效果。
本试验的总黄酮含量测定结果说明,辣木叶醇提物经乙酸乙酯萃取后,黄酮含量显著增大;抗菌研究表明,M2的抑菌活性明显优于其它部位及文献报道的结果,其对 K.pneumoniae、S.aureus、E.faecalis、B.thuringiensis的 MIC均为0.625 mg/mL,对 A.baumannii、E.coli的 MIC 为 1.25 mg/mL,对 P.aeruginosa、B.subtilis的MIC为2.5 mg/mL。综合分析推断,总黄酮可能是辣木叶抑菌活性的主要成分,后续将对其组成成分及结构鉴定等方面进行深入研究,以期揭示辣木叶抗菌活性的物质基础。
3 结论
本文分析了辣木叶醇提物及不同极性部位中的总黄酮含量,结果表明,辣木叶乙酸乙酯部位(M2)、正丁醇部位(M3)总黄酮含量分别为(326.19±2.35)mg/mL和(209.39±1.16)mg/mL,显著高于醇提物中的总黄酮含量(100.56±1.49)mg/mL。抗菌试验结果显示,除M4无抑菌活性外,其余部位的抑菌活性顺序为:M2>M3>M,其中,M2 对 K.pneumoniae、S.aureus、E.faecalis、B.thuringiensis的MIC均为0.625 mg/mL,是辣木叶主要的抗菌活性部位。
