槲皮素对肠道菌群的调节作用研究
2020-05-29陈樱萌胡满江曾钰鹏丁艺新丁静华李瑶璐陈骁熠苏立杰
陈樱萌,胡满江,曾钰鹏,丁艺新,丁静华,李瑶璐,陈骁熠,苏立杰
(广州医科大学公共卫生学院,广东广州511436)
肠道菌群是生活在人体肠道内细菌的统称[1],种类、数量众多,对机体健康发挥着极其重要的作用。肠道菌群协助机体抵御致病菌侵袭,参与消化吸收以及免疫调节等[2-3]。正常人的肠道菌群相对稳定,但是多种因素诸如饮食习惯改变、疾病和药物使用、环境等均会导致肠道菌群失调[4]。肠道菌群失调不仅仅是肠道生物屏障损伤,也与肠道化学屏障、免疫屏障和机械屏障相关联[5-6],可能导致消化系统病变、循环系统疾病及内分泌疾病等。调节肠道菌群可有效缓解其临床症状。
目前,治疗菌群失调主要采用微生态制剂[7],如双歧杆菌、乳酸杆菌等活菌制剂,但活菌使用存在一定局限,而天然活性物质因其环保、高效、对机体损伤小的特点越来越受到重视。研究表明天然活性产物能够有效地调节胃肠道菌群失调状态,其有效成分可以对肠道菌群的种类和数量产生影响,也可以对肠道菌群定位产生影响。杨帆等[8]研究发现,菜籽多糖对小鼠肠道双歧杆菌和乳杆菌等益生菌有明显的促进作用,但对大肠杆菌、肠球菌等致病菌有明显的抑制作用。菊粉干预后,小鼠双歧杆菌和乳杆菌的相对丰度也是显著增加的[9]。
槲皮素(quercetin)是天然存在的黄酮类物质,广泛存在于植物的花、叶和果实中,具有抗氧化[10]、抗炎[11]、抑菌[12]等多种生物活性作用,且长期食用安全性较高。由于其稳定强大的生物活性和广泛的药理作用而引起广泛关注。槲皮素可通过改变细胞的通透性、抑制细菌体内酶活性或抑制核酸的合成等途径发挥抑菌效果。槲皮素调节肠道菌群失衡状态,增加拟杆菌和减少变形杆菌,表明其有恢复宿主微生物平衡的能力[13]。魏希颖等[12]研究槲皮素的体外抑菌效果发现槲皮素对革兰氏阳性菌和革兰氏阴性菌均有抑制作用。而体内研究发现添加一定槲皮素可明显抑制蛋鸡肠道有害菌群大肠杆菌等的生长,提高益生菌双歧杆菌的数量,增加了肠道的竞争性保护能力[14]。这些方法均是对抑制致病菌的效果进行分析,研究槲皮素对细菌增殖过程的影响较少,对槲皮素与益生菌体外增殖、调节肠道菌群失调功能的研究也未见报道。因此拟动态观察槲皮素在体内和体外对肠道优势菌增殖的影响,并为辅助调节肠道菌群食物的研制提供理论依据。
1 材料与方法
1.1 材料与试剂
小鼠(SPF级Balb/c雄性小鼠,7周龄,健康状况良好):广东省医学实验动物中心;槲皮素、盐酸林可霉素注射液:西安应化生物科技有限公司;伊红美蓝琼脂培养基、胆盐七叶苷琼脂、双歧杆菌琼脂、乳杆菌选择性培养基:北京陆桥技术有限责任公司;丽珠肠乐胶囊:珠海丽珠医药;二甲基亚砜(分析纯):天津市大茂化学试剂厂;革兰氏染色液、苏木素染液、伊红染液:杭州微生物试剂有限公司;苯扎溴铵消毒液:南昌华鑫医药化工有限公司;无菌厌氧培养袋、厌氧产气袋、氧气指示剂:日本三菱化学公司。
营养肉汤培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,L-半胱氨酸 0.3 g,加热。
槲皮素无菌溶液的制备:精确称取槲皮素0.00604g,溶于200 μL二甲基亚砜,紫外线常规照射30 min即得到槲皮素无菌溶液。
精确称取槲皮素200、400、800 mg,各加入生理盐水20 mL,混匀即得10、20、40 mg/mL槲皮素悬浊液。常温保存,使用前充分摇匀。
取丽珠肠乐胶囊3粒,加入3 mL生理盐水,混匀。现配现用。
1.2 仪器与设备
SPX-250B微机生化培养箱:上海悦丰仪器仪表有限公司;MULTISKAN GO全自动酶标仪:赛默飞世尔科技公司;MLS-3750高压蒸汽灭菌机:日本三洋电机集团;UV-3900紫外可见分光光度计:日本日立集团;XW-80A漩涡混合仪:海门市其林贝尔仪器制造有限公司;DZF-6050真空干燥箱:上海一恒科学仪器有限公司;倒置荧光显微镜:日本奥林巴斯;EG1160石蜡包埋机、HI1210摊片机、RM2235石蜡切片机:徕卡(Leica)仪器(德国)有限公司。
1.3 试验方法
1.3.1 槲皮素影响小鼠肠道菌群体外增殖的实验方法
1.3.1.1 菌种分离
无菌取小鼠粪便,用无菌水梯度稀释至10-4后,分别接种于4种选择培养基上,按照以下条件进行培养。

表1 菌种定向分离条件Table 1 Conditions for directional separation of strains
选择性培养并鉴定,剔除不符合条件的菌落,其余菌落以无菌水冲洗后收集,得到目标菌种。
1.3.1.2 菌种鉴定
参考《伯杰氏系统细菌学手册》第九版,通过菌落形态和微生物形态学特征进行鉴定。
1.3.1.3 定量菌液浓度
以麦氏比浊管为参照,将菌种以无菌水调整至0.5 MCF,相当于108(CFU/mL),待用。
1.3.1.4 光电比浊法
将0.5 MCF的目标菌种以10%的接种量分别接种于槲皮素浓度为 0、0.005、0.01、0.05、0.1、0.5、1(μmol/mL)的营养肉汤中,各取 200 μL置于 96孔板中,37℃厌氧培养。以空白营养肉汤为对照,600 nm波长下测其吸光度(OD值)。每2 h测定1次,共检测24 h。
1.3.1.5 微生物的无害化处理
实验结束后,所有一次性耗材浸泡于稀释后的苯扎溴铵消毒液(苯扎溴铵与水体积比为1∶14)中10 min以上。其余器材121℃高温高压灭菌20 min后取出清洗。
1.3.2 槲皮素影响小鼠肠道菌群体内增殖的实验方法
1.3.2.1 肠道菌群失调模型的构造与槲皮素干预对小鼠肠道菌群的影响
SPF级Balb/c雄性小鼠80只,6~8周龄,饲养于清洁环境中,自由饮水饮食,每天称重1次。将小鼠按体重随机分为空白对照组(K,20只)和模型组(M,60只),模型组每天10:00和17:00各灌胃盐酸林可霉素0.3 mL,空白组给予等量生理盐水,共灌胃3天。造模期间观察各组小鼠的精神状态、活动情况、外观等。
保留空白对照组(K,10只),将模型组按照体重随机分为自然恢复组(N)、阳性对照组(Y)、低剂量组(D)、中剂量组(Z)和高剂量组(G),每组均为10只。阳性对照组每天给予丽珠肠乐溶液0.3 mL,各剂量组每天灌胃相应剂量槲皮素悬浊液(100、200、400 mg/kg BW),空白对照组和自然恢复组每天灌胃生理盐水。
1.3.2.2 样品的采集与处理
小鼠粪便的采集与处理:在干预的第1、5、10、15天灌胃前,用无菌棉签刺激小鼠肛门,促使小鼠排便。采集小鼠新鲜粪便,将粪便快速放入已灭菌EP管中,取出后立刻进行菌群测定。严格按照无菌操作规范,将小鼠粪便放入干燥灭菌的5 mL无菌EP管中,加入99倍粪便重量的无菌生理盐水,然后充分振荡至粪便分散均匀,制备成10-2粪便稀释液,备用。
小鼠脏器的采集与处理:干预结束后对小鼠进行断颈椎处死,剖腹,快速取出小鼠脾脏、盲肠和结肠组织。脾脏、盲肠组织称重纪录。每组取3只小鼠结肠组织保存于4%多聚甲醛中,其余结肠组织和所有盲肠迅速用液氮急冻,-80℃冻存。
1.3.2.3 菌群测定
培养基的配方及制备参照培养基说明书。
1.3.2.4 适宜接种浓度测定
无菌环境下吸取无菌取10-2粪便稀释液0.5 mL,加入无菌生理盐水4.5 mL充分吹打均匀,即得到10-3粪便稀释液。以此方法依次得到10-4、10-5、10-6浓度。取 10-3、10-4、10-5、10-6浓度粪便稀释液,分别吸取 10 μL和20 μL,均匀涂布于选择培养基上,参考《保健食品检验与评价技术规范(2003版)》要求培养后统计其菌落总数。每个样品设3个平行样。
1.3.2.5 样本的接种、培养及鉴定
使用涂布法,选择相应样本的稀释液10 μL分别接种于4种菌群的相应的选择培养基上,涂布均匀。乳杆菌、双歧杆菌的培养皿立即装入有厌氧产气袋的厌氧培养袋中。每个样品做3个平行样。培养条件及培养基上各细菌的鉴定方法见表2。

表2 菌种培养及鉴定方法Table 2 Strain culture and identification method
1)菌落的鉴定
培养后,挑取培养基上菌落,根据菌落形态、革兰氏染色镜检确定目的菌。肠杆菌为革兰氏阴性菌,无芽孢,一般为中等大小的杆菌,端圆,形状长短不一;肠球菌为革兰氏阳性球菌,形态类似链球菌,为单个、成双或短链状排列的卵圆形;乳酸杆菌为革兰氏阳性菌,多数菌体稍大,直或微弯,成双或短链排列;双岐杆菌为革兰氏阳性菌,无芽孢,菌体长短及形态不一,多有分叉,常形成Y或V型排列。
2)菌落计数
培养结束后,使用菌落计数仪观察并计数各目的菌的菌落数。根据平板上的活菌计数和稀释度,按活菌计数公式计数,结果以每克粪便或盲肠内容物湿重中菌落形成单位的对数值表(log10CFU/g):每克粪便或结肠内容物中菌落数=log10(菌落数×稀释倍数×每次稀释取样毫升数)/(接种用样品毫升数×样品克数)。
1.3.2.6 小鼠结肠组织病理切片制作
1)石蜡切片的制备:杀取小鼠后,快速取出小鼠结肠,于冷的生理盐水中漂洗后按如下操作进行:固定、脱水、透明、浸蜡包埋、修块、切片、摊片、烤片及保存。
2)苏木素-伊红染色:参考常规方法操作。
1.3.2.7 结果判定
依据《保健食品检验与评价技术规范(2003版)》规定,干预后干预组与对照组比较符合以下任一项,差异有显著性即可以判定该受试样品具有调节肠道菌群的作用。
1)粪便中双歧杆菌和/或乳杆菌明显增加,肠杆菌、肠球菌无明显变化。
2)粪便中双歧杆菌和/或乳杆菌明显增加,肠杆菌和/或肠球菌明显增加,但增加的幅度低于双歧杆菌/乳杆菌增加的幅度。
2 结果
2.1 菌种分离结果
小鼠粪便稀释后接种在选择培养基上,经培养后,各个平板上菌落分散生长,无重叠黏连,数量充足。
2.2 菌种鉴定结果
依据《伯杰氏系统细菌学手册》第九版对肠球菌、肠杆菌、双歧杆菌和乳杆菌的描述,对分离所得菌种菌落形态和镜下形态进行观测,结果如表3、图1、图2所示。

表3 菌种鉴定结果Table 3 Results of strain identification
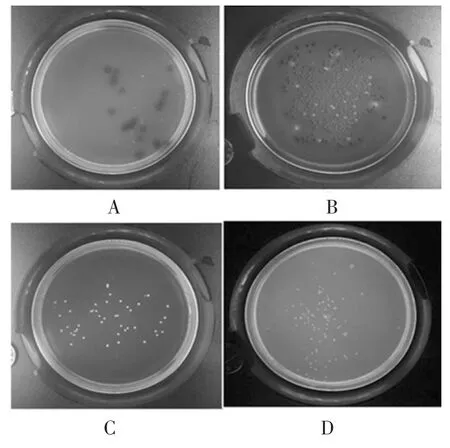
图1 菌种菌落形态Fig.1 Colony morphology of species
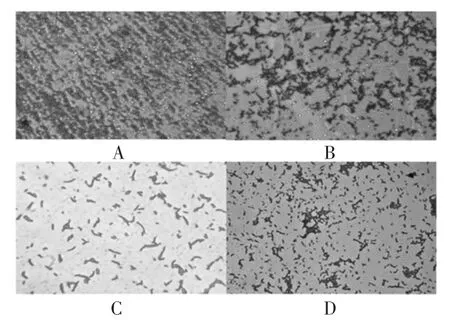
图2 革兰氏染色结果及镜下形态Fig.2 Gram staining results and microscopic morphology
本试验分离所得菌种符合《伯杰氏系统细菌学手册》第九版对肠球菌、肠杆菌、双歧杆菌和乳杆菌的描述,可用于后续试验。
2.3 浊度检测波长选择
比浊法检测用到的检测波长多为600 nm,也有实验选用420 nm作为检测波长。两种波长检测原理相同,均通过测定光透过率检测菌体数目。在420 nm处测量时,培养基中色素等成分可能会影响检测准确性,因此选择600 nm作为检测波长。
2.4 槲皮素对肠道菌群体外增殖的影响
连续测定不同菌群在 0、0.01、0.05、0.1、0.5、1 μmol/mL浓度槲皮素作用下24 h内OD600的变化,制成24 h生长曲线,动态评价槲皮素对致病菌和益生菌菌群体外增殖的影响。
2.4.1 不同浓度槲皮素对致病菌体外增殖影响
不同浓度槲皮素对肠球菌体外增殖的影响见图3。
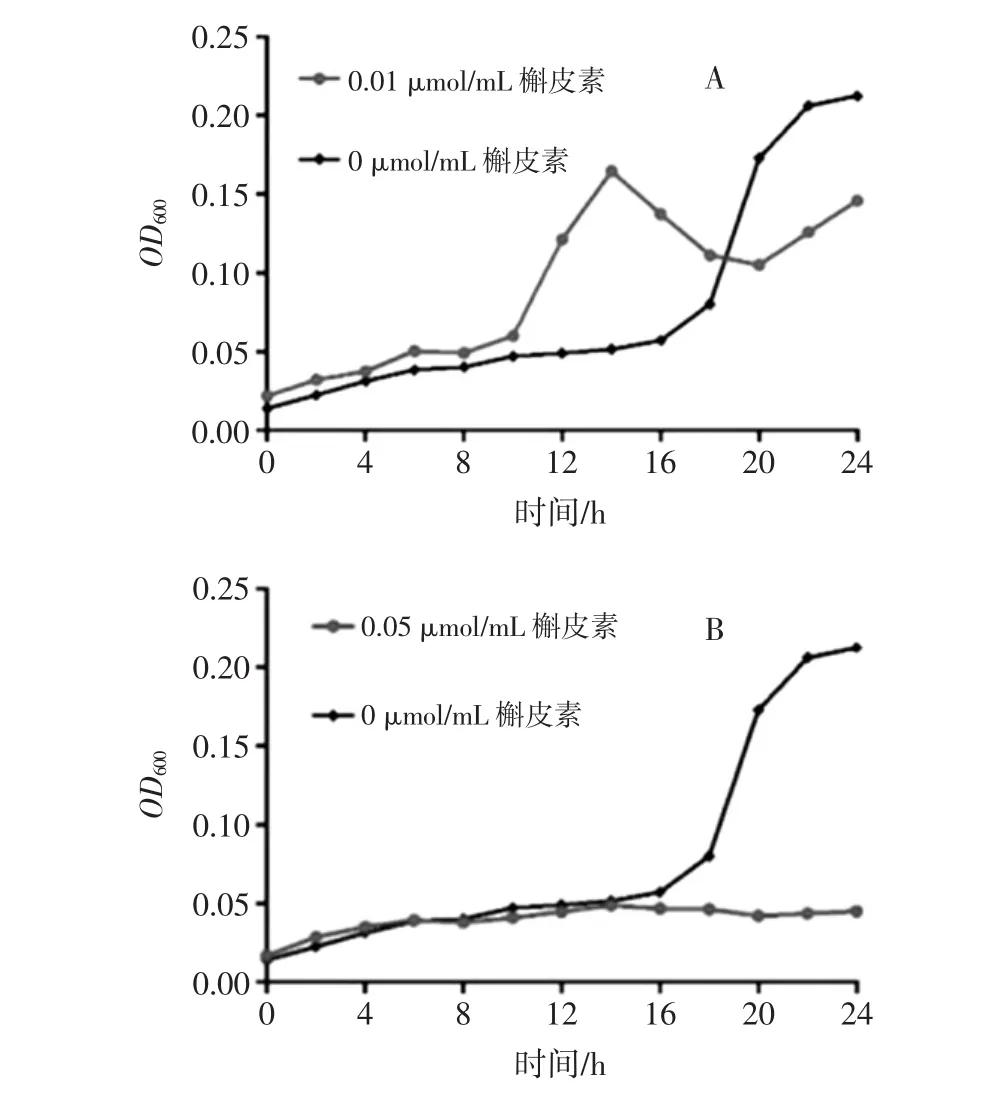

图3 不同浓度槲皮素对肠球菌体外增殖的影响Fig.3 Effects of different concentrations of quercetin on the proliferation of enterococcus in vitro
如图3所示,黑色折线代表空白组肠球菌的体外增殖情况,红色折线代表槲皮素干预下肠球菌的体外增殖情况。0.01 μmol/mL槲皮素(图3A)在10 h左右虽然促进了肠球菌的增殖,但是在14 h左右后其生长曲线明显呈下降趋势,18 h后肠球菌的增殖程度明显低于空白组。0.05、0.1、0.5、1 μmol/mL 槲皮素干预组(图3B、C、D、E)肠球菌生长曲线基本水平,随时间只有小幅度增长。经培养,所有干预组肠球菌生长曲线均明显低于空白组肠球菌,表明所有浓度的槲皮素均对肠球菌的增殖表现出较强的抑制作用。不同浓度槲皮素对肠杆菌体外增殖的影响见图4。

图4 不同浓度槲皮素对肠杆菌体外增殖的影响Fig.4 Effects of different concentrations of quercetin on the proliferation of e.coli in vitro
如图4所示,黑色折线代表空白组肠杆菌的体外增殖情况,红色折线代表槲皮素干预下肠杆菌的体外增殖情况。24 h内各个干预组肠杆菌的生长曲线与空白组趋势基本一致,各个干预组肠杆菌的生长曲线多数在空白组之下,24 h时所有干预组的肠杆菌OD600均小于空白组,槲皮素对肠杆菌的增殖抑制效果虽并不明显,但也未表现出扶植作用。
2.4.2 不同浓度槲皮素对益生菌体外增殖影响
不同浓度槲皮素对双歧杆菌体外增殖的影响见图5。
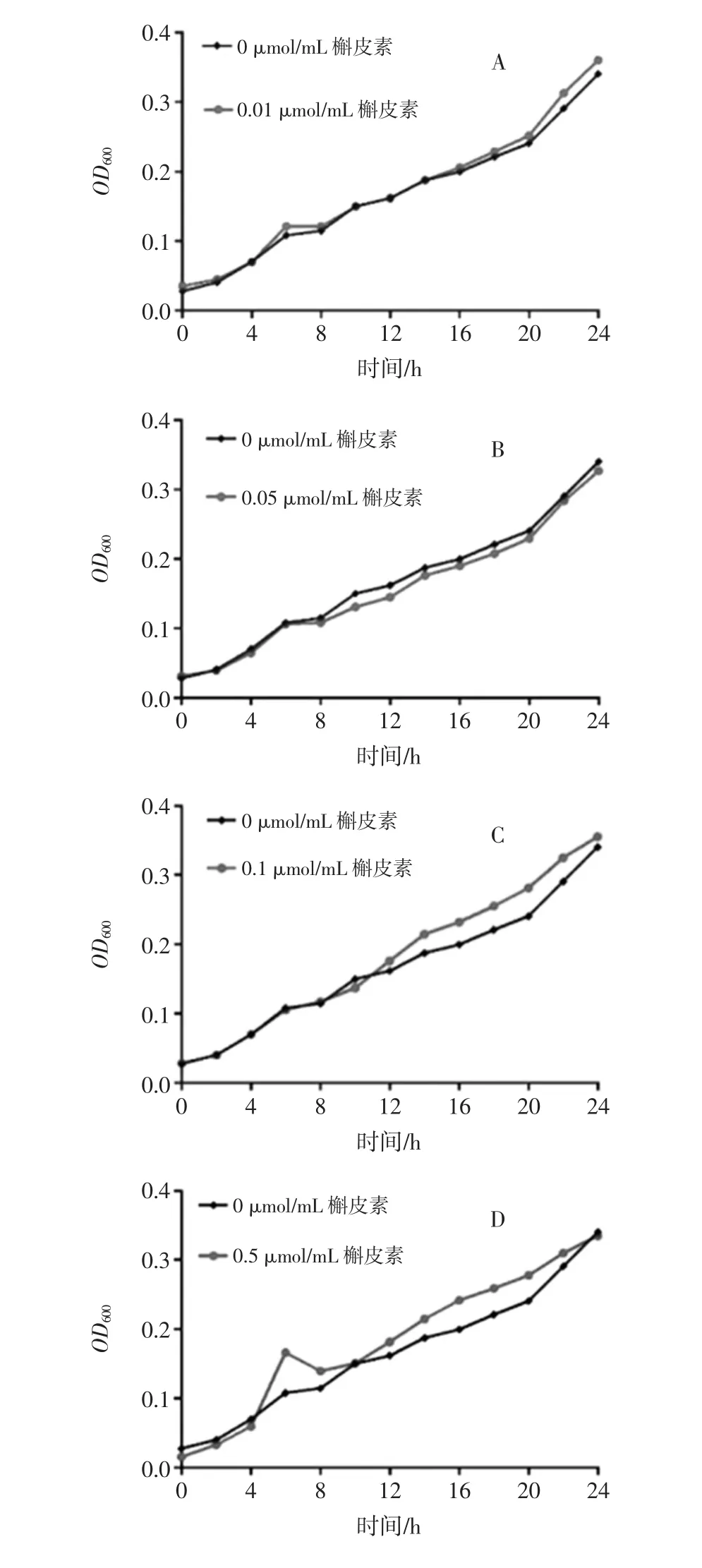
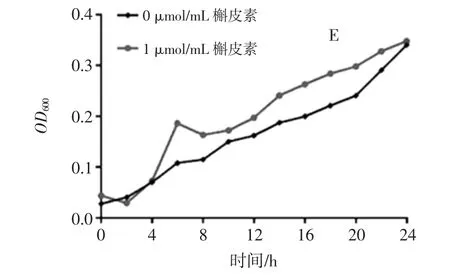
图5 不同浓度槲皮素对双歧杆菌体外增殖的影响Fig.5 Effects of different concentrations of quercetin on the proliferation of bifidobacteria in vitro
如图5所示,黑色折线代表空白组双歧杆菌的体外增殖情况,红色折线代表槲皮素干预下双歧杆菌的体外增殖情况。24 h内各个干预组双歧杆菌的生长曲线与空白组趋势基本一致,各个干预组双歧杆菌的生长曲线多数在空白组之上,24 h时所有干预组的双歧杆菌OD600基本都小于空白组,槲皮素对双歧杆菌并无抑制效果,但也未表现出较明显的扶植作用。不同浓度槲皮素对乳杆菌体外增殖的影响见图6。
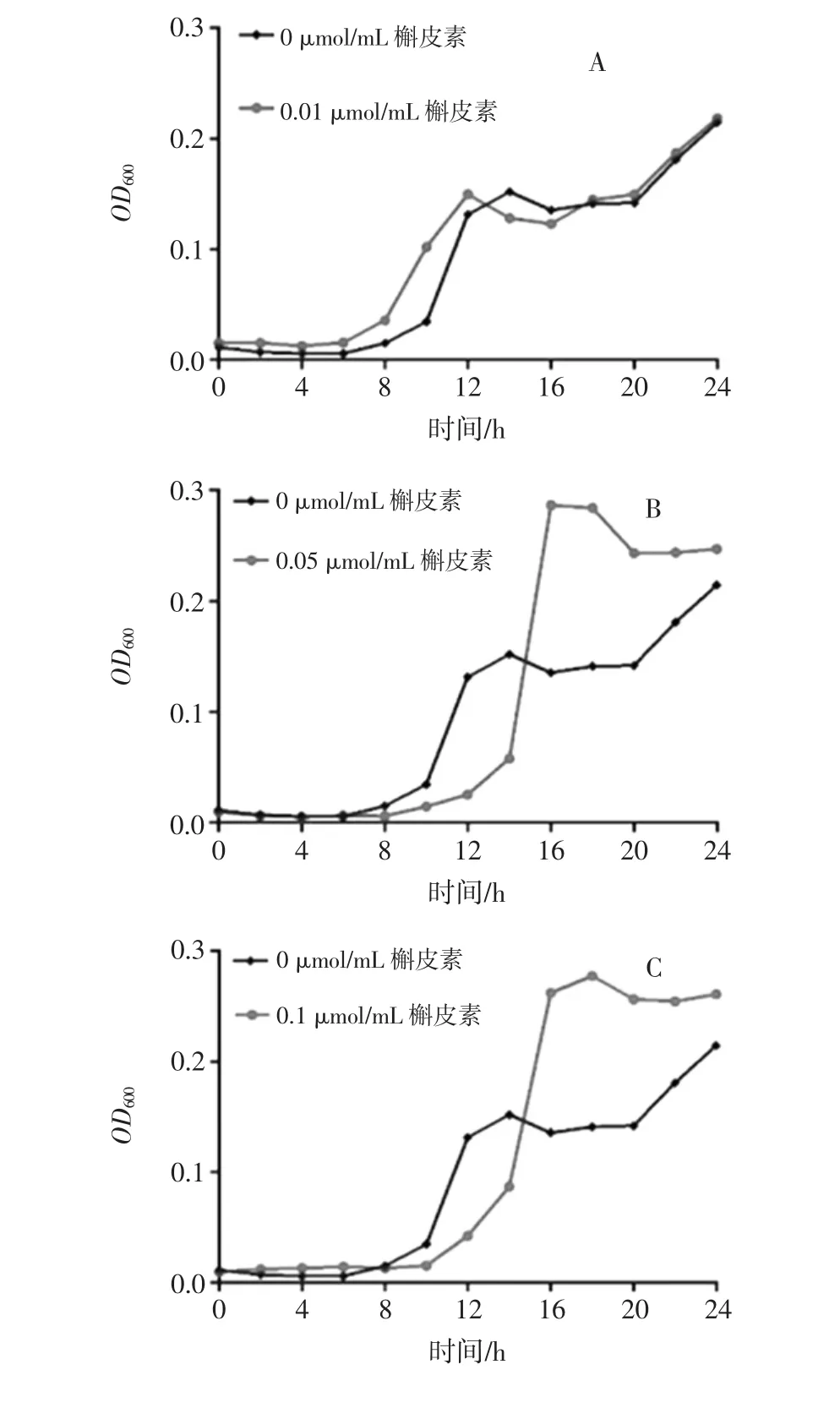

图6 不同浓度槲皮素对乳杆菌体外增殖的影响Fig.6 Effects of different concentrations of quercetin on the proliferation of lactobacillus in vitro
如图6所示,黑色折线代表空白组乳杆菌的体外增殖情况,红色折线代表槲皮素干预下乳杆菌的体外增殖情况。0.01、0.05、0.1 μmol/mL 浓度槲皮素组(图6A、B、C)乳杆菌的生长曲线明显高于空白组乳杆菌生长曲线,其中0.01 μmol/mL浓度槲皮素(图6A)在8 h~12 h可加速乳杆菌的增殖,0.05 μmol/mL浓度槲皮素(图6B)在15 h~24 h可加速乳杆菌的增殖,但对其最终总浓度并未产生明显影响,0.1 μmol/mL浓度槲皮素(图6C)不仅在15 h后加速乳杆菌的增殖,还明显提高了乳杆菌的最终浓度,表现出较强的扶植作用;而 0.5、1 μmol/mL 浓度槲皮素(图 6D、E)则对乳杆菌表现为较强的抑制作用。
槲皮素渗入细菌内会降低细胞液pH值杀灭细菌[15]。乳杆菌具有较强的耐酸性,因此一定浓度范围内槲皮素干预下,槲皮素无法抑制乳杆菌增殖,但是乳杆菌增殖被扶植的原因仍需进一步探索。过高浓度的槲皮素依然会抑制其体外增殖,可能与槲皮素破坏细胞壁的能力有关。
2.5 接种浓度的测定结果
选择在培养基上出现50 CFU~300 CFU菌落的稀释度为接种稀释度。最后确定乳杆菌、双歧杆菌、肠杆菌接种稀释度为10-5,肠球菌接种稀释度为10-4,接种量为10 μL时,观察效果最佳。
2.6 菌群失调小鼠模型造模效果评价
2.6.1 造模后小鼠一般情况
造模3 d后,空白组小鼠(生理盐水灌胃)精神状态好,活动正常,毛发光洁整齐,外观及排便情况无异常;模型组小鼠(盐酸林可霉素灌胃)精神状态较差,活动量减少且活动缓慢,毛发黏结成束且缺少光泽,活动时背部皮肤轻易可见,小鼠有腹泻症状,粪便较稀不易成型,肛门附近有较多粪便残留。
2.6.2 造模后肠道菌群测定
医学上用B/E值(双歧杆菌/肠杆菌)来评估肠道菌群的情况,如果B/E比值大于1则说明肠道菌群处于平衡状态,如果B/E比值小于1则说明肠道菌群处于失衡状态,比值越小说明菌群失衡越严重。如表4所示,造模后空白组小鼠B/E值为1.15,肠道菌群平衡,而模型组小鼠B/E值为0.99,说明盐酸林可霉素灌胃导致了小鼠B/E值下降,造成了小鼠肠道菌群失衡。

表4 造模后肠杆菌与双歧杆菌数量Table 4 Enterobacteriaceae and bifidobacteria after model establishment
2.6.3 造模后小鼠脏器比变化
解剖后可见,空白组小鼠消化道颜色呈粉红色,具有较好的弹性;模型组与空白组对比发现,小鼠消化道颜色苍白,肠壁组织变薄易断,盲肠肿大明显,造模后小鼠盲肠脏器比显著大于空白对照组(P<0.05)(如图7)。

图7 造模后小鼠盲肠脏器比Fig.7 Cecum organ ratio in mice after model establishment
2.6.4 菌群失调小鼠模型造模后病理切片结果
观察造模后小鼠结肠组织苏木素-伊红染色结果见图8。

图8 造模后小鼠肠道苏木素-伊红染色(×100)Fig.8 Intestinal hematoxylin-eosin staining in mice after model establishment
盐酸林可霉素造模3 d后,空白组小鼠结肠组织腺体大小正常,结肠上皮完整,细胞紧密。模型组小鼠结肠绒毛减少,腺体变少且萎缩,结肠上皮受损,细胞连接有间断。
2.7 槲皮素干预对小鼠粪便中菌群的影响
槲皮素干预后第1次检测小鼠肠道菌群情况见图9。
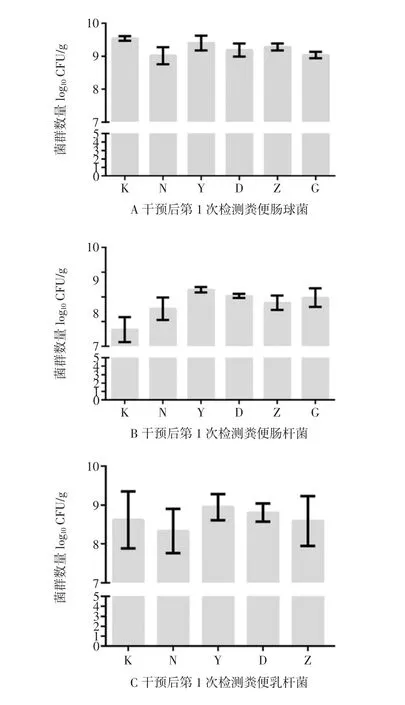
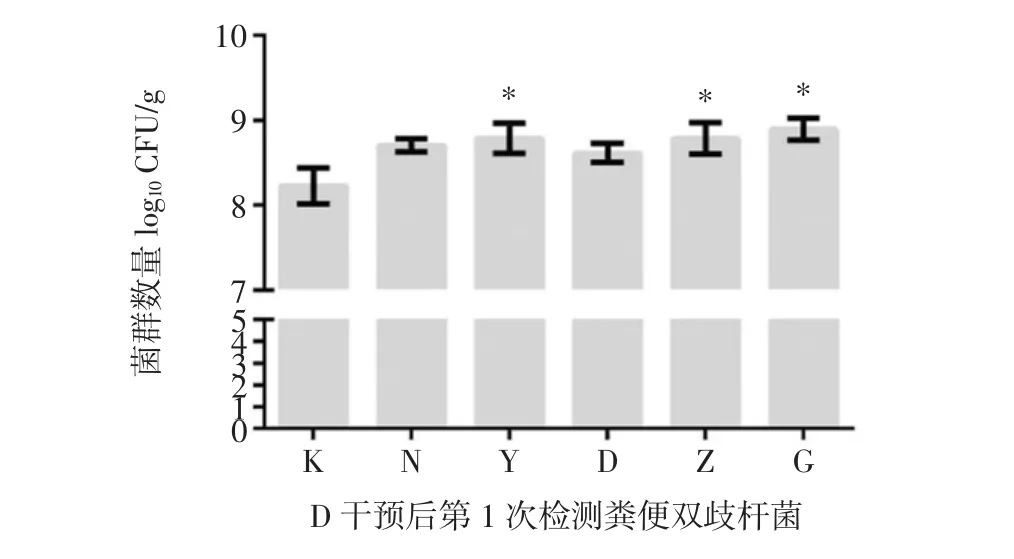
图9 槲皮素干预后第1次检测小鼠肠道菌群情况Fig.9 Detection of intestinal flora in mice for the first time after quercetin intervention
干预后第5天时第1次检测菌群情况。与空白组相比,所有组别小鼠粪便中肠球菌、肠杆菌数目都有所增加(图9A、B)但结果无统计学差异(P>0.05)。与空白组相比,所有组别小鼠粪便中双歧杆菌的数目都有所增加(图9C),且阳性对照组、中剂量组和高剂量组均有统计学差异(P<0.05)。与空白组相比,阳性对照组、低剂量组和高剂量组小鼠粪便乳杆菌数目增多,自然恢复组和中剂量组小鼠粪便乳杆菌数目减少(图9D),但变化无统计学差异(P>0.05)。根据《保健食品检验与评价技术规范(2003版)》规定可判断:干预后第5天时,阳性对照组、槲皮素干预中剂量组和高剂量组即表现出调节肠道菌群能力。槲皮素干预后第2次检测小鼠肠道菌群情况见图10。
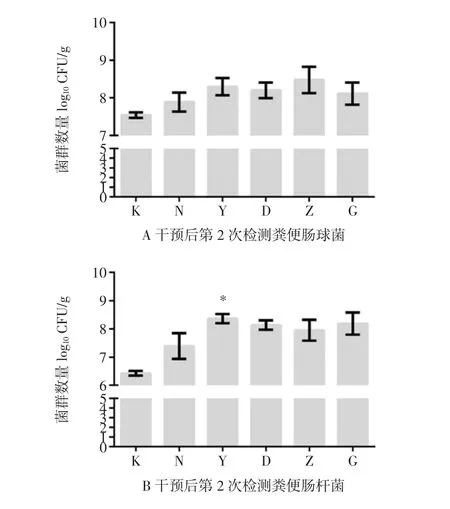
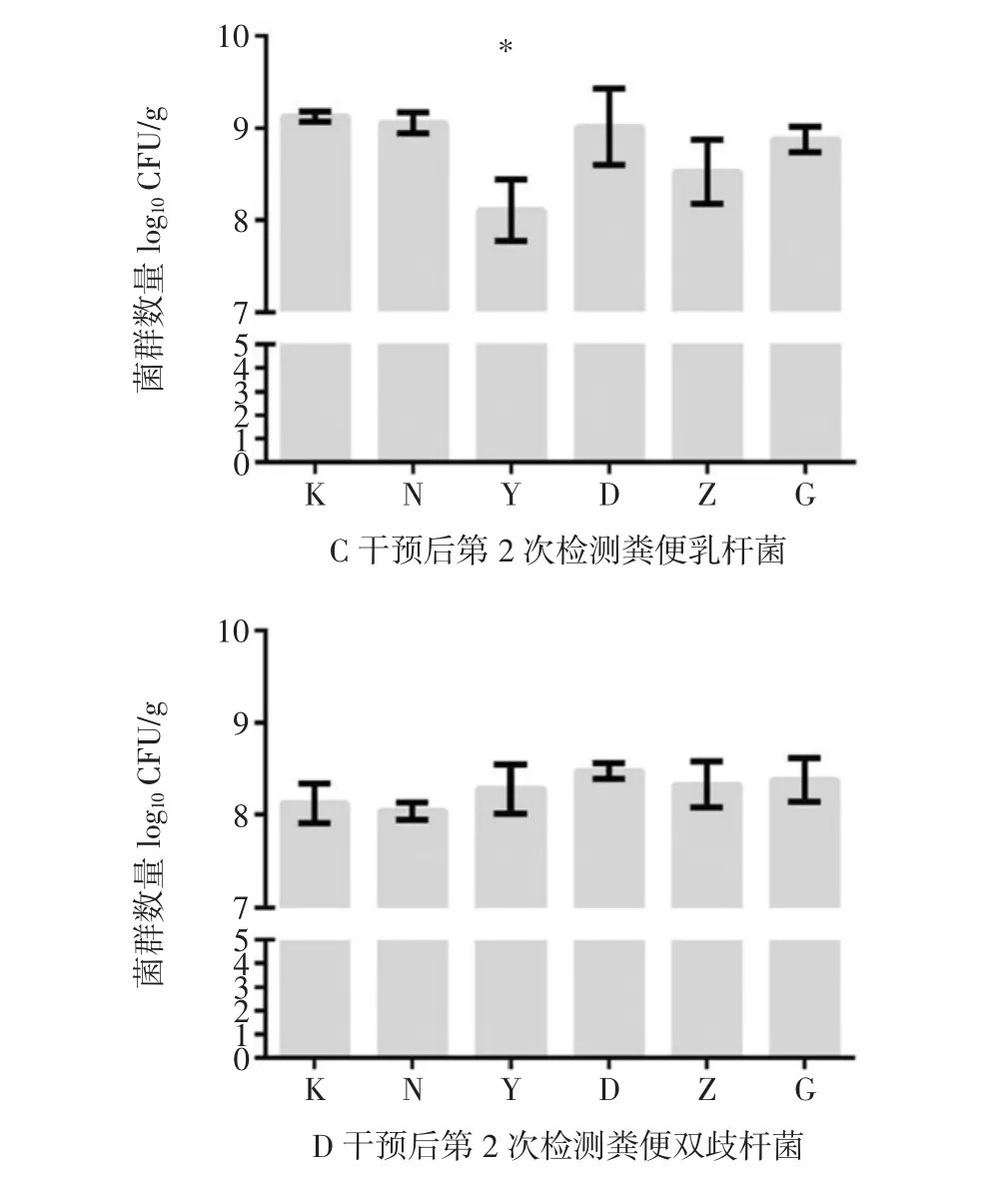
图10 槲皮素干预后第2次检测小鼠肠道菌群情况Fig.10 Detection of intestinal flora in mice for the second time after quercetin intervention
干预后第10天时,第二次检测菌群情况。与空白组相比,所有组别小鼠粪便中肠球菌、肠杆菌数目都有所增加(图10A、B),只有阳性对照组小鼠粪便中肠杆菌增加有统计学差异(P<0.05)。与空白组相比,所有组别小鼠粪便中双歧杆菌的数目都有所增加(图10C),所有结果均无统计学差异(P>0.05)。与空白组相比,所有组别小鼠粪便双歧杆菌数目均下降(图10D),阳性对照组双歧杆菌数目下降有统计学差异(P<0.05)。因此,干预后第10天各槲皮素干预组小鼠的肠道菌群与空白对照组和自然恢复组无统计学差异,但是所有组别小鼠的条件致病菌(肠球菌和肠杆菌)数量均比空白对照组有明显升高,而各组间双歧杆菌数目变化不明显,乳杆菌数目反而下降。
槲皮素干预后第10天时,自然恢复组菌群与空白组即无显著差异,说明盐酸林可霉素灌胃对肠球菌、肠杆菌、双歧杆菌和乳杆菌造成的菌群失调是可以自然恢复的,但肠道菌群种类众多,并不能确定盐酸林可霉素是否影响肠道菌群的物种丰度及其多样性,以及物种丰度和多样性是否可以自然恢复到菌群失调前水平,需进一步通过16s rDNA测序进行探索。槲皮素干预后第3次检测小鼠肠道菌群情况见图11。

图11 槲皮素干预后第3次检测小鼠肠道菌群情况Fig.11 Detection of intestinal flora in mice for the third time after quercetin intervention
干预后第15天时,第3次检测菌群情况。与空白组相比,所有组别小鼠粪便中肠球菌数目都有所增加(图11A),但只有自然恢复组的升高具有统计学差异(P<0.05)。与空白组相比,所有组别小鼠粪便肠杆菌和双歧杆菌的数目都有所增加(图11B、C),但结果均无统计学差异(P>0.05)。与空白组相比,其余所有组别小鼠粪便乳杆菌数目均减少(图11D),但变化无统计学差异(P>0.05)。
3 结论
槲皮素在自然界中存在广泛,成本低廉且易于保藏及加工。对槲皮素调节肠道菌群效果进行评价,发现在一定浓度范围内槲皮素对乳杆菌体外增殖有明显扶植作用,超过范围时对乳杆菌增殖强烈抑制;槲皮素对肠球菌体外增殖均表现为强烈的抑制作用,对肠杆菌和双歧杆菌体外增殖无明显的抑制作用但也不表现出扶植作用。200 mg/kg BW和400 mg/kg BW槲皮素可增加小鼠肠道内双歧杆菌数量。以上结果说明,槲皮素可调节肠道菌群失调状态。
