基于高通量测序分析鲜槟榔水提液对于小鼠肠道菌群及免疫指标的影响
2020-05-29刘尔卓吴忠坤赵紫薇李宗军王远亮
刘尔卓,吴忠坤,赵紫薇,李宗军,2,3,王远亮,2,3,*
(1.湖南农业大学食品科学技术学院,湖南长沙410128;2.食品科学与生物技术湖南省重点实验室,湖南长沙410128;3.国家植物功能成分利用工程技术研究中心,湖南长沙410128)
槟榔原产于马来西亚,是生长在亚洲热带地区的槟榔属常绿乔木,我国台湾、云南与海南等地广泛种植。作为人类除烟草、酒与咖啡因类饮品之后的第四大类嗜好物,食用人群高达6亿之多。槟榔食用的历史亦在数千年之上,因其具有驱蛔、提神、消食的功效而跻身我国四大南药。随着现代医学发展和流行病学研究的深入,槟榔食用对于人体健康的危害渐渐被人们所认识。这其中长期咀嚼槟榔造成的口腔组织损伤与槟榔碱的生理毒性作用引起了人们的特别注意,因而目前大量的工作主要集中于槟榔咀嚼物(betel quid)和槟榔碱对于口腔组织细胞、肝脏等脏器细胞的生理作用及其机理的研究上[1-3]。
近年来,研究者们将人体微生物菌群(human microbiome)视为人体另一个重要的器官。这其中,肠道微生物菌群(intestinal microbiota)结构与比例的改变被认为与人体疾病的发生有着密切的联系[4]。槟榔提取液(areca nut extract,ANE)目前已被证实能促进多种人体免疫细胞炎症因子的释放,并可能导致口腔慢性炎症的发生[5-6]。然而ANE是否也能作用于肠道微生物使其产生相应的改变并促进机体炎症的发生,并没有相关试验数据的支撑。目前也鲜有关于槟榔食用对于机体肠道微生物影响的研究。因此,本研究以小鼠为实验对象着重探究ANE对于肠道微生物的影响,并结合小鼠免疫指标的测定分析其对于机体可能产生的作用以及相关的影响,以期为日后槟榔食用相关的肠道菌群研究提供一些参考与借鉴。
1 材料与方法
1.1 材料和试剂
1.1.1 试验材料
鲜槟榔:海南省万宁市。
1.1.2 主要试剂
小鼠白介素-1(interleukin 1,IL-1)、α 肿瘤坏死因子(tumor necrosis factor α,TNF-α)、免疫球蛋白 A(immunoglobin A,IgA)、IgM、IgG Elisa试剂盒:长沙达尔锋生物科技有限公司。
1.2 仪器
冷冻干燥仪(FD-IA-50):北京博医康实验仪器有限公司;高速万能粉碎机(QE-500):浙江屹立工贸有限公司;超声仪(JP-030S):深圳市洁盟清洗设备有限公司;恒温水浴锅(DZKW-S-8):北京市永光明医学仪器有限公司;离心机(LXJ-IIB):上海安亭科学仪器厂;旋转蒸发器(RE-53):上海亚荣生化仪器厂。
1.3 实验动物
SPF级雄性昆明小鼠,4周龄(约20 g):湖南斯莱克景达实验动物有限公司,生产证号:SCXK(湘)2013-0004,此次实验遵循《实验动物管理条例》中的要求进行。
1.4 试验方法
1.4.1 灌胃液制备
槟榔水提物制备:将洗净切碎晾干的槟榔块冷冻干燥36 h,冻干后用万能粉碎机粉碎。槟榔粉加入足量蒸馏水,先超声30min后60℃水浴1h。随后5000 r/min离心10 min取上清液旋转蒸发浓缩。
1.4.2 试验设计
在温度22℃左右、相对湿度60%、光照时长为12 h的小鼠房经过1周环境适应性饲养后随机将30只小鼠分为3组(n=10)。各组均每天准时灌胃一次,一共进行4周,3个试验组分别如下:
对照组(F):给予蒸馏水,灌胃剂量为 0.1 mL/(10 g·d);鲜槟榔低剂量组(A1):灌胃 1 X 鲜槟榔水提物,剂量为0.1 mL/(10 g·d),相当于70 kg成人每天食用4颗鲜槟榔;鲜槟榔高剂量组(A2):灌胃5 X鲜槟榔水提物,剂量为0.1 mL/(10 g·d),相当于70 kg成人每天食用20颗鲜槟榔。
1.4.3 样品采集
经过4周的灌胃饲养后,将小鼠摘眼球取血,脱颈处死后转移至冰上,快速解剖取其结肠内容物,分别收集于2 mL灭菌离心管中,-80℃保存待检测。将全血常温放置30 min,随后5 000 r/min离心5 min得血清,-20℃冻存备用。
1.4.4 小鼠免疫指标测定
将分装的冻存血清在4℃冰箱预解冻,拿出置于25℃室温下,随后使用相应的试剂盒分别测定其中IL-1、TNF-α、IgA、IgG、IgM 的含量。按要求将一系列标准品在450 nm处测定其吸光度,并拟合各成分的标准曲线。测定各样品吸光度,并依照标准曲线分别计算其含量。
1.4.5 DNA提取、扩增及高通量测序和分析
为提取冻存肠道内容物的DNA,针对16S rRNA基因V3~V4区合成带有barcode的特异引物341F(5'-CCTAYGGGRBGCASCAG-3') 和 806R(5'-GGACTACNNGGGTATCTAAT-3')并通过聚合酶链式反应(polymerase chain reaction,PCR)扩增。采用2%琼脂糖凝胶电泳检测PCR扩增产物,对目标片段进行切胶并用凝胶回收试剂盒(Axygen公司)回收。随后用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)定量检测PCR产物,使用Illumina PE250文库构建,再利用HiSeq PE250平台进行高通量测序及相应分析。
1.5 数据统计与分析
本次试验使用SPSS 21.0软件进行数据统计分析,采用单因素方差分析与Duncan检验方法检验多个试验组间样本的显著性。结果用平均值±标准差表示,视p<0.05为差异显著。
2 结果与讨论
2.1 小鼠采食与生长状况
不同组小鼠体重变化与进食量见表1。

表1 不同组小鼠体重变化与进食量Table 1 Weight gain and food intake of mice in different groups
由表1可以看出,3组小鼠在适应性喂养7 d后A1组与对照组间体重具有显著性差异,这种差异直到灌胃结束后的第4周依然存在。灌胃开始前F组小鼠与A2组小鼠体重无差异,到第4周时则是显著高于A2组,而A1和A2组从灌胃开始到第4周体重无显著差异。通过实验观察,A1与A2组小鼠在每次灌胃后半小时内会出现不同程度腹泻的现象并且A2组较A1组更为明显,这可能会影响小鼠的生长。然而分析小鼠灌胃期间各组体重的变化,比较发现体重增量在各组间并不具有显著差异。此外,分析各组小鼠第4周前3天进食量数据显示组间小鼠摄食量也无差异性。
2.2 免疫与炎症指标
各组小鼠血清促炎症因子水平见表2。
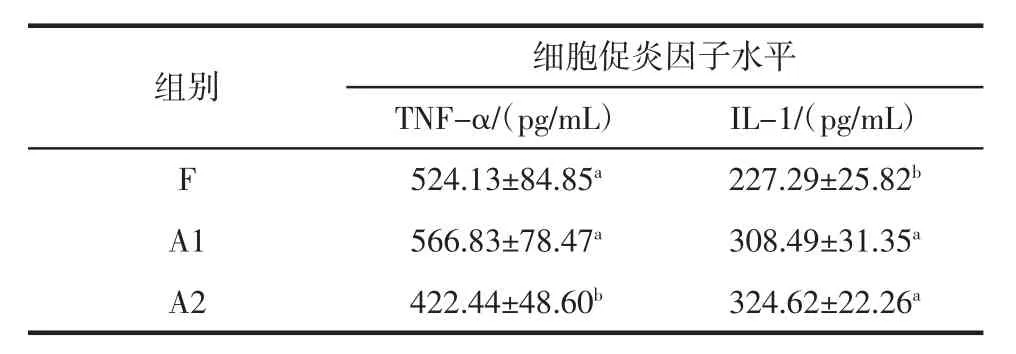
表2 各组小鼠血清促炎症因子水平Table 2 Serum pro-inflammatory cytokines level in different groups of mice
肿瘤坏死因子(tumor necrosis factor α,TNF-α)与白介素1(interleukin 1,IL-1)是重要的促炎症因子。IL-1在慢性炎症与组织修复过程中起着关键的作用,机体受到感染后巨噬细胞会分泌TNF-α,刺激其它促炎因子的产生并导致组织炎症的产生。由表2可以看出ANE灌胃小鼠两种炎症因子水平与对照组有显著性差异。在IL-1水平上,F组为227显著低于A1与A2组的308、324 pg/mL。在血清TNF-α含量上A2组显著低于A1与F组,相比A1与F组的566 pg/mL和524 pg/mL,其值仅为422 pg/mL。免疫球蛋白即浆细胞分泌的抗体,能直接与抗原结合从而有效地清除侵入机体内的微生物。3种小鼠免疫球蛋白的数据如图1所示。

图1 不同组小鼠3种免疫球蛋白含量的比较Fig.1 Comparison of three immunoglobulin contents in different groups of mice
A1与A2组小鼠IgA、IgG水平没有差异,并且显著低于F组。此外,A2组小鼠IgM水平明显高于A1与F组。
2.3 小鼠肠道菌群多样性与主坐标分析
基于高通量测序结果的结肠肠道菌群Alpha多样性分析见表3。
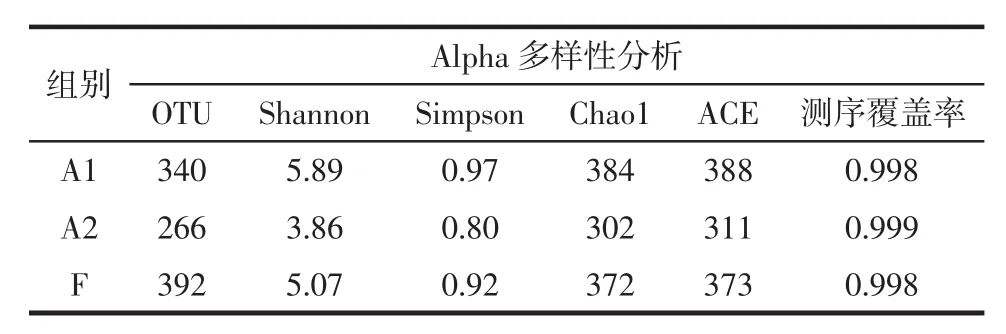
表3 基于高通量测序结果的结肠肠道菌群Alpha多样性分析Table 3 Alpha diversity analysis of colonic intestinal flora based on high throughput sequencing results
操作分类学单元(operational taxonomic unit,OTU)代表了样品中物种的丰度,结果分析得出对照组所含OTU最多为392而A2组仅为266。Shannon与Simpson指数代表了样本中菌群的多样性,较大的Shannon指数与较小的Simpson指数可以反应更高的菌群多样性。从表3中能看出,3组中A2的Shannon指数最小为3.86,A1组最大为5.89。Chao与Ace指数表征菌群的丰度,其数值越大表明菌群拥有更高丰度。比较3组数据,F与A1组的两指标均明显高于A2组,其Chao与Ace指数分别为302与311,这说明高剂量的槟榔提取液显著降低了小鼠的肠道菌群多样性。本次测序覆盖率均为0.99以上,这反映了样品中序列未被检测出的概率很低,可以很好的反应样品中微生物含量的真实情况。
主坐标分析(principal co-ordinates analysis,PCoA),是通过一系列的特征值和特征向量排序从多维数据中提取出最主要的元素和结构。选取贡献率最大的主坐标组合进行作图展示,样品距离如果越接近就表示物种组成结构越相似。因此群落结构相似度高的样品倾向于聚集在一起,而群落差异较大的样品则会远远分开。结果如图2所示。

图2 样本主坐标分析Fig.2 Principal co-ordinates analysis of mice colonic flora data
可以看出A1组与F组的3个样本主要集中在右下方,而A2组的3个样本则分布于左上方。这表明了A1组与F组菌群结构相似性较高,而A2组样本则与它们有较明显的差异。
2.4 小鼠肠道菌群结构分析
2.4.1 门水平菌群结构分析
通过相对丰度分析,可以找出分类学水平上占多数的菌门和菌属。不同组小鼠结肠门水平优势菌群见图3。

图3 不同组小鼠结肠门水平优势菌群Fig.3 Dominant flora in the colon of mice from different groups at the phylum level
如图各实验组中门水平上主要由酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、Saccharibacteria、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)与放线菌门(Actinobacteria)组成,它们在各组中占据了90%以上的相对丰度。可以看出灌胃不同剂量的槟榔液对小鼠门水平上的菌群结构产生了明显的改变。其中A2组相较于F组,疣微菌门产生了显著增加。此外,A1和F组相较于A2组小鼠肠道菌群,其中厚壁菌门与拟杆菌门的比例也有明显的差别。拟杆菌门与厚壁菌门共同促进人体对于糖类物质的分解利用,有研究表明,厚壁菌门与拟杆菌门丰度的比值在肥胖与正常体重个体中具有明显差异,这一比例的改变会影响机体对于食物中能量的吸收[7]。A2与A1组相比其中拟杆菌门相对丰度显著降低了,这使得A2组具有更高的厚壁菌门与拟杆菌门比例。实验过程中高剂量灌胃组小鼠腹泻表现最为明显,其摄食量数据分析结果并未显著高于其他两组,然而体重增加量却与之无明显差异,这说明厚壁菌门与拟杆菌门丰度比值增加可能导致了小鼠对于食物中能量利用率的提高。此外,A2与A1相比具有显著增加的疣微菌门与放线菌门丰度,这可能与这两种门下阿克曼菌属(Akkermansia)与Enterorhabdus菌属丰度显著增加有关。
2.4.2 属与种水平差异菌群分析
通过Metastat分析,属水平上相对丰度前十的菌属如图4所示。
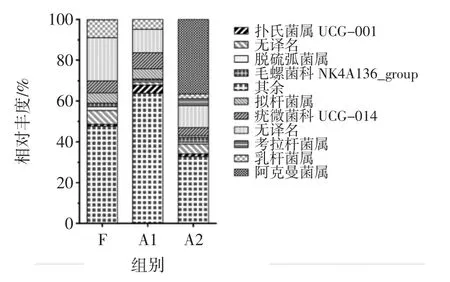
图4 不同组小鼠属水平优势菌群Fig.4 Dominant colonic flora of mice from different groups at the genus level
比较3组间菌属相对丰度的差别,可以看出A2组中阿克曼菌属与葡萄球菌属(Staphylococcus)含量相较A1与F组显著增加了。过往的研究表明阿克曼菌属是专门分解肠道中黏蛋白的一类细菌[8],并且它能在抗生素作用与肠道膳食营养减少的情况下增加其在肠道菌群中相对丰度[9-10]。小鼠在长期腹泻的情况下其肠营养受到影响而阿克曼菌可以通过不断分解黏蛋白提供能量,这可能是其相对丰度显著增加的原因之一。除这两种菌属显著增加之外,A2与A1组相比Enterorhabdus菌属的丰度也有显著的提高。对于Zn缺乏(Zn deficiency)患者的调查发现,长期腹泻会导致他们肠道Zn吸收功能的紊乱并因此患上锌缺乏症[11]。Sauer等[12]的研究表明轻微的Zn缺乏(marginally Zn deficiency,MZD)会导致小鼠肠道菌群结构的显著改变,并显著增加其中疣微菌门和Enterorhabdus菌属的丰度,这与本实验A2组小鼠长期腹泻和疣微菌门与Enterorhabdus菌属丰度显著增加的现象一致。Gaulke等[13]的试验表明MZD小鼠肠道菌群对砷暴露的敏感性会明显增加,在环境水平的砷影响下其肠道菌群结构便会明显改变,随着砷浓度的升高,阿克曼菌属丰度会显著增加而毛螺菌科(Lachnospiraceae)的丰度会显著减少。Rmalli[14]指出食用槟榔会增加人体对于砷、镉和铅的暴露,而本试验中A2与A1组相比其中毛螺科菌A2(Lachnospiraceae bacterium A2)丰度显著降低了。此外,Zn在维持和参与机体免疫功能方面具有重要的作用。锌的缺乏会导致机体免疫能力的紊乱,并促进肠道炎性反应[15]。而A2较A1组显著增加的Enterorhabdus菌属中的菌种如Enterorhabdus mucosicola和Enterorhabdus plexicaudatum都与肠道黏膜炎症和肠道上皮细胞屏障功能紊乱相关。葡萄糖硫酸钠(dextran sodium sulfate,DSS)处理的小鼠因其肠内和粪便中与黏膜相关的微生物菌群与炎性肠病患者中的相似。因而被广泛用于研究小鼠炎性肠病(inflammatory bowel disease,IBD)[16]。Berry 等[17]的实验发现,DSS诱导的结肠炎小鼠肠道中阿克曼菌属的丰度以及其黏蛋白降解相关的转录因子水平都显著增加了。这也进一步说明了A2组小鼠有结肠炎症发生的可能。
葡萄球菌属与细菌感染疾病息息相关,高通量测序发现A2组中松鼠葡萄球菌(Staphylococcus sciuri)丰度显著高于其它两组。在绝大多数情况下,松鼠葡萄球菌不是直接导致疾病的菌种,其检出往往发生在多菌种感染或者其它致病菌感染后[18]。因此,我们推测其含量的显著增加可能反应了肠道屏障功能的减弱与结肠感染的发生。值得注意的是,Ganesh等[19]也指出阿克曼菌属Akkermansia muciniphila菌种通过大量分解肠道黏蛋白削弱了肠道黏膜屏障,并促进了伤寒沙门氏菌(Salmonella typhosa)感染的IBD的产生。A2组葡萄球菌属与阿克曼菌属同时显著高于A1与F组,可能是其小鼠肠道中阿克曼菌属大量增加的结果。综上,高剂量灌胃小鼠可能出现了结肠炎症、感染与Zn缺乏的情况,它们与长期腹泻,肠道屏障功能削弱和砷暴露相关。
2.5 结合Alpha多样性分析和免疫指标的讨论
小鼠3种免疫球蛋白含量分析结果显示,A1组与F组相比IgA、IgG水平显著降低,这反映出低剂量槟榔水提液具有一定的免疫抑制作用。A2组IgA、IgG水平显著低于F组,而IgM水平显著高于F组,这与一种名为高免疫球蛋白M(hyper-immunoglobulin M syndrome,HIGM)的遗传免疫缺陷症状描述相吻合[20]。HIGM病症产生的原因在于机体参与B细胞信号传导、体细胞高频突变与DNA修复机制的一系列基因发生了突变[21]。不同的基因突变对于免疫系统的影响各不相同,并可能会导致截然不同的感染并发症。考虑到本实验各组小鼠均经过了随机分组,因此基本排除了小鼠个体天生免疫缺陷造成如此结果的可能性。然而无论是否为HIGM,这些结果都反映了小鼠免疫功能的紊乱。究其原因,可能在于槟榔中的某些化学成分如槟榔碱通过改变DNA甲基化水平、组蛋白修饰等表观遗传修饰途径,影响了基因的表达造成了小鼠表观遗传的变异,从而产生了与基因突变类似的表型[22]。大量研究发现表观遗传突变可早于遗传基因突变的发生,并能促进癌症的产生[23-24]。这些结果侧面反应了高剂量槟榔水提液对于机体可能的致癌性作用。
从小鼠两种促炎细胞因子IL-1与TNF-α的水平来看,A2组小鼠IL-1水平相较F组显著增加而TNF-α水平却显著低于另外两组。两种促炎因子水平的变化截然相反,这也反应出高剂量鲜槟榔水提液灌胃组小鼠免疫功能的紊乱。3组菌群的OTU分析表明,A2组小鼠菌群在多样性指标上明显低于其它两组。值得注意的是,大量关于IBD患者肠道菌群的研究显示具有IBD症状的个体肠内菌群的多样性较低,并且IBD个体会出现多种微量元素吸收异常的情况[25],这进一步暗示了A2组小鼠可能出现了结肠炎症与Zn缺乏的现象。
3 结论
实验结果表明低剂量槟榔水提物对小鼠免疫功能具有一定的抑制作用,对于肠道菌群无明显影响。而摄入高剂量的槟榔水提物能明显的扰乱小鼠免疫功能以及相关指标,显著改变其肠道菌群结构,造成长期腹泻以及可能的结肠炎症发生。可能的作用机理在于高剂量槟榔水提液中成分如槟榔碱的促肠蠕动作用等导致小鼠长期腹泻,改变肠道菌群、诱导肠道炎症产生与吸收紊乱,并可能造成微量元素如锌的缺乏,而诸如锌之类的微量元素在维持机体免疫力方面具有重要的作用。此外鲜槟榔水提液中成分众多,具体是槟榔中的哪些物质造成了本实验中的结果还有待后续针对性的研究。
