N2和CO2惰化丙烯爆炸极限参数实验研究
2020-05-28罗振敏杨勇程方明王涛常助川苏彬张蔓
罗振敏,杨勇,程方明,王涛,常助川,苏彬,张蔓
(1 西安科技大学安全科学与工程学院,陕西西安710054; 2 陕西省工业过程安全与应急救援工程技术研究中心,陕西西安710054; 3 陕西省煤火灾害防治重点实验室,陕西西安710054; 4 西安科技大学矿业工程博士后流动站,陕西西安710054)
引 言
丙烯是一种重要的易燃易爆化工生产原料,在现代化工行业中广泛应用[1-3]。在其生产、加工、储存、运输过程中的爆炸事故时有发生。2005 年美国德克萨斯州的台塑集团,某联合烯烃装置内发生了由丙烯泄漏引发的火灾,事故造成16名受轻伤,1名重伤[4]。2010 年江苏南京的某厂在拆迁过程中管道内丙烯泄漏引发了爆炸,事故造成22 人死,直接经济损失额度高达4784万元[5]。2014年台湾高雄前镇区丙烯泄漏引发的爆炸事故,致28 人死,287 人伤,外加2 人失踪,此外事故造成附近居民停气、停水、停电[6]。丙烯爆炸事故对人们的生命和财产安全造成极大威胁,因此开展丙烯等可燃气体的爆炸相关参数研究是很有必要的。爆炸极限和临界氧浓度是确定可燃性气体是否爆炸的重要安全参数,合理地控制爆炸极限参数可以有效地预防或减少爆炸事故的发生[7-8]。防止可燃性气体爆炸的措施有很多,其中惰化防爆是常用的一种防爆方法[9-10]。惰性气体因具有良好的惰化效果,且来源广泛,对环境无污染等特点而备受关注,其中N2、CO2惰性气体常被用于阻燃及可燃气体的惰化等方面。
学者们在可燃气体爆炸极限以及惰化方面开展了大量研究,并取得了一定成果。罗振敏等[10-12]通过实验研究发现N2可以减小CH4的爆炸极限范围,对于混有C2H6的CH4可燃混合气,则需要更多N2才能将其惰化;同时还利用实验和数值模拟方法研究了C2H6/C3H8混合气对CH4爆炸极限参数的影响规律,揭示其动力学特性。罗振敏等[13]和周宁等[14]利用N2和CO2对LPG 进行惰化抑爆效能实验,研究表明,N2和CO2都能缩小液化石油气的爆炸极限,但CO2对LPG 的抑爆性能优于N2。Benedetto 等[15]通过实验研究了CH4/O/N2/CO2和H2/O2/CO2混合物在不同CO2和O2情况下的爆炸行为,结果表明,降低CO2含量或者增加O2含量会使最大压力和最大压力上升速率显著增加,而增加CO2含量则会使层流燃烧速度降低至熄灭。Andrés 等[16]研究了可燃-惰性气体(CO2和N2)-空气混合物在25℃和0.1 MPa 压力下的爆炸极限,并提出一种方法来测定FIP 中可燃惰性混合物中的惰性气体摩尔分数。张增亮等[17]通过研究可燃气体(液体蒸气)的爆炸极限及最大允许氧含量,指出爆炸极限与最大允许氧含量是衡量可燃气体爆炸危险性的两个重要参数。Ma 等[18]和任韶然等[19]在其研究中发现,惰性气体(CO2和O2)可以减小可燃气体的爆炸极限,降低爆炸危险性,但CO2的惰化效果要优于N2。钱新明等[20]采用改进的Hartmann 管测试研究了室温常压下含二氧化碳天然气的可燃极限及燃爆压力,得到了含二氧化碳天然气在三角坐标系下的可燃性图表和燃爆压力的变化规律。Deng 等[21]对采空区的混合气体的爆炸极限进行了研究,发现惰性气体(氮气、二氧化碳)对混合性气体的爆炸有一定的抑制作用。
国内外学者针对丙烯爆炸也做了相关的研究。van den Schoor 等[22]在200 mm 的封闭容器内对丙烯/空气、乙烷/空气、丙烷/空气、正丁烷/空气和乙烯/空气混合物的爆炸上限进行了测试,发现爆炸上限与所测试时的环境温度及压力有关。刘姝廷等[23]采用了KPLS 算法预测了丙烯的爆炸极限,并验证了该算法的有效性且确定了丙烯的爆炸区域为2.56%~9.25%。王振刚等[24]通过实验研究发现,丙烯/空气混合气的爆炸上限比其爆炸下限更容易受到温度、压力和氧含量的影响。王康等[25]通过研究氧含量对甲烷及丙烯爆炸特性的影响发现,氧气含量增加会使丙烯的爆炸极限范围增大,氮气含量增加则会缩小丙烯爆炸范围。以上对丙烯的研究主要集中在改变初始温度或压力的情况下研究其氧含量对爆炸特性的影响,然而对于惰性气体对丙烯爆炸极限参数影响的研究较少。基于此,本文在前人的研究基础上,开展了惰性气体N2和CO2在常温常压状态时丙烯的爆炸极限参数的惰化研究。通过实验得到丙烯爆炸极限参数变化规律及N2和CO2的惰化效果,进一步为工业丙烯安全防爆工作提供理论指导。
1 实验装置及工况
1.1 测试装置
本实验爆炸极限测试系统为HY12474C 型可燃性气体爆炸极限测定装置,符合标准GB/T 12474—2008,实验装置如图1 所示,系统主要由爆炸反应管、压力传感器、点火电极、电磁阀、真空泵、循环泵和显示屏等组成。石英管内径60 mm,长1400 mm。管道底部装有通径不小于25 mm 的泄压阀,点火装置在反应管横截面中心且距底部不小于100 mm。
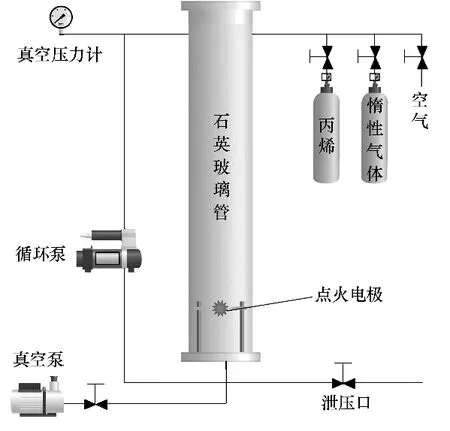
图1 实验装置示意图Fig.1 Schematic diagram of experimental device
1.2 实验工况
实验温度为20~27℃,湿度为30%~60%,初始压力为常压。实验用丙烯纯度为99.9%,氮气纯度为99.9%,二氧化碳纯度为99.9%。实验装置可由计算机自动控制完成分压法配气、循环搅拌、点火等步骤,配气精度为0.1%,采用300 VA 电压互感器作为点火电源,电极间距3 mm,放电时间0.1~1 s 可调。实验添加的惰性气体为CO2和N2,实验测试流程如文献[26-27]所述。实验测试时,首先抽真空,然后按照分压法配制所需比例待测混和气,经循环搅拌后由点火电极点火,最后观察混合气体在爆炸管中被电火花引燃后,管道中是否有火焰传播来判定最终是否发生爆炸,采用渐进逼近法,最终得到火焰刚好传播和刚好不能传播的丙烯浓度,取二者的平均值作为最终的爆炸极限测定值。在同一条件下,每组实验均进行3次实验测定。
2 实验结果与讨论
2.1 N2和CO2对丙烯爆炸极限及危险度的影响
实验测得丙烯在空气中的爆炸极限为3.1%~13.8%。通过在丙烯中分别加入不同浓度(本文浓度用体积分数表示)的N2(5%、15%、25%、35%、40%、42%、43%、44%、45%、47%、48%、49%)和CO2(5%、15%、25%、30%、32%、33%、34%)测试丙烯爆炸极限的变化情况,并确定其爆炸临界氧浓度。本文选用7组不同浓度的丙烯(4.2%、4.3%、4.4%、5%、7%、9%、11%),研究其爆炸最小氧浓度及N2和CO2临界添加量变化情况。
实验测得了N2和CO2惰化条件下丙烯的爆炸极限,同时根据式(1)计算丙烯的爆炸危险度[28],考察惰性气体对丙烯的爆炸危险性的影响,结果如图2所示。爆炸危险度计算公式为
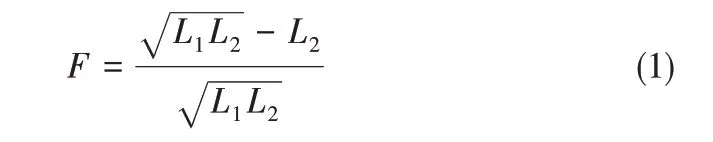
式中,F 是爆炸危险度,在0~1 之间,值越大说明危险度越大;L1、L2分别是爆炸上限和爆炸下限。
图2中,随着惰性气体的增加,丙烯爆炸极限范围相应变窄,爆炸危险度也逐渐减小,最终分别在N2添加量为49%,CO2的添加量为34%时,丙烯爆炸上下限重合(爆炸临界状态),此时CO2的添加量明显小于N2的添加量,而丙烯对应的浓度均为4.4%,爆炸危险度F 为0,说明惰性气体对丙烯起到了惰化效果,降低了爆炸的危险性。此外,随着N2和CO2的增加,丙烯爆炸下限会略微升高,而爆炸上限明显降低,说明惰性气体对爆炸上限的影响更显著。丙烯爆炸下限升高主要是由于惰性气体的加入稀释了体系中丙烯的浓度,使得丙烯分子与氧气分子发生反应的机会减少,同时N2或者CO2加入,起到了屏障作用,隔离了丙烯与氧气,导致体系中活化分子与N2和CO2分子发生碰撞机会增加,丧失活性的可能性增大,进而反应不能继续,因此需要提高丙烯浓度才能发生爆炸。而丙烯爆炸上限降低是因为添加惰性气体减少了体系氧气含量,且惰性气体具有降温吸热的作用,降低了体系内活化分子的活性。
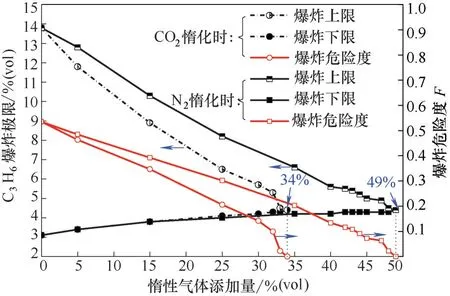
图2 丙烯的爆炸极限及爆炸危险度的变化曲线Fig.2 Explosion limits and explosion risk value of propylene with dilution of CO2 and N2
2.2 N2和CO2对临界氧浓度的影响
图3 是N2和CO2惰化条件下丙烯爆炸极限对应的氧浓度变化曲线。由图2 和图3 可以看出,丙烯爆炸极限对应的氧浓度变化规律与惰性气体对爆炸极限影响规律相似。随着惰性气体添加量的增大,丙烯爆炸极限对应的氧浓度在逐渐减小。当惰性气体添加到一定量时,丙烯爆炸达到临界状态,爆炸上下限对应氧浓度重合于一点,该点为临界氧浓度。图3 中,惰性气体浓度低于33%时,N2和CO2对丙烯爆炸下限对应氧浓度的影响基本相同,但CO2对丙烯爆炸上限对应的氧浓度影响较大,上下限对应的氧浓度比N2的提前重合,临界氧浓度为12.94%,而N2惰化条件下临界氧浓度为9.79%,从临界氧浓度数值来看,CO2惰化丙烯比N2惰化丙烯时的临界氧浓度提高了约3.15%。分析原因是爆炸上限处氧浓度较低,使用N2和CO2惰化丙烯时,使得体系中氧浓度被稀释,丙烯分子与氧气分子发生反应的机会减少,体系中活化分子与N2和CO2分子发生碰撞机会增加,丧失活性进而中断反应,其中CO2的惰化作用强于N2,与丙烯反应时添加CO2比N2更加能影响爆炸上下限对应氧浓度,从而提高了临界氧浓度点。
2.3 N2和CO2对最小氧浓度的影响
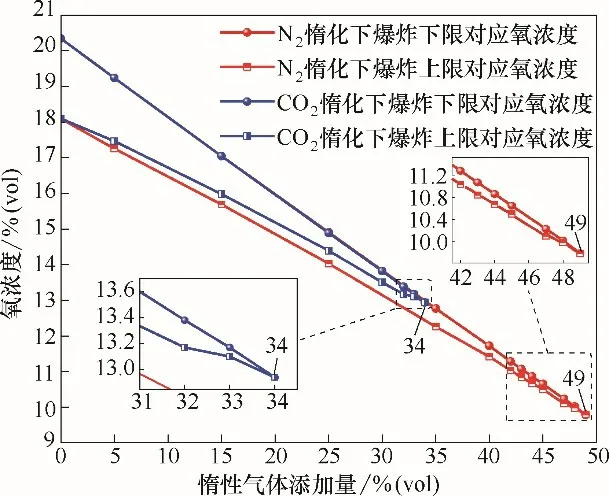
图3 惰性气体对丙烯爆炸极限对应氧浓度的影响Fig.3 Critical oxygen concentration of propylene with dilution of CO2 and N2
图4所示是丙烯最小氧浓度与惰性气体临界添加量变化曲线,图中添加N2和CO2对丙烯最小氧浓度变化趋势的影响是一致的,但影响的程度却不同。最小氧浓度呈现先减少后增大的趋势,在丙烯浓度为4.4%时,最小氧浓度及惰性气体临界添加量的图都出现了转折,变化的原因是,爆炸下限附近氧气充足,是否发生爆炸取决于丙烯浓度,而N2和CO2本身具有较强吸热作用,加入后降低了反应体系的温度导致最小氧浓度出现下降趋势。随着丙烯浓度增加,体系中氧浓度逐渐减少,添加一定量的N2和CO2使得丙烯不发生爆炸,在靠近爆炸上限处氧气严重缺乏,加入惰性气体后其稀释作用起主要作用,稀释了体系中的氧浓度并隔离了氧分子与丙烯分子。因此,在增大丙烯浓度时需要降低惰性气体的添加量,保证体系中氧浓度刚好维持爆炸,转折点的氧浓度正好是丙烯在惰化下的临界氧浓度,说明临界氧浓度是爆炸范围里所有最小氧浓度中最小的,这与文献[7]研究结果是一致的。
图4 中,在CO2惰化条件下,丙烯最小氧浓度值均高于N2惰化条件下的最小氧浓度值,说明添加CO2比N2提高了最小氧浓度值,CO2惰化效果更好。而当满足丙烯刚好能维持发生爆炸反应进行所需的最小氧浓度时,CO2的临界添加量始终低于N2的临界添加量,也说明CO2比N2的惰化效果好。
2.4 丙烯爆炸三角形分析
依据上述实验结果中的丙烯爆炸上下限、临界氧浓度等参数,绘制了在CO2和N2惰化下丙烯爆炸三角形图,见图5,以便更加直观地比较CO2和N2对丙烯的惰化效果。图中关键点的具体物理意义如下:A(A′)点为丙烯在空气中的氧浓度,B(B′)点和C(C′)点分别是空气中丙烯爆炸上限、上限值对应的氧浓度,D 点为CO2惰化丙烯的临界氧浓度,D′点为N2惰化丙烯的临界氧浓度,E 点是AD 延长线与横坐标交点,E′点是A′D′延长线与横坐标交点,直线ABC(A′B′C′)为空气组分线,表示空气中不同浓度的丙烯对应的氧浓度。图中空气线以下区域可划分为4个区域:1 区(△BCD、△B′C′D′)为丙烯爆炸区域,2区(△ABD、△A′B′D′)为低浓度丙烯不爆区域,3 区为低氧浓度下丙烯不爆区域,4 区(△AOE、△A′OE′)为安全区域,丙烯处于完全惰化状态,该区域惰性气体与丙烯的浓度比均大于窒息比[29](窒息比是指丙烯处于临界爆炸状态时惰性气体与丙烯的体积比)。
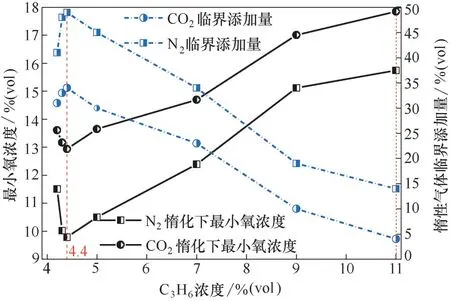
图4 最小氧浓度与惰性气体临界添加量Fig.4 Minimum oxygen concentration and critical addition of dilution of CO2 and N2
由图可知,△BCD面积明显小于△B′C′D′面积,即添加CO2丙烯爆炸区域明显缩小,这是CO2降低丙烯爆炸上限、提高爆炸下限的直接体现。其次,图中D 点高于D′点,这是CO2惰化丙烯提高了临界氧浓度的直观表达,也说明添加CO2比N2更能提高临界氧浓度值,降低丙烯爆炸可能性。对比△ABD 和△A′B′D′发现2 区仅略微缩小,此区域的丙烯浓度低,不容易进入可爆区。3 区也有所缩小,在该区域内因为氧气浓度低也不容易进入可爆区。4 区内丙烯处于完全惰化状态,CO2惰化条件下4区面积明显扩大,是因为窒息比减小了(CO2惰化条件下窒息比为7.73,N2惰化条件下的窒息比为11.14),说明添加较少的CO2就能使丙烯处于完全惰化状态而需更多的N2才可以达到相同的惰化效果,所以CO2比N2惰化效果更显著。
2.5 CO2和N2的惰化机理分析
对比爆炸极限、危险度、临界氧浓度、最小氧浓度以及惰性气体临界添加量,都说明了CO2的惰化效果优于N2,从惰化机理分析,主要原因如下。
(1)从惰性气体本质属性来说,CO2的分子直径为5.1×10-10m,N2分子直径为3.1×10-10m,相比之下,CO2分子直径较大,表面积较大,与活性分子碰撞机会增加,消耗的活性分子更多[30](图6)。在相同实验条件下,CO2体系比N2体系中的化学反应受到阻碍更大,依据分子碰撞理论,CO2加入后在分子的碰撞过程中,链式反应中的活化自由基的能量转移到CO2上,其活性降低以致爆炸能量不能传播,爆炸反应不能进行,CO2惰化作用更明显[31]。
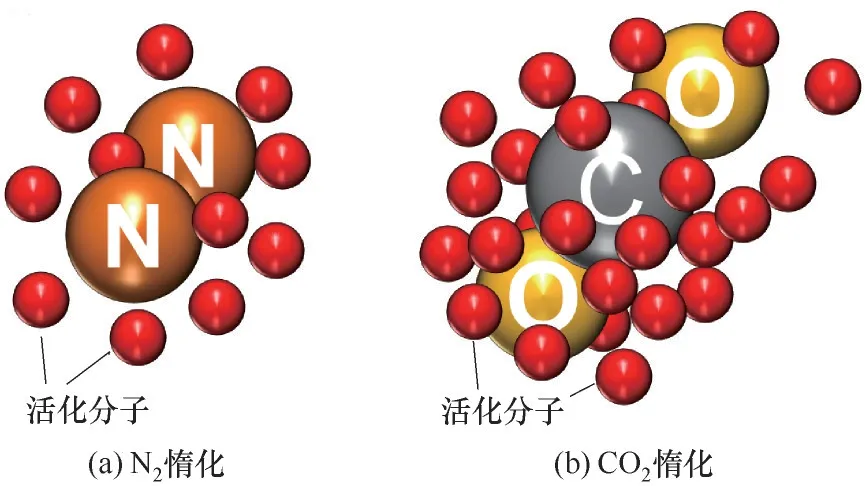
图6 不同惰性气体与活化分子碰撞Fig.6 Collision of different inert gases with activated molecules
(2)反应动力学理论层面,CO2和N2惰性气体作为第三体参与链式反应中自由基、分子的碰撞,消耗了关键组分,延缓了爆炸反应进程[31]。从轻烃组分燃烧化学式分析,CO2是轻烃燃烧的产物组分,添加CO2等于增加了反应生成物量,根据化学平衡原理,反应将逆向进行,从而在某种程度上减缓了反应的进程。而N2的物理性质更稳定,常温常压下很难发生反应[32]。
(3)根据气体动理论,处于平衡状态下的气体分子,每一个自由度所具有的平均能量都相等。而CO2和N2均可认为是理想气体,其中CO2为多原子分子,自由度为6,N2为刚性双原子分子,自由度为5,CO2的 比定容热 容 大于N2
[33]。而根 据Matheson 气 体数据手册[34],室温(25℃)下CO2的气体摩尔定压热容为38.42 J·mol-1·K-1,N2的 气 体 摩 尔 定 压 热 容 为29.07 J·mol-1·K-1,很明显CO2的比热容大于N2。因此同等实验环境下,如图7所示,CO2吸热量比N2多,使得体系温度降得更快[30],故CO2对丙烯爆炸极限上限、上限对应氧浓度、最小氧浓度的影响相对氮气更明显。
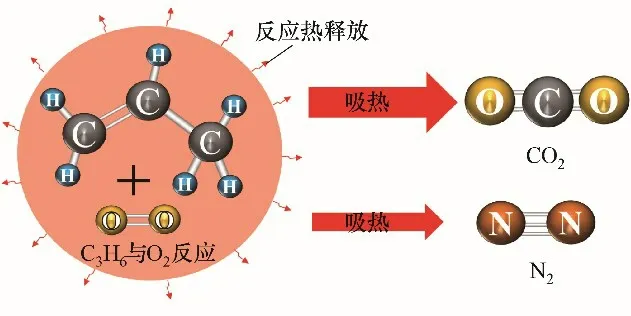
图7 不同惰性气体的吸热能力Fig.7 Heat absorption capacity of different inert gases
3 结 论
(1)CO2和N2都可以缩小丙烯爆炸极限范围,且影响趋势具有一致性。逐渐添加CO2和N2,丙烯的爆炸上限近似呈线性下降,下限略微升高。当N2惰化丙烯时,N2添加量为49%使得爆炸上下限重合,临界氧浓度为9.79%;CO2惰化丙烯时,CO2的添加量为34%,临界氧浓度为12.94%。
(2)CO2和N2都对丙烯爆炸有良好的惰化效果,但通过对比爆炸极限、临界氧浓度、最小氧浓度、惰性气体临界添加量、窒息比及爆炸三角形,发现CO2比N2的惰化效果更显著。要控制丙烯爆炸的危险性,可以通过控制混合反应体系中丙烯浓度在爆炸下限以下或者反应体系中氧浓度小于临界氧浓度或最小氧浓度。采用惰性气体惰化丙烯时,CO2的惰化效果相对较好。
(3)CO2的惰化效果优于N2的原因主要有CO2的分子表面积大,与活化分子分子碰撞的机会多;化学反应过程中,加速逆反应进行;作为第三体参与自由基反应,破坏活化分子能力强,而且它的比热容较大,吸热降温能力强,使得体系中温度降低的幅度大。
