卵巢肿瘤组织中CXCL9mRNA表达与患者的预后、免疫微环境特征的相关性研究
2020-05-28
上海交通大学医学院附属仁济医院妇产科,上海市妇科肿瘤重点实验室,上海 200127
在妇科恶性肿瘤中,卵巢癌的恶性程度及死亡率均位列第一[1]。由于卵巢癌起病隐匿且缺乏早期检测方法,超过70%的患者在初诊时即已发生癌细胞转移。尽管晚期卵巢癌患者可从肿瘤细胞减灭术及紫杉醇联合铂类一线化学治疗(化疗)中获益,但75%以上的晚期患者仍会复发并最终导致死亡[2]。已有研究[3]证实卵巢癌的微环境免疫特征与患者预后密切相关,即与无肿瘤浸润淋巴细胞(尤其是CD3+T细胞)的卵巢癌患者相比,存在有该细胞的卵巢癌患者的5年生存率提高了8倍(4.5%vs38%)。
在肿瘤微环境中,免疫细胞的迁移及激活与趋化因子家族密切相关。其中,趋化因子CXCL9(C-X-C motif chemokine ligand 9)及相关趋化因子受体CXCR3(C-X-C motif chemokine receptor 3)发挥了至关重要的作用[4-6]。CXCL9是一种响应干扰素γ(interferon-γ,IFN-γ)诱导且参与免疫炎症反应相关细胞生长、迁移及激活的趋化因子。当CXCL9与表达于单核细胞、激活T细胞、自然杀伤细胞(natural killer cell,NK cell,简称NK细胞)、树突状细胞(dendritic cell,DC)表面的CXCR3相结合,可介导淋巴细胞浸润至病灶部位以发挥免疫细胞抗肿瘤功能。在稳态中,CXCL9于单核细胞、内皮细胞和成纤维细胞中低水平表达,但在IFN-γ和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等细胞因子刺激下其表达将显著上调[4,7-8]。Gorbachev等[9]对小鼠体内的研究发现,与表达CXCL9的肿瘤细胞相比,存在CXCL9表达缺陷的肿瘤细胞具有更强的成瘤性,继而推测CXCL9表达缺失是肿瘤细胞逃避抗肿瘤免疫反应的一种机制。研究者对肿瘤微环境进一步分析发现,CXCL9表达受IFN-γ诱导上调,并能够与T、B和NK细胞表达的CXCR3结合以募集淋巴细胞至肿瘤微环境[5-6]。同时有较多实验[10-12]表明,CXCL9表达不足会大大削弱免疫细胞介导的抗肿瘤免疫反应。
基于此,本研究以癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中卵巢癌组织测序数据集进行生物信息学分析,探究CXCL9mRNA表达对总体生存期的影响,并通过基因集富集分析(Gene Set Enrichment Analysis,GSEA)挖掘CXCL9mRNA在卵巢癌中的生物学功能,分析CXCL9mRNA表达与细胞分化抗原8A(cluster of differentiation 8A,CD8A)及免疫检查点的mRNA表达的相关性,以期为免疫检查点阻断治疗卵巢癌的生物标志物研究提供可能性依据。
1 资料与方法
1.1 数据来源
UCSC(https://xenabrowser.net/datapages/)是一个被公认的能够对TCGA数据进行标准化清洗与处理的网站。本研究从该网站下载获得由AffyU133A基因芯片测量得到的TCGA浆液性卵巢癌数据集。同时,本研究使用的另一部分数据来源于R包curatedOvarianData[13],共包含来自23项研究中的2 970个患者的基因表达谱数据及生存数据,其中有16组研究的样本表达谱和患者生存数据可用于计算中位生存期,具体数据集包括E.MTAB.386、GSE13876、GSE14764、GSE17260、GSE18520、GSE19829、GGSE26193、GSE26712、GSE30161、GSE32062、GSE49997、GSE51088、GSE9891、PMID17290060c、TCGARNAseqV2、TCGA。
1.2 CXCL9 mRNA表达及其与总体生存期的相关性分析
采用Log-rank检验法对来自GEPIA(Gene Expression Profiling Interactive Analysis,GEPIA)网 站[14]的TCGA浆液性卵巢癌组织与癌旁组织中CXCL9mRNA的表达情况进行分析。根据CXCL9的每千个碱基的转录每百万映射读取的转录本(transcripts per kilobase of exon model per million mapped reads,TPM)中位数,将424个浆液性卵巢癌组织分为CXCL9低表达组(212例)与CXCL9高表达组(212例)。采用Kaplan-Meier法分析2组组织中CXCL9mRNA表达对卵巢癌患者总体生存期的影响。同时,本研究使用由R包curatedOvarianData[13]内含的卵巢癌样本数据及其相应临床数据绘制森林图,探究大样本基数下CXCL9mRNA对卵巢癌患者总体生存期的影响。
1.3 GSEA
于GSEA门户网站(https://www.gsea-msigdb.org/gsea/index.jsp)下载GSEA软件[15]。GSEA是一种计算方法,用来确定一组先验基因在2种生物状态之间是否表现出统计学上的显著一致性差异。GSEA软件包含分子签名(Molecular Signatures Database,MSigDB)数据库,研究人员可以从该数据库中选择感兴趣的功能基因集进行分析。本研究选用GSEA软件内附带的MSigDB数据库中的c2.cp.kegg.v.7.0功能基因集,将TCGA浆液性卵巢癌数据集全基因表达谱作为输入文件,计算c2.cp.kegg.v.7.0功能基因集中各生物学通路在CXCL9高表达组与CXCL9低表达组中的差异,最终得出基因集在2组中的富集评分。
1.4 CXCL9 mRNA表达与CD8A及免疫检查点mRNA表达的相关性分析
使用在线分析网站GEPIA的correlation功能,计算CD8A、程序性死亡受体-1(programmed death-1,PD-1)、程序性死亡配体-1(programmed death ligand-1,PD-L1)、细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyteassociated protein 4,CTLA4)的mRNA表达与CXCL9mRNA表达之间的关系。将log2(CXCL9TPM)作为X轴,依次将log2转换后的CD8A、PD-1、CTLA4及PD-L1的TPM值作为Y轴,使用Pearson相关分析研究其表达间的相关性,并采用t检验判定该相关性是否具有显著意义。
2 结果
2.1 预后相关预测因子分析
本研究针对GEPIA网站提供的TCGA浆液性卵巢癌组织和癌旁组织的CXCL9mRNA表达数据进行分析,结果(图1A)显示CXCL9mRNA在卵巢癌组织中的表达水平较高(P<0.05),继而提示CXCL9表达具有肿瘤组织特异性。随后,使用Kaplan-Meier法评估CXCL9高表达组与CXCL9低表达组的生存曲线,结果(图1B)显示在TCGA浆液性卵巢癌数据中,CXCL9是浆液性卵巢癌预后良好的预测因子(Log-rankP=0.010)。

图1 CXCL9 mRNA在TCGA浆液性卵巢癌组织中的表达情况及总体生存期分析Fig 1 Analysis of CXCL9 mRNA expression and overall survival in TCGA serous ovarian cancer tissues
由于TCGA数据库中的卵巢癌样本均为浆液性卵巢癌,为扩大卵巢癌的组织学类型,本研究使用R包curatedOvarianData中的16组研究的样本表达谱及患者生存数据进行进一步分析,即将趋化因子CXCL9表达作为整体生存的单变量预测因子并绘制森林图;其中,风险比(hazard ratio,HR)>1表示CXCL9mRNA表达与预后不良相关,HR<1则表示与预后良好相关。结果(图2)显示仅有GSE19829、GSE14764、GSE26193数据集的HR>1,提示CXCL9mRNA表达或与卵巢癌预后不良相关。
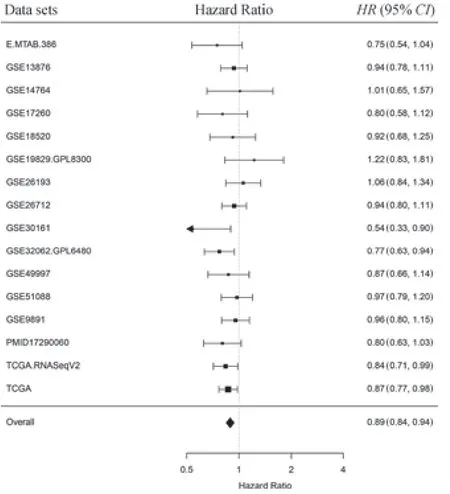
图2 卵巢癌数据集中CXCL9 mRNA表达与总体生存期的森林图Fig 2 Forest plot of the expression of CXCL9 mRNA in ovarian cancer datasets
2.2 CXCL9 mRNA表达在TCGA浆液性卵巢癌组织中的生物学功能分析
本研究使用TCGA 浆液性卵巢癌数据集,根据 GSEA中的c2.cp.kegg.v.7.0 功能基因集对CXCL9高表达组与CXCL9低表达组的组织进行富集分析,结果(图3)显示与免疫细胞迁移、激活有关的功能通路在CXCL9高表达组中的表达均较高,而在CXCL9低表达组中则较低;继而提示,CXCL9mRNA表达主要与细胞因子及其受体相互作用通路、NK细胞介导的细胞毒性通路、Janus激酶(Janus kinase,JAK)-信号转导子和转录活化子(signal transducer and activator of transcription,STAT)信号通路、白细胞跨膜通路、T细胞受体信号通路以及抗原加工与提呈通路显著相关;从而推断,在卵巢癌微环境中,CXCL9mRNA高表达或对免疫细胞迁移、激活等功能发挥重要作用。

图3 GSEA研究CXCL9 mRNA表达在TCGA浆液性卵巢癌组织中的生物学功能Fig 3 Analyze the biological function of the expression of CXCL9 mRNA in TCGA serous ovarian cancer tissues by GSEA
2.3 CXCL9 mRNA表达与CD8A及免疫检查点mRNA表达的相关性分析
运用Pearson相关分析对TCGA浆液性卵巢癌肿瘤组织中CXCL9与CD8A、PD-L1、PD-1及CTLA4mRNA表达的相关性进行分析,其中R代表Pearson相关系数,表示两者mRNA间的线性关系(即最大正相关为1、最大负相关为-1)。结果(图4)显示,CD8A、PD-L1、PD-1及CTLA4mRNA均与CXCL9mRNA表达存在显著的线性正相关(均P<0.05),其中CTLA4、CD8A、PD-1的表达分别与CXCL9表达的线性相关系数均较高(R>0.7)。

图4 CXCL9与CD8A、CTLA4、PD-1及PD-L1 mRNA表达的相关性分析Fig 4 Correlation of mRNA expression levels of CXCL9 and CD8A, CTLA4, PD-1 and PD-L1
3 讨论
过往研究已证实卵巢癌是一种免疫原性肿瘤,该肿瘤组织中的肿瘤浸润淋巴细胞数目与患者的预后呈正相关。除肿瘤浸润淋巴细胞数目外,肿瘤微环境中免疫效应细胞与抑制细胞的比例、免疫细胞浸润位置及免疫细胞激活程度也是影响该患者预后及临床免疫治疗应答的重要因素。趋化因子CXCL9的表达与肿瘤微环境中的免疫细胞迁移、分化及激活密切相关,且对表达CXCR3的CD8+T细胞、Th1细胞、细胞毒性T细胞和NK细胞的抗肿瘤免疫反应具有积极影响[9-11]。
研究[16-17]显示,CXCL9的高度表达与肾癌、胰腺导管腺癌等多种恶性肿瘤的总体生存期延长相关。有研究[16]使用免疫组织化学技术(免疫组化)对CXCL9在肾癌组织中的表达进行检测,结果发现CXCL9的表达量与肿瘤大小、肿瘤微血管密度均呈负相关,与CD8+T细胞在肿瘤中的浸润数量呈正相关。Bronger等[18]对184例高级别浆液性卵巢癌的CXCL9、CXCL10表达进行免疫组化分析,并使用CD3、CD56和FOXP3荧光抗体标记细胞以评估肿瘤浸润淋巴细胞的数量;结果表明,CXCL9高表达是晚期高级别浆液性卵巢癌的有利预后因素,并推测CXCL9对肿瘤抑制性免疫细胞的趋化性募集可能是导致卵巢癌预后良好的原因。本研究中,我们根据TCGA浆液性卵巢癌数据集中CXCL9mRNA的TPM中位数将TCGA数据集分为CXCL9低表达组和CXCL9高表达组,并通过Kaplan-Meier法对2组的总体生存期进行分析,结果显示CXCL9高表达组与预后良好显著相关。为进一步扩大样本量、减少抽样误差,本研究对16组研究的样本表达谱及患者生存数据中CXCL9mRNA表达与总体生存期间的关系进行综合分析,结果发现其表达亦与卵巢癌预后良好显著相关。
目前,卵巢癌的死亡率位居妇科恶性肿瘤之首,且其患者总体生存期在过去30年间并没有得到显著提升,而以铂类及紫杉醇类药物为基础的化疗方式也一直未得到有效突破,因此急需探索除传统化疗之外的治疗方法,如免疫治疗。迄今已有多个临床试验证实,PD-1单抗在黑色素瘤、非小细胞肺癌、膀胱癌等多种肿瘤中具有显著的临床效果,而在卵巢癌中使用PD-1单抗单药治疗的客观缓解率较低(为10%~15%)。因此,探索预测卵巢癌PD-1/PD-L1阻断治疗的生物标志物以有效筛选潜在获益人群,成为了研究者们的共识。截至目前,大量研究已发现多种因素可影响PD-1单抗的药物有效性,包括肿瘤微环境中抗肿瘤免疫细胞浸润的数量与位置[19]、肿瘤负荷[20]、PD-L1表达水平[21]、抗原提呈缺陷[22]、干扰素信号传导[23]及错配修复缺陷[24]等。肿瘤组织PD-L1表达是目前应用范围最广的免疫检查点抑制剂生物标志物,但就卵巢癌而言,即便是PD-L1阳性表达的人群,其对PD-1单抗的应答率依然较低。KEYNOTE-028临床试验[25]是一项关于PD-1单抗pembrolizumab的一期临床试验,该试验共纳入26例PD-L1阳性(PD-L1表达≥1%)的晚期卵巢癌患者,患者每2周接受1次pembrolizumab治疗(10 mg/kg),持续24个月;结果显示,其最终客观缓解率为11.5%(1例完全缓解、2例局部缓解),中位无进展生存期及中位生存期分别为1.9个月和13.8个月。为进一步探究pembrolizumab在晚期卵巢癌患者中的疗效,KEYNOTE-100临床试验[26]中入组376例复发性晚期卵巢癌患者,每3周接受1次pembrolizumab静脉注射(200 mg);截至目前,该试验中总人群的客观缓解率仅为8%,其中PD-L1表达联合阳性评分(combined positive score,CPS) <1的患者的客观缓解率仅为5.0%,而CPS≥1(或CPS≥10)的患者的客观缓解率也同样较低,分别为10.2%(或17.1%)。该研究一方面提示在卵巢癌中PD-L1的表达水平与pembrolizumab疗效具有一定的相关性,即PD-L1表达评分高的患者,采用pembrolizumab治疗具有相对更高的客观缓解率;另一方面亦提示即使将PD-L1表达CPS≥10作为筛选患者的阳性阈值,该人群的客观缓解率依然不高。因此,在卵巢癌中为进一步精准筛选PD-1/PD-L1阻断治疗潜在获益人群,急需探索其他生物标志物以更有效筛选患者。
综上所述,在卵巢癌PD-1/PD-L1阻断治疗中,除进一步完善PD-L1等生物标志物的应用外,探索其他预测PD-1/PD-L1阻断治疗的生物标志物,或寻找新的生物标志物与已有标志物联合使用成为了当下亟待解决的问题。本研究中,我们通过GSEA研究发现CXCL9mRNA主要富集于细胞因子及其受体相互作用通路、NK细胞介导的细胞毒性通路、JAK-STAT信号通路、白细胞跨膜通路、T细胞受体信号通路以及抗原加工与提呈通路等。这些通路均参与了肿瘤浸润淋巴细胞迁移、分化及激活等重要的抗肿瘤免疫生物学功能,继而提示CXCL9在卵巢癌抗肿瘤免疫应答中发挥着多重效应;此外,本研究通过Pearson相关分析发现,CXCL9mRNA表达与CD8A及免疫检查点mRNA表达呈正相关。目前研究[27]认为肿瘤微环境中PD-L1、PD-1等免疫检查点mRNA表达主要受与JAKSTAT通路相关的IFN-γ下游调节,而CXCL9是IFN-γ诱导产生的趋化因子,因此CXCL9与免疫检查点的mRNA的表达呈正相关可能与其两者皆受IFN-γ调控相关。根据以上结果推测,在CXCL9高表达组的免疫微环境中或存在高表达的CD8+T细胞及PD-L1。Teng等[28]针对免疫治疗提出了一种肿瘤微环境的免疫分型(tumor microenvironment immune type,TMIT),该分型基于肿瘤PD-L1表达及肿瘤淋巴细胞浸润(tumor-infiltrating lymphocyte,TIL)情况将肿瘤分成4型,包括Ⅰ型TIL+PD-L1+(适应性免疫抵抗型)、Ⅱ型TIL+PD-L1-(免疫豁免型)、Ⅲ型TIL-PD-L1+(内源诱导型)和Ⅳ型TIL-PD-L1-(免疫耐受型)。由于PD-L1与TIL双阳性是免疫检查点通路参与肿瘤内浸润T细胞程序化死亡的最有力证据,使得Ⅰ型肿瘤被认为是最有可能受益于PD-1/PD-L1阻断治疗的分型。Kryczek等[29]研究显示,CXCL9表达与CD8+T细胞浸润显著相关;且表达CXCR3的免疫细胞(如NK细胞[11]、Th1细胞[30])也均被证明,其可通过CXCR3依赖的方式被CXCL9-CXCR3轴募集到肿瘤所在部位。综合上述研究可以推断,本研究中的CXCL9高表达组卵巢癌组织或存在Ⅰ型(TIL+PD-L1+)肿瘤免疫微环境,继而受益于PD-1/PD-L1阻断治疗。
卵巢癌错综复杂的基因组表达变化与其肿瘤微环境之间的相互作用是研究卵巢癌免疫检查点抑制剂的巨大挑战,这不仅涉及免疫细胞还涉及肿瘤微环境中众多免疫趋化因子在免疫激活通路中发挥的动态作用。近期,越来越多的研究强调趋化因子CXCL9对肿瘤患者生存的影响及其在肿瘤微环境中调节抗肿瘤免疫细胞的迁移、浸润功能。CXCL9作为调控免疫细胞浸润的重要基因,在卵巢癌免疫微环境中参与了多项抗肿瘤免疫应答,与较高的免疫细胞浸润数量相关,且与PD-L1的表达呈正相关。未来,CXCL9或可作为预测卵巢癌患者响应PD-1/PD-L1阻断治疗的生物标志物之一,同时将CXCL9与PD-L1表达或错配修复缺陷联合使用,或有望更精准地筛选PD-1/PD-L1阻断治疗的潜在获益患者。
