Hp根治治疗对非酒精性脂肪性肝病患者血清细胞因子和血脂水平的影响*
2020-05-28沈金勇郭翔云
沈金勇,郭翔云,周 辉,罗 乐
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)属临床常见的慢性非传染性流行病。据报道,普通人群NAFLD发病率高达20%~30%,而在不同国家其发病率也多处于10%~24%之间,40~49岁年龄段人群多发,与中心性肥胖、胰岛素抵抗等因素有关[1]。有报道显示,幽门螺杆菌(helicobacter pylori,Hp)感染可能是NAFLD发展的独立危险因素,主要是Hp经奥狄氏括约肌逆流上行,进入肝脏,对肝细胞产生一定的毒性,或经诱导某些毒力因子或细胞炎症因子产生免疫反应,危害邻近的胃、肝或胆道,加重肝脂肪变性,参与NAFLD发病的病理生理过程[2]。另有报道显示,Hp感染与糖脂代谢异常、心脑血管疾病、胰岛素抵抗等有关,可能通过某些中间机制,如胰岛素抵抗、代谢综合征等,参与NAFLD的发生和发展[3]。本研究探讨了根除Hp治疗对NAFLD患者血清细胞因子和糖脂代谢的影响,现报道如下。
1 资料与方法
1.1 一般资料 2015年6月~2019年6月我院收治的Hp阳性的NAFLD患者168例,男111例,女57例;年龄18~65岁,平均年龄为(48.9±11.3)岁。NAFLD诊断参照《非酒精性脂肪性肝病诊疗指南(2010年修订版)》的标准[4],无饮酒史,或存在饮酒史(折合乙醇摄入量男性小于140 g/周,女性小于70 g/周)。不明原因的血清谷丙转氨酶和(或)谷草转氨酶和谷氨酰转肽酶持续增高6个月以上,超声检查表现为肝脏近场回声弥漫性增强,回声强于肾脏,肝脏远场回声逐渐衰减,肝内管道结构显示不清,与弥漫性脂肪肝诊断标准相符且无其他原因可解释,伴或不伴代谢综合征相关组分。排除全胃肠外营养、自身免疫性肝病、病毒性肝炎、药物性肝损伤、肝豆状核变性等所致的脂肪肝。Hp感染诊断参照《幽门螺杆菌感染诊疗指南》[5],快速尿素酶试验和组织学检查均为阳性,则判定为Hp阳性。入组前1个月内未曾接受过根除Hp治疗。采用随机数字表法将患者分为两组,两组一般资料比较差异无统计学意义(P>0.05)。患者签署知情同意书,本研究获得我院医学伦理委员会批准。
1.2 治疗方法 入院后,给予所有患者合理控制饮食和强化运动锻炼指导。在对照组,给予多烯磷脂酰胆碱胶囊[赛诺菲(北京)制药有限公司,国药准字H20059010]456 mg口服, 3次/d,二甲双胍(中美上海施贵宝制药有限公司,国药准字H20023370)0.5口服,3次/d;观察组在对照组治疗的基础上行Hp根治治疗,即给予奥美拉唑肠溶胶囊(浙江京新药业股份有限公司,国药准字H20065588)、克拉霉素胶囊(丽珠集团丽珠制药厂,国药准字H20067196)、阿莫西林胶囊(西南药业股份有限公司,国药准字H20083608)和胶体果胶铋胶囊(江西药都仁和制药有限公司,国药准字H20073987)四联疗法,持续2周。停药1个月后,复查Hp。两组均于治疗2个月后评定疗效。
1.3 检测方法 使用ADVIA Centaur CP型全自动化学发光免疫分析仪(德国西门子公司),以放射免疫法测定血清肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平(上海抚生生物科技有限公司);采用比色法测定血清超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平(上海药巢生物有限公司);采用ELISA法测定白介素6(interleukin-6,IL-6)和IL-8水平(广州瑞辉生物科技股份有限公司);常规检测血生化指标;采用放射免疫法测定空腹胰岛素(fasting insulin,FINS,湖南海源医疗科技股份有限公司),按照公式计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance index,HOMA-IR),即HOMA-IR=(FPG×FINS)/22.5。

2 结果
2.1 两组Hp根除情况比较 在Hp根治治疗停药1个月后复查时,观察组Hp转阴79例(94.0%),而对照组无Hp转阴病例(P<0.01)。
2.2 两组血清炎性因子水平比较 治疗后,观察组血清TNF-α、hs-CRP、IL-6和IL-8水平显著低于对照组(P<0.05,表1)。

表1 两组血清炎性因子水平比较
与对照组比,①P<0.05
2.3 两组血脂指标比较 治疗后,观察组血TC、TG和LDL-C水平显著低于对照组(P<0.05),而血HDL-C水平显著高于对照组(P<0.05,表2)。
2.4 两组糖代谢和肝功能指标比较 治疗后,观察组FINS、HOMA-IR、ALT和AST水平显著低于对照组(P<0.05,表3)。
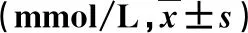
表2 两组血脂水平比较
与对照组比,①P<0.05

表3 两组糖代谢和肝功能指标比较
与对照组比,①P<0.05
3 讨论
有报道显示,Hp感染可能参与了NAFLD发病的病理生理过程,与胰岛素抵抗、炎性细胞因子、脂肪细胞因子、Hp产生的毒素和肠道通透性增加有关[6,7]。
本研究结果显示,Hp根治治疗停药1个月后观察组Hp根除率为94.0%,提示Hp根治治疗疗效确切。有报道也发现根除Hp的四联疗法,即奥美拉唑、阿莫西林、克拉霉素和胶体果胶铋,治疗合并Hp感染的NAFLD患者,持续2周后Hp根除率达93.8%,提示上述四联疗法疗效好[8-10]。
本研究结果显示,治疗后观察组血清TNF-α、hs-CRP、IL-6和IL-8水平显著低于对照组,提示Hp根治治疗能有效减轻NAFLD患者炎性反应。NAFLD常伴肠源性内毒素血症的发生,导致核因子-κB信号传导系统被激活,促使炎症介质,如IL-6和TNF-α大量释放,诱导炎症反应,刺激炎症指标如CRP的产生,诱发胰岛素抵抗,提示炎症因子在NAFLD发生、发展过程中发挥着重要的作用[11]。Hp属强烈促炎细胞因子诱导物,长期慢性感染引起炎症刺激会过度释放血管活性物质和促炎细胞因子[12]。Hp感染与胰岛素抵抗密切相关,可能与Hp感染释放大量血管活性物质,促进血小板激活,诱导脂联素下降,引起慢性萎缩性胃炎,形成活性氧,导致胃促生长素水平下降,影响凋亡过程[13]。TNF-α能引起胰岛素抵抗,干扰胰岛素信号,导致脂肪变性,可能在NAFLD的发病机制中发挥重要的促炎作用,是Hp感染相关的NAFLD一个关键性的调节物质[14]。根除Hp感染能增加循环脂联素水平,阻止肝纤维化进展,减轻炎症反应[15,16]。
有报道Hp可经IL-6和INF-α等多种细胞因子途径诱发或加重脂质代谢紊乱,引起肝细胞内脂质过度沉积,导致NAFLD的发生。根除Hp能增加Hp阳性的NAFLD患者血HDL-C水平,降低TC、TG、LDL-C水平[17]。本研究发现,经治疗,观察组FINS和HOMA-IR明显低于对照组,提示Hp根治治疗能有效纠正Hp阳性的NAFLD患者糖代谢紊乱。根除Hp能改善Hp阳性的NAFLD患者胰岛素抵抗水平,降低FINS和HOMA-IR[18]。分析Hp感染影响Hp阳性NAFLD患者血糖变化的具体机制,可能与Hp慢性长期感染所致系统性炎症反应、激素水平,如瘦素等改变有关。
根除Hp治疗能改善Hp阳性的NAFLD患者的肝功能[19]。但也有报道认为根除Hp对Hp阳性NAFLD患者血清ALT和AST水平并无明显的影响,多因Hp感染引起的胰岛素抵抗仅为NAFLD发病机制中的第一次打击,而炎症细胞因子、脂质过度氧化、氧化应激等参与的第二次打击机制相对复杂,Hp感染可能在其进程中未扮演主要的角色[20]。分析上述报道与本研究存在偏差的原因,可能与该研究纳入患者中以轻度脂肪肝患者居多、大部分人群仅处于第一次打击的发病机制阶段有关。我们认为,根除Hp治疗后机体经自身代谢调节,能清除肝细胞内脂质蓄积,纠正脂质代谢紊乱,恢复肝细胞功能,改善病情。这些研究还处于初步阶段,获得的数据还需要进一步验证和评估。
