培养条件对西洋参不定根诱导的影响
2020-05-26李润田刘志琨邹丹张宗申
李润田 刘志琨 邹丹 张宗申


摘 要: 为了提高西洋参不定根的诱导率和生长速度,该研究以西洋参鲜根为外植体,在基本培养基的基础上优化IBA、碳源、氮源和磷源等营养成分。结果表明:西洋参不定根诱导过程可以明显分为外植体脱分化(愈伤化)、再分化(根形成)和根伸长等三个阶段;MS基本培养基更有利于西洋参不定根的诱导,可能与MS培养基中矿质元素含量高有关;当培养基中IBA浓度达到2 mg·L-1时,外植体表面上不定根分布密度大,誘导率达到(96±3.5)%;培养基中添加蔗糖到30 g·L-1时,不定根的诱导效果最好,但继续提高浓度后不定根变短、直径变粗;培养基中NO3-∶NH4+和 PO43- 浓度分别为20∶ 10(总氮量30 mmol·L-1)和25.0 mmol·L-1时,西洋参不定根诱导率达到最大。结果提示优化培养条件可以显著改善西洋参不定根的诱导和生长,为后续西洋参不定根规模化培养提供理论支持。
关键词: 西洋参, 不定根, 培养基优化, 诱导, IBA
中图分类号: Q945 文献标识码: A
文章编号: 1000-3142(2020)04-0557-10
Abstract: This study reported the improved induction rate and growth speed of Panax quinquefolium adventitious roots cultured on the basal media supplemented with varying IBA, sucrose, NO3-∶NH4+ ratio and PO43-, etc. The results were as follows: In the whole process of adventitious root induction, three main phases could be distinguished including dedifferentiation (callus formation), redifferentiation (initiation of adventitious root), and elongation of roots. And it achieved the best induction of adventitious roots from explants cultured on the MS containing high concentration of mineral elements, which probably fulfilling the requirement for nutrients at stage of callus formation. Amid experiments of IBA, at a concentration of 2 mg·L-1 was the most effective in inducing adventitious roots with (96±3.5)% of induction rate, at which dense distribution of adventitious roots on the surface of callus could be observed. Additionally, 30 g·L-1 sucrose was proved to be the optimal concentration, however, it would grow into stubbly roots upon the increase of sucrose concentration. Furthermore, the effect of NO3-∶NH4+ ratio and PO43- concentration on adventitious root induction was also evaluated. The maximum induction rate was obtained in 20∶10 ratio of NO3- to NH4+ (total N source of 30 mmol·L-1) and 25.0 mmol·L-1 PO43-, respectively. The present data suggest that modification of media ingredients can significantly enhance the induction and growth of P. quinquefolium adventitious roots, which would provide theoretical support for following large-scale culture of P. quinquefolium adventitious roots.
Key words: Panax quinquefolium, adventitious roots, optimization of media, induction, IBA
西洋参(Panax quinquefolium)是五加科人参属(Panax L.)的多年生草本药用植物,其宿根一直是该属天然药物的重要来源(Yang et al., 2014)。西洋参除了具有清热解毒、滋阴补肾和口齿生津的功效外,还具有降血糖、促进血液循环的作用,有助于人体抗衰老、提高免疫力和保护心血管系统等(李珊珊和孙印石, 2017; Huang et al., 2019)。鉴于我国将西洋参列入新食品原料目录管理,随着其在食品领域的广泛应用,它的市场需求量将会急剧增加。
种植的西洋参受生长环境、气候、土壤及栽培技术等因素的影响很大,也存在着“重、毒、副”残留与基本农田争地和管理成本高等突出问题,而且一般还要经过4到5年的生长周期才能收获入药(Li et al., 1996; 陈洪海和张志华, 2014)。因为西洋参以根入药, 通过不定根离体培养技术生产西洋参培养物,可以作为替代大田栽培资源提取天然产物的原料(Murthy et al., 2018)。不定根离体培养的工艺流程包括不定根诱导、固体增殖扩繁和悬浮级联放大培养等技术环节,其中高效诱导是实现不定根规模化生产的前提(Jeong et al., 2009; Zhang et al., 2017)。对于西洋参等多年生药用植物,一般采用其宿根作为不定根诱导的外植体,但是普遍存在着细胞脱分化难、次生代谢物质抑制生长、对外源激素敏感性低甚至易发生褐变致死等问题,直接导致外植体上不定根诱导率较低(Zhao et al., 2013)。目前,虽然开展了西洋参不定根离体培养的研究,但仅限于不定根悬浮培养的生长和总皂苷积累等方面,主要集中在诱导子应用、培养形式和不定根增殖等问题上(李慧娟等, 2011; Yu et al., 2016)。目前,对于影响西洋参不定根诱导发生的因素及解决手段等方面的研究还未见文献报告,而对该问题的研究有利于建立稳定的西洋参不定根诱导工艺。
为了提高西洋参不定根的诱导率,本文以新鲜的西洋参根为外植体,筛选适合西洋参不定根诱导的基本培养基和优化主要成分的添加浓度。研究结果对后续西洋参不定根培养的商业化应用提供基础性数据,同时也为其他珍稀濒危药用植物资源可持续利用提供参考。
1 材料与方法
1.1 植物材料
吉林长白山三年生的新鲜西洋参根。先将西洋参根经自来水冲洗、滤纸吸干、消毒等处理,然后将其剪为1~2 cm的切段,作为诱导不定根的外植体,待用。
1.2 方法
1.2.1 基本培养基的选择 将外植体切段分别接种在含有1/2 B5、B5、MS、1/2 MS的固体培养基上(pH6.0),辅以2%蔗糖+0.5%琼脂粉+3 mg·L-1 IBA。在25 ℃条件下暗培养,以诱导率为指标确定最适培养基。
1.2.2 吲哚丁酸(IBA)浓度对西洋参不定根诱导效果的影响 以MS为基本培养基,添加2%蔗糖+0.5%琼脂粉,分别添加不同浓度的IBA(0.05、0.10、0.20、1.00、2.00、4.00 mg·L-1),pH值6.0,将处理的外植体切段接入,其余同1.2.1。
1.2.3 碳源浓度对西洋参不定根诱导的影响 以MS+2 mg·L-1IBA+0.5%琼脂粉为培养基配方,添加不同浓度的蔗糖(15、25、30、40 g·L-1),pH值 6.0,接种后培养,其余同1.2.1。
1.2.4 氮源对西洋参不定根诱导的影响 以MS+30 g·L-1蔗糖+2 mg·L-1 IBA +0.5%琼脂粉等作为基本培养基配方,按照表1添加不同比例的NO3- ∶NH4+,培养基中总氮量固定为30 mmol·L-1,培养基pH6.0,外植体接种后培养,其余同1.2.1。
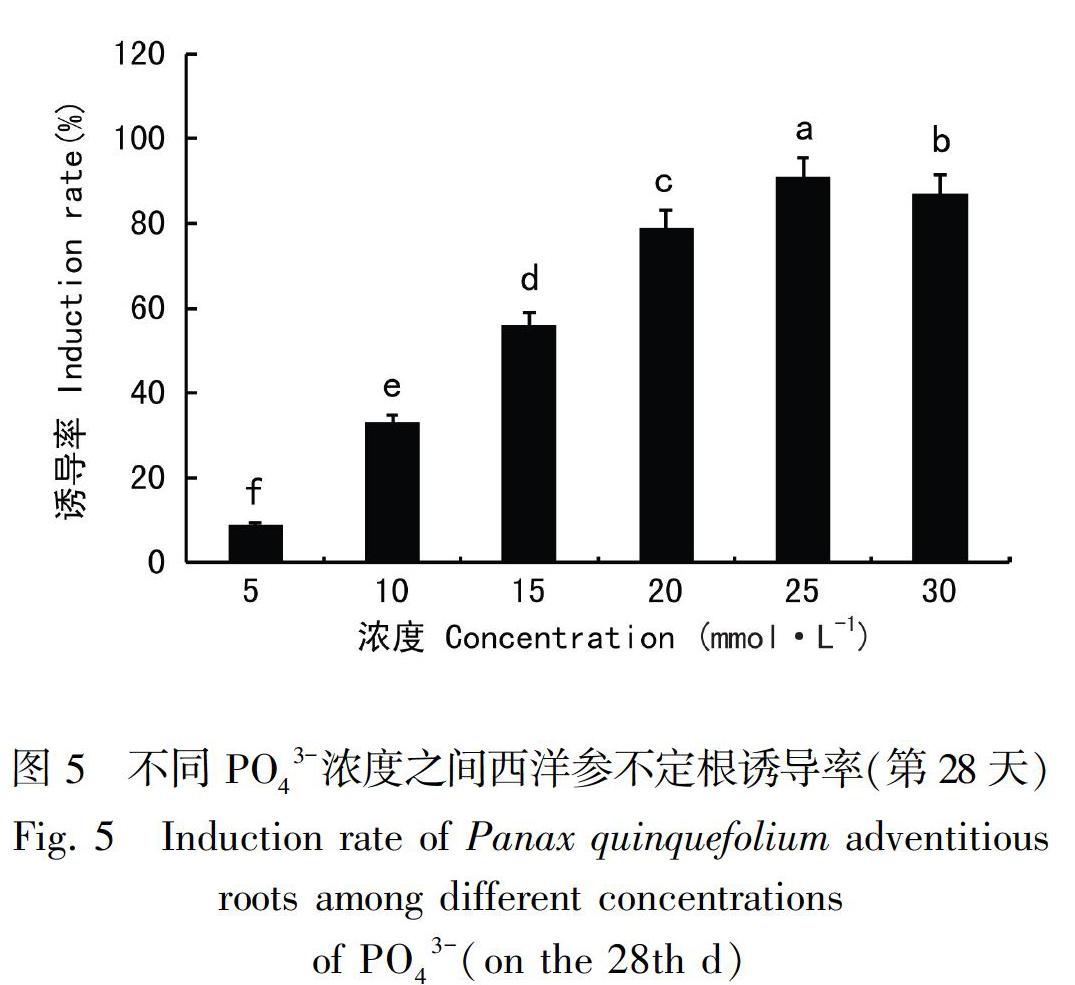
1.2.5 PO43-对西洋参不定根诱导的影响 以MS(NO3-∶NH4+为20∶10)+30 g·L-1蔗糖+2 mg·L-1 IBA+0.5%琼脂粉为培养基组成配方,添加不同浓度的PO43-(5、10、15、20、25、30 mmol·L-1),培养基pH6.0,外植体接种后培养,其余同1.2.1。
1.2.6 数据统计与分析 上述所有试验均随机分组,设置3组重复,每组总接种数量为50个外植体;从接种第4天开始,每天观察外植体变化及不定根发生情况,并以培养28 d的不定根诱导结果计算诱导率,实验数据采用Microsoft Excel 2010和Origin 2017进行分析,P<0.05差异显著。不定根诱导率=(发生不定根的外植体数/外植体总数)×100%
2 结果与分析
2.1 基本培养基的选择
通过观察不定根发生情况确定适合西洋参不定根诱导的基本培养基类型,结果如图版Ⅰ所示。在接种培养7 d后,外植体的切口端(伤口)出现膨胀等愈伤化现象;随着时间延长,愈伤组织表面逐渐呈现颗粒状;在培养20 d后,愈伤组织表面陆续分化出不定根。从诱导培养28 d后的不定根诱导率统计结果(图1)可以看出,MS更适合不定根诱导,B5的效果较差。这可能与不定根发生过程中涉及愈伤组织中细胞脱分化、分裂、生长等有关,因为这些细胞变化需要活跃的生物物质代谢、能量代谢以及细胞的重构等,必须提供充足的营养元素才能满足上述细胞活动。MS培养基的最主要特点就是矿质元素和其他营养成分含量高,与不定根诱导过程对营养成分的需求相一致,本结果也证明了这个推测。
2.2 吲哚丁酸(IBA)浓度对西洋参不定根的诱导效果
培养基中IBA浓度对西洋参不定根的诱导情况及诱导率统计结果分别如图版Ⅱ和图2所示。通过比较发现,当浓度较低时,外植体上发生较多愈伤组织,表面上不定根数量少且短(图版Ⅱ:A,B,C);当IBA浓度较高时,不定根诱导发生的效果较好,不定根分布密度大且不定根较长(图版Ⅱ:D, E,F);当IBA浓度高于1 mg·L-1时,外植体上不定根诱导率达到(82±3)%以上,2 mg·L-1时不定根诱导率达到(96±3.5)%。综合考虑诱导率和培养基成本,在后续的试验中选择2 mg·L-1 IBA作为添加浓度。
2.3 碳源浓度对西洋参不定根的诱导效果
在离体条件下,培养基中添加碳源除了为不定根诱导提供能量外,还对培養基渗透势有很大影响,因此其添加浓度是非常重要的参数。根据前面结果,在MS+2 mg·L-1 IBA+0.5%琼脂基本配方中添加不同浓度的蔗糖,28 d后观察统计外植体上不定根的发生和诱导率(图版Ⅲ和图3)。结果表明,尽管在所有蔗糖浓度的培养基中,外植体上都能发生愈伤组织,但是不定根发生情况差异很大。当糖量为30 g·L-1时,西洋参不定根诱导率较大;当糖量较低时(15 g·L-1),西洋参不定根诱导率较低;当蔗糖浓度达到40 g·L-1时,虽然不定根发生率相对较高,但不定根较短,说明高浓度蔗糖具有抑制生长的作用, 这可能与糖量过高引 A. 1/2 B5培养基,愈伤组织表面上不定根较少; B. B5培养基,不定根密度比1/2 B5培养基中的增加; C. 1/2 MS培养基,愈伤组织表面的不定根数量明显增加; D. MS培养基,不定根密度和根长度最大。
2.4 NO3- ∶NH4+对西洋参不定根的诱导效果
在MS+30 g·L-1蔗糖+2 mg·L-1IBA+0.05 mg·L-1NAA+0.5%琼脂基础上,改变NO3- ∶NH4+配比,培养28 d后观察、统计西洋参不定根发生情况如图版Ⅳ和图4所示。当NO3-所占比例低时,外植体愈伤化较好,不定根发生率也较高,但不定根较短即生长速度漫;当NO3-所占比例逐渐升高时,不定根密度增加,不定根越来越长即生长速度越来越快,NO3-所占比例过大(超过28∶2)时,尽管不定根较长,但分布密度降低,不定根衰老较明显。上述结果提示,NO3- ∶NH4+影响不定根的发生、生长和生理状态。A. 0.05 mg·L-1; B. 0.10 mg·L-1; C. 0.20 mg·L-1; D. 1.00 mg·L-1; E. 2.00 mg·L-1; F. 4.00 mg·L-1。
2.5 PO43-浓度对西洋参不定根的诱导效果
磷元素是植物细胞分裂、分化和生长发育必须的大量元素之一。MS培养基中磷元素以PO43-的形式存在,其浓度高低直接影响着外植体上不定根诱导发生。将西洋参外植体接种在含不同浓度PO43-的培养基中,培养28 d后不定根发生情况如图版Ⅴ和图5所示。当PO43-浓度较低时,不定根诱导率较低,生长速度慢;随着浓度升高,不定根密度逐渐增加,到15 mmol·L-1时不定根生长明显加快;当PO43-浓度达到25 mmol·L-1时,不定根的生长速度和分布密度基本不再变化。A. 15 g·L-1; B. 25 g·L-1; C. 30 g·L-1; D. 40 g·L-1。
3 讨论
本研究通过筛选基本培养基和优化NO3-∶NH4+比以及IBA、蔗糖和PO43-等培养基成分,均显著提高了西洋参外植体的不定根诱导率和生长速度,在优化条件下不定根诱导率最高值达到(96+3.5)%。上述结果为西洋参不定根的固体增殖扩繁、缩短不定根种子制备周期等提供了依据,对于下阶段建立西洋参不定根悬浮培养体系奠定了基础。
添加外源IBA对不定根的诱导发生起关键作用。一些研究表明,IBA在植株水平上诱导根器官A. 0∶30; B. 4∶26; C. 8∶22; D. 12∶18; E. 15∶15; F. 20∶10; G. 24∶6; H. 28∶2; I. 30∶0。
形成的活力很强,如拟南芥和玉米的不定根发生以及侧根形成等(Ludwig-Muller et al., 2005; Strader et al., 2011; Yadav et al., 2013; Schlicht et al., 2013);其在离体条件下也起类似的生理作用,如促进东哥阿里和贯叶金丝桃不定根的形成(Cui et al., 2010;Tao et al., 2015)。对于IBA诱导不定根或侧根发生的机理,一些研究发现IBA是IAA依赖性的,必须在细胞内转化为IAA形式才具有生理活性(Zoman et al., 2000);也有结果证明IBA可能有独立于IAA的作用机制,依靠自己的信号传递途径激发下游的生理生化事件(Strader et al., 2011)。本文结果显示IBA不但具有较好的西洋参不定根诱导效果,而且还具有IBAA. 5 mmol·L-1; B. 10 mmol·L-1; C.15 mmol·L-1; D . 20 mmol·L-1; E. 25 mmol·L-1; F. 30 mmol·L-1。
浓度依赖性的特征。在离体条件下,不同外植体对外源IBA的敏感性,存在着种质特性、生理状态、组织幼嫩程度和环境条件等造成的差异性,这些差异影响着外植体对外源IBA的吸收效率、转运速度和IAA转化等(Woodward & Bartel, 2005)。因此,在进行外植体诱导不定根的试验中,首先要根据外植体的具体情况优化并确定IBA使用浓度,以提高不定根诱导效率和缩短不定根种子制备周期。
基础培养基及其他营养成分对不定根诱导具有很大影响。由于基本培养基的大量元素和微量元素的组成特点有所不同,其应用范围和使用目的也有差异(齐琳琳等,2017)。从外植体经过愈伤组织途径发生不定根,涉及到外植体细胞脱分化、再分化等过程,细胞显微结构和形态以及生理生化代谢能力和方式等都发生一系列变化(Benková et al., 2003;Ma s'lanka & Bach, 2014; Li et al., 2018)。而MS基本培养基具有无机盐含量高的特点,符合不定根诱导及生长对营养元素的要求,本文结果也证明了MS培养基比较适合西洋参不定根诱导,与前人结论一致( Lee & Paek, 2012)。同时,本文结果也说明了NO3-∶NH4+、糖和PO43-浓度等对西洋参不定根诱导率具有很重要的影响。一方面是因为从外植体组织到不定根转化过程中涉及细胞重构和生物大分子代谢等需要大量营养成分参与的过程,而且糖等物质还有调节培养基渗透势的作用,直接影响外植体细胞对营养成分的吸收利用;另一方面,NO3-∶NH4+对植株或离体根系的形态建成通过氮元素转化效率、NO信号分子形成等发挥特殊作用(Pagnussat et al., 2002; Zhao et al., 2007; 杨雨迎等, 2018)。因此,本文在筛选基本培养基的基础上进一步优化了NO3-∶NH4+比等营养成分,初步实现了西洋参不定根高效诱导,证明营养成分及其浓度对不定根发生具有重要作用,可以与IBA等一起发挥协同作用。
尽管利用不定根培养技术在少数种类的药用植物中获得突破,但是对于大多数药用植物来说仍然存在限制性因素,主要包括不定根诱导率低、悬浮下生长慢、有效成分含量不稳定等 (Murthy et al., 2008; Lee & Paek, 2012; Murthy et al., 2018)。基于此,在本研究基础上,下一步需要在基于生物反应器规模化悬浮培养工艺方面深入研究,比如溶氧、供氧方式及养分代谢动力学等重要参数,实现西洋参不定根生物量和活性成分积累等关键技术指标的突破,解决影响西洋参不定根规模化培养过程中的核心问题。
参考文献:
BENKOV E, MICHNIEWICZ M, SAUER M, et al., 2003. Local, efflux-dependent auxin gradients as a common module for plant organ formation[J]. Cell, 115(5):591-602.
CHEN HH, ZHANG ZH, 2014. Cultivation and analysis on the technique of high yield cultivation of Panax quinquefolium in area of Changbai Mountain [J]. Agric Technol, 34(11):134.[陳洪海, 张志华, 2014. 长白山区西洋参种植及高产栽培技术分析[J]. 农业与技术, 34(11):134.]
CUI XH, CHAKRABARTY D, LEE EJ, et al., 2010. Production of adventitious roots and secondary metabolites by Hypericum perforatum L. in a bioreactor[J]. Bioresour Technol, 101(12):4708-4716.
HUANG X, LIU Y, ZHANG Y, et al., 2019. Multicomponent assessment and ginsenoside conversions of Panax quinquefolium L. roots before and after steaming by HPLC-MS [J]. J Ginseng Res, 43(1):27-37.
JEONG JA, WU CH, MURTHY HN, et al., 2009. Application of an airlift bioreactor system for the production of adventitious root biomass and caffeic acid derivatives of Echinacea purpurea[J]. Biotechnol Bioproc Eng, 14(1): 91-98.
LEE EJ, PAEK KY, 2012. Enhanced productivity of biomass and bioactive compounds through bioreactor cultures of Eleutherococcus koreanum Nakai adventitious roots affected by medium salt strength[J]. Ind Crops Products, 36(1):460-465.
LE SS, SUN YS, 2017. Research achievements on structures and activities of polysaccharides from Panax quinquefolius[J]. Spec Wild Econ Anim Plant Res, 39(3): 68-71.[李珊珊, 孙印石, 2017. 西洋参多糖结构与药理活性研究进展[J]. 特产研究, 39(3):68-71.]
LI HJ, PIAO XC, FEI LK, et al., 2011. Several factors affecting proliferation of adventitious root in vitro and ginse-noside production of Panax quinquefolium [J]. J Agric Sci Yanbian Univ, 33(2):77-88. [李慧娟, 朴炫春, 费丽坤, 等, 2011. 影響西洋参不定根组培增殖的几种因素及皂苷生产的研究[J]. 延边大学农学学报, 33(2):77-88.]
LI K, LIANG YQ, XING LB, et al., 2018. Transcriptome analysis reveals multiple hormones, wounding and sugar signaling pathways mediate adventitious root formation in apple rootstock[J]. Int J Mol Sci, 19(8):1-13.
LI TSC, MAZZA G, COTTRELL AC, et al., 1996. Ginsenosides in roots and leaves of American ginseng[J]. J Agric Food Chem, 44(3):717-720.
LUDWIG-MULLER J, VERTOCNIK A, TOWN CD, 2005. Analysis of indole-3-butyric acid-induced adventitious root formation on Arabidopsis stem segments[J]. J Exp Bot, 418(418): 2095-2105.
MA S'LANKA M, BACH A, 2014. Induction of bulb organogenesis in in vitro cultures of tarda tulip (Tulipa tarda Stapf.) from seed-derived explants[J]. In Vitro Cell Dev Biol-Plant, 50(6):712-721.
MURTHY HN, DANDIN V, PARK SY, et al., 2018. Quality,safety and efficacy profiling of ginseng adventitious roots produced in vitro[J]. Appl Microbiol Biotechnol, 102(17):7309-7317.
MURTHY HN, HAHN EJ, PAEK KY, 2008. Adventitious roots and secondary metabolism[J]. Chin J Biotechnol, 24(5): 711-716.
PAGNUSSAT GC, SIMONTACCHI M, PUNTARULO S, et al., 2002. Nitric oxide is required for root organogenesis[J]. Plant Physiol,129(3):954-956.
QI LL, LI G,LIU ZW, et al., 2017. Effects of culture conditions on the growth and accumulation of saponin in Panax notoginseng callus[J]. Guihaia, 37(8):1035-1042 .[齐琳琳, 李刚, 刘志伟, 等, 2017. 培养条件对三七愈伤组织生长和皂苷积累的影响[J]. 广西植物, 37(8):1035-1042.]
SCHLICHT M,LUDWIG-MULLER J, BURBACH C, et al., 2013. Indole-3-butyric acid induces lateral root formation via peroxisome-derived indole-3-acetic acid and nitric oxide[J]. New Phytol, 200(2):473-482.
STRADER LC, WHEELER DL, CHRISTENSEN SE, et al., 2011. Multiple facets of Arabidopsis seedling development require indole-3-butyric acid-derived auxin[J]. Plant Cell, 23(3):984-999.
TAO LL, PARK SY, IBRAHIM R, et al., 2015. Production of biomass and bioactive compounds from adventitious roots by optimization of culturing conditions of Eurycoma longifolia in balloon-type bubble bioreactor system [J]. J Biosci Bioeng, 119 (6): 712-717.
WANG MQ, GUILBERT LJ, LING L, et al., 2001. Immunomodulating activity of CVT-E002, a proprietary extract from North American ginseng (Panax quinquefolium)[J]. J Pharm Pharmacol, 53(11):1515-1523.
WOODWARD A, BARTEL B, 2005. Auxin: regulation, action, and interaction [J]. Ann Bot, 95(5):707-735.
YADAV S, DAVID A, BALUKA F, et al., 2013. Rapid auxin-induced nitric oxide accumulation and subsequent tyrosine nitration of proteins during adventitious root formation in sunower hypocotyls [J]. Plant Signal Behav, 8: e23196.
YANG WZ, HU Y,WU WY, et al., 2014. Saponins in the genus Panax L. (Araliaceae): A systematic review of their chemical diversity[J]. Phytochemistry, 106:7-24.
YANG YY, LUO HY, CAO F, et al., 2018. Effects of NO3-/NH4+on the growth of hairy roots of Psammosilene tunicoide [J]. Mol Plant Breed, 16(5):1698-1703.[楊雨迎, 雒怀宇, 曹芳, 等, 2018. NO3-/NH4+对金铁锁毛状根生长的影响[J]. 分子植物育种, 16(5):1698-1703.]
YU Y, ZHANG WB, LI XY, et al., 2016. Pathogenic fungal elicitors enhance ginsenoside biosynthesis of adventitious roots in Panax quinquefolium during bioreactor culture [J]. Ind Crops Products, 94:729-735.
ZHANG Z, ZOU D, LIU M, et al., 2017. Induction of Psammosilene tunicoides adventitious roots and the accumulation of triterpenoid saponins as affected by culture conditions[J]. Int J Agric Biol, 19(6):1535-1540.
ZHAO DY, TIAN QY, LI LH, et al., 2007. Nitric oxide is involved in nitrate-induced inhibition of root elongation in Zea mays [J]. Ann Bot, 100(3): 497-503.
ZHAO XY, SU YH, ZHANG CL, et al., 2013. Differences in capacities of in vitro organ regeneration between two Arabidopsis ecotypes Wassilewskija and Columbia [J]. Plant Cell Tiss Organ Cult, 112:65-74.
(责任编辑 周翠鸣)
