miR-125a-5p抑制剂对大鼠心肌缺血再灌注损伤的影响
2020-05-26
心肌缺血再灌注(ischemia and reperfusion,I/R)损伤由Jennings在1960年首次于犬类心脏冠状动脉结扎模型中描述[1]。研究发现血液再灌注后增加心肌坏死速度。心肌I/R损伤导致炎症应答,并对缺血部位多种组织造成进一步损伤,如促进相关组织凋亡等。由心肌缺血导致的急慢性炎症应答对心脏功能退化具有重要影响[2-3]。心肌缺血性心脏病是目前主要的致死性疾病之一[4-5]。及时的血液再灌注是降低死亡率的有效手段,但再灌注本身导致一系列组织损伤和病理异常,如心脏收缩功能降低、心肌细胞代谢异常、内皮细胞功能障碍、坏死和凋亡等[6-7]。引起再灌注损伤的主要因素为一氧化氮(NO)、超氧化物和过氧化亚硝酸盐等产生[7-8]。microRNAs是近年来发现的一类小RNA分子,通过转录后调控基因表达[9]。microRNAs通过调控基因表达影响多种细胞活动和功能,如细胞增殖、凋亡和分化等[10-11]。有研究表明,miR-125a-5p在多发性骨髓瘤细胞中抑制p53通路促进细胞增殖和迁移,并抑制肿瘤细胞凋亡[12]。但针对miR-125a-5p对心肌I/R损伤相关机制报道较少。本研究探讨miR-125a-5p抑制剂对大鼠心肌I/R损伤模型中的影响,以期为心肌I/R损伤疾病提供依据。
1 材料与方法
1.1 实验试剂 苏木素-伊红(HE)染色试剂盒(货号:C0105)均购自碧云天公司。荧光素酶报告基因检测试剂盒(货号:RG005-1)购自碧云天公司。大鼠超氧化物歧化酶(SOD)检测试剂盒(货号:QYS-03061)、谷胱甘肽(GSH)检测试剂盒(货号:QYS-231069)和丙二醛(MDA)检测试剂盒(货号:QYS-03052)均购自齐一生物科技(上海)有限公司。白介素-6(IL-6)(货号:ab6672)、Bax(货号:ab53154)、Bcl-2(货号:ab692)、信号传导与活化转录因子3(STAT3)(货号:ab119352)、GAPDH(货号:1056)一抗购自美国abcam公司、辣根过氧化物酶(HRP)标记的山羊抗小鼠二抗购自美国Santa Cruz公司。SYBR PCR Master Mix(货号:4309155)购自赛默飞公司。
1.2 实验仪器 半干转膜仪、电泳仪及PCR仪均购于美国伯乐公司;Mμltiskan GO酶标仪购自Thermo;Gel View 6000化学发光凝胶成像仪购于广州云星仪器有限公司。分析天平ME204购自梅特勒托利多国际贸易(上海)有限公司。-86 ℃超低温冰箱DW-86L578J、-25 ℃低温保存箱DW-25L262h和2~8 ℃医用冷藏箱HYC-310购自海尔公司。Eppendorf台式冷冻离心机5702R购自德国艾本德股份公司。
1.3 实验方法
1.3.1 大鼠心肌I/R损伤模型的构建 将30只8周龄健康Wistar大鼠(维通利华)随机分为假手术组(sham组)、I/R损伤组(I/R组)和I/R+miR-125a-5p抑制组。大鼠腹腔注射2%戊巴比妥钠盐(50 mg/mL)进行麻醉,置于操作台上并使用小动物呼吸器维持呼吸(60次/min),潮气量为13~15 mL。在第4肋骨处进行开胸,左冠状动脉胸前下肢进行结扎阻断血管30 min后,恢复血管通畅后缝合胸腔;sham组进行同样处理但不结扎血管;建立大鼠sham组和I/R损伤模型。其中I/R+miR-125a-5p抑制组在血液再灌注前给予心肌层注射miR-125a-5p抑制剂(0.2 μL/g)。所有大鼠再灌注24 h后处死。
1.3.2 荧光素酶报告实验测定STAT3和miR-125a-5p结合位点荧光素酶活性 利用生物信息学网站预测STAT3和miR-125a-5p结合片段,使用定量即时聚合酶连锁反应(qRT-PCR)扩增STAT3两者的结合片段,并将该结合片段插入到PC-DNA中,构建野生(wild type,wt)STAT3质粒,再利用突变技术将结合位点突变,构建STAT3突变(mutant type,mut)质粒。使用野生STAT3质粒、STAT3突变质粒和miR-125a-5p模拟物(mimic)分别或同时对细胞进行转染。细胞分为4组:STAT3 wt组、STAT3 wt+miR-125a-5p mimic组、STAT3 mut组和STAT3 mut+miR-125a-5p mimic组,采用Luciferase报告基因试剂盒检测各组荧光素酶活性。实验重复3次。
1.3.3 qRT-PCR检测心肌组织细胞相关RNA水平 取解剖后心肌组织,使用TRIzol试剂提取各组细胞总RNA,测定RNA浓度、纯度后,使用反转录试剂盒合成cDNA,使用PCR仪器进行扩增,用SYBR PCR Master Mix试剂盒测定STAT3和miR-125a-5p表达水平,以GAPDH为内参。实验所用引物均采用Primer 3 Plus网站设计,由苏州金唯智生物科技有限公司提供合成,实验重复3次。
1.3.4 HE染色 切片经3次二甲苯脱蜡,每次时间分别为15 min、15 min、10 min;梯度乙醇进行脱苯,分别使用100%、90%、80%、70%乙醇各脱苯10 min;蒸馏水缓慢冲洗5 min,2次;苏木素染细胞核15 min,蒸馏水缓慢冲洗;0.5%盐酸乙醇分色后,用蒸馏水缓慢冲洗15 min;70%和80%乙醇先后各浸泡10 min,复染伊红1 min,90%乙醇进行分化10 s;95%乙醇脱水2次,每次10 min,100%乙醇进行脱水2次,每次15 min,二甲苯透明3次,每次时间分别是10 min、15 min、15 min;中性树脂进行封片观察。
1.3.5 免疫组织化学法分析组织抗原表达 将组织从-86 ℃冰箱取出后使用磷酸溶液(PBS)缓冲液清洗8次,去掉坏死组织和血凝块。4%多聚甲醛于4 ℃固定24 h。PBS缓冲液清洗3次,再用30%、50%和70%乙醇依次清洗,脱水,石蜡包埋。1%聚乙二醇辛基苯基醚(triton-100)进行处理15 min,3%的H2O2进行处理15 min。5%羊血清封闭30 min后,依次孵育一抗及二抗。染色封片。
1.3.6 酶联免疫吸附测定(ELISA)检测炎症因子 取心脏组织,经液氮冻干研磨后收集组织样品,加1 mL PBS缓冲液混匀后低温离心机以4 000 r/min离心8 min,取上清液供实验使用。加样设置:分别设空白孔,标准品孔待测样品孔。酶标包被的板子上加标准品50 μL,先加入样品稀释液40 μL于待测样品孔,之后加待测样品10 μL。孵育:封板后置于37 ℃环境进行30 min孵育。液体配制:将30倍洗涤母液经蒸馏水稀释30倍保留备用。洗涤:缓慢揭掉封板膜,将液体弃去,甩干液体,每孔加洗涤液,放置30 s之后弃去,反复重复5次,拍干板子。加酶:每孔加酶标试剂50 μL,空白孔不加。孵育:再次封板后放37 ℃孵育30 min。洗涤:小心取掉封板膜,甩去液体,甩干液体,每孔加适量洗涤液,放置30 s之后弃去,反复重复5次,拍干板子。显色:各孔加入显色剂A液50 μL,再加显色剂B液50 μL缓慢震荡混匀后,37 ℃避光进行显色10 min。终止:各孔加入50 μL终止反应液,反应终止(终止后蓝色立即转为黄色)。测定:用空白孔进行调零,450 nm波长下依次测量每孔吸光值(OD值)。测定在加入终止液后的15 min内进行。
1.3.7 免疫印迹试验(Western Blot)检测细胞蛋白表达 收集各组大鼠组织细胞,经液氮冻干研磨后收集研磨组织,添加有终浓度为1 mmol/L蛋白酶抑制剂苯甲基磺酰氟(phenyl methanesulfonyl fluoride,PMSF)细胞裂解液进行裂解,提取各组细胞总蛋白。用聚氰
基丙烯酸正丁酯(BCA)试剂盒检测总蛋白浓度(具体检测按照试剂说明书进行),10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后用半干转膜仪转移蛋白质至PVDF膜。用5%脱脂牛奶室温封闭蛋白2 h,之后加入一抗于4 ℃封闭过夜,次日加入对应二抗室温封闭1 h,最后滴加电化学发光(ECL)曝光显影。SDS-PAGE凝胶电泳分离并转至PVDF膜,经5%牛血清白蛋白(BSA)封闭后依次孵育相应一抗和二抗。显色并统计灰度值计算相对表达量。
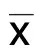
2 结 果
2.1 STAT3与miR-125a-5p之间靶向性 经过生物信息学技术预测STAT3 5′端与miR-125a-5p之间的序列差异表明,两者具有高度互补性,显示两者具有一定靶向关系;对HEK299细胞进行miR-125a-5p处理后发现,与STAT3 wt组比较,STAT3 wt+miR-125a-5p mimic组荧光亮度减少;STAT3 mut组和STAT3 mut+miR-125a-5p mimic组与STAT3 wt组比较,差异有统计学意义(P<0.01)。详见图1。

与STAT3 wt组比较,*P<0.01。
2.2 各组心肌细胞miR-125a-5p和STAT3表达水平 各组经过相应处理后,取心肌组织,经过组织总RNA提取,逆转录为cDNA后进行qRT-PCR测定发现:与sham组比较,I/R组miR-125a-5p异常升高而STAT3表达水平受到抑制;与I/R组比较,I/R+miR-125a-5p抑制组miR-125a-5p表达受到抑制,而STAT3表达水平上调。详见图2。

与sham组比较,*P<0.01;与I/R组比较,#P<0.01。
2.3 miR-125a-5p抑制后改善大鼠心肌I/R损伤 经组织切片HE染色发现,与sham组比较,I/R组心肌细胞排列不规则,边界模糊,细胞核溶解或消失,心肌细胞间隙增加,并伴有明显的炎症细胞浸润;与I/R组比较,I/R+miR-125a-5p抑制组细胞排列相对整齐,细胞边界逐渐清晰,细胞核基本正常,细胞间隙减小,浸润细胞明显减少。详见图3。

图3 HE染色后各组心肌细胞损伤情况
2.4 miR-125a-5p抑制后降低IL-6活性 各组大鼠经过相应处理后,取心脏组织经固定和石蜡包埋后切片,免疫组化染色检测炎症因子IL-6表达水平显示:与sham组比较,I/R组细胞IL-6表达水平增高;与I/R组比较,I/R+miR-125a-5p抑制组组织细胞IL-6表达水平明显下调。详见图4。
图4 免疫组化检测各组心肌细胞IL-6表达水平
2.5 miR-125a-5p抑制后降低细胞内氧化应激相关因子 ELISA检测心肌组织细胞氧化应激相关因子SOD、MDA和GSH结果显示:与sham组比较,I/R组组织细胞SOD和GSH表达水平降低,MDA表达水平升高;与I/R组比较,I/R+miR-125a-5p抑制组组织细胞SOD和GSH表达水平提高,MDA表达水平受到抑制。详见图5。
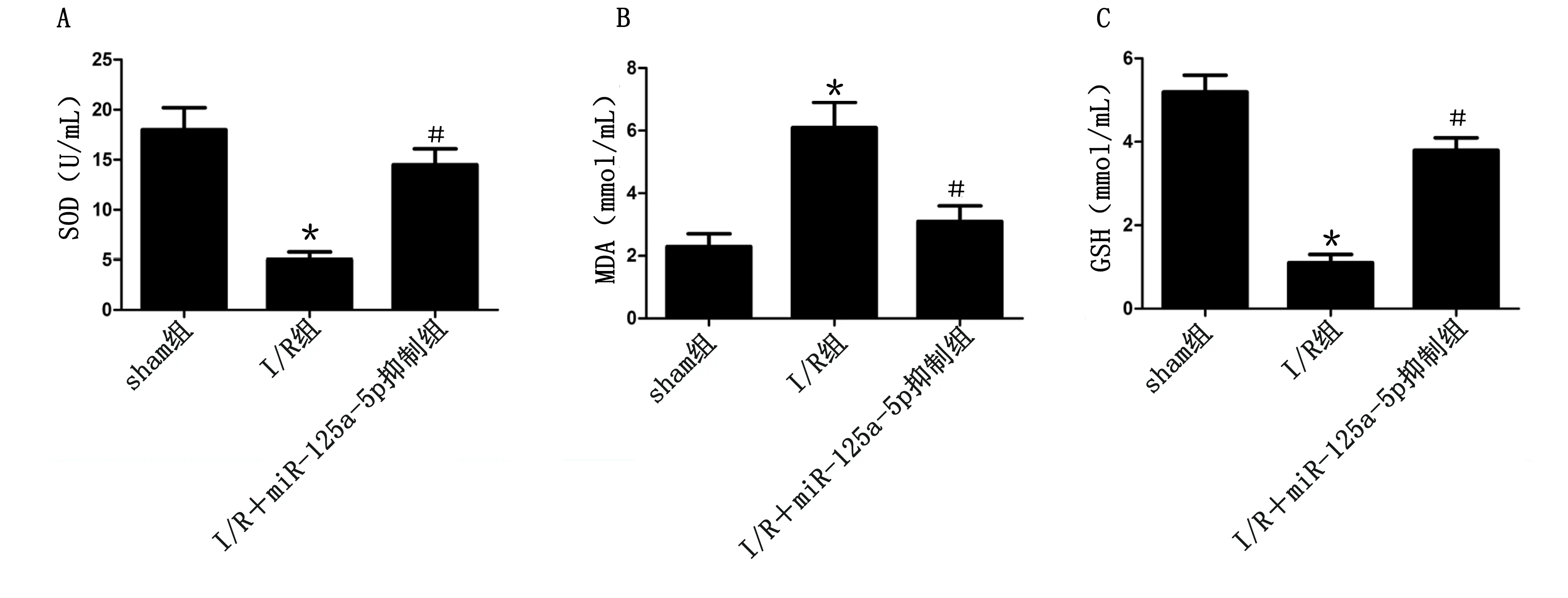
与sham组比较,*P<0.01;与I/R组比较,#P<0.01。
2.6 miR-125a-5p抑制后凋亡通路活性增强 Western Blot检测心肌组织细胞凋亡通路相关分子结果显示:与sham组比较,I/R组组织细胞内Bcl-2和STAT3表达水平降低,Bax表达水平升高;与I/R组比较,I/R+miR-125a-5p抑制组组织细胞Bcl-2和STAT3表达水平提高,而Bax表达水平受到抑制。详见图6。

与sham组比较, *P<0.01;与I/R组比较,#P<0.01。
3 讨 论
缺血性心脏病是一种致命性心脏疾病,导致严重公共卫生威胁[13-14]。根据世界卫生组织(WHO)数据显示,缺血性心脏病2012年已导致760万人死亡;缺血性心脏病将成为2030年全球农村和城市中第二大死亡因素[15]。治疗缺血性心脏病的唯一方式是恢复并促进冠状动脉血流再灌注,由此减少心肌细胞死亡并减少心肌功能紊乱的发生[16]。急速再灌注对心肌细胞造成较大损害,同样导致细胞死亡[17],其发生机制为再灌注导致心肌细胞产生大量氧自由基,促进心肌细胞凋亡发生[18]。本研究发现,大鼠经过I/R损伤后,心肌细胞产生大量氧自由基MDA,同时SOD和GSH等氧自由基清除分子表达水平下降。另一方面,发现凋亡通路相关蛋白表达水平增高,由此说明在I/R损伤中,大量产生的氧化自由基与心肌细胞凋亡密切相关。
miR-125是一类高度保守的miRNA家族,共3类同源物,包括:has-miR-125a,has-miR-125b-1和has-miR-125-2。该家族成员在多种疾病已证实明显下调,具有抑制疾病进展的作用;另一些相关疾病中具有促进疾病进展作用。同时miR-125可靶向一系列基因,如转录因子、基质金属蛋白酶、Bcl-2家族蛋白等,异常表达导致细胞异常增殖、转移和侵袭,甚至诱发肿瘤[19]。现有报道证实,miR-125a-5p被抑制后导致巨噬细胞对脂类物质摄取增加,并促进氧化低密度胆固醇受体-1的表达[20]。本研究结果发现,与正常大鼠心肌组织细胞比较,大鼠心肌细胞经过I/R损伤后,细胞内miR-125a-5p表达水平增高。说明miR-125a-5p在大鼠I/R损伤后发挥重要机制。
本研究I/R损伤细胞内除发现miR-125a-5p表达异常升高之外,同时发现STAT3表达受到抑制,推测miR-125a-5p可能与STAT3之间具有某种联系。根据生物信息学分析发现,两者之间具有较强的靶向关系;进一步通过荧光素酶实验验证这种猜测。有研究证实,miR-125a-5p可靶向STAT3,进而抑制甲状腺功能衰退发生[21]。本研究发现,对I/R损伤大鼠进行miR-125a-5p抑制剂使用后,不但有效降低I/R损伤细胞miR-125a-5p表达量,同时下调STAT3表达水平。因此推测,在I/R损伤大鼠心肌细胞内,miR-125a-5p可有效靶向STAT3,促使细胞STAT3表达水平下调。
本研究发现,在I/R损伤细胞中氧化应激产物MDA高表达,SOD和GSH等强还原分子表达水平受到抑制;另一方面,心肌组织细胞炎症因子IL-6表达水平增高;同时伴有心肌组织细胞严重凋亡。有文献报道,IL-6可抑制STAT3表达水平,进而抑制细胞凋亡的发生[22]。因此推测,大鼠心肌细胞I/R损伤后,造成IL-6高表达,从而抑制STAT3表达,进一步促进细胞凋亡发生。利用miR-125a-5p抑制剂对I/R损伤大鼠处理后发现,心肌组织细胞IL-6表达水平有效下调,且STAT3上调后伴有细胞凋亡抑制。说明miR-125a-5p抑制剂可有效解除STAT3对心肌细胞促凋亡的作用。
综上所述,miR-125a-5p抑制剂可有效解除对STAT3表达的抑制,进一步降低Bax/Bcl-2表达,降低心肌细胞凋亡水平;同时降低细胞内氧化应激产物MDA,增强SOD和GSH表达水平。这种保护作用与miR-125a-5p和STAT3相互作用具有一定的相关性。因此,靶向miR-125a-5p在大鼠心肌I/R损伤中具有重要意义。但涉及microRNAs调控通路复杂,明确具体信号转导机制并选择性阻断关键分子可为解释心肌I/R损伤机制提供理论指导。
